双氢青蒿素通过抑制角质形成细胞的增殖和促炎因子的产生改善小鼠银屑病样皮肤炎症①
2020-04-13金权鑫金琳博李芳芳李红花孟繁平金桂花
魏 强 金权鑫 金琳博 于 然 李芳芳 李红花 金 丹 孟繁平 金桂花
(延边大学医学院免疫学与病原生物学教研室,延吉 133002)
银屑病是皮肤科常见的四大顽固性疾病之一,其病理改变主要为表皮的角化过度或角化不全,角质形成细胞的过度增殖,临床表现为皮肤的红斑、鳞屑,常伴有全身症状且易复发,严重影响患者身心健康与生活质量[1]。银屑病的发病与遗传、感染、环境和免疫等多重因素相关[2,3]。近来研究证实,IL-23/Th17轴在银屑病发生发展中起重要作用[4]。目前,针对IL-23/Th17轴的药物如Brodalumab、Ustekinumab等对中重度银屑病患者表现出良好的疗效,但停药后容易复发[5,6]。
青蒿素是从菊科植物黄花蒿花蕾及叶中提取的一种具有高效抗疟疾活性的中药单体[7],双氢青蒿素(Dihydroartemisinin,DHA)是其衍生物之一。近年来研究发现,DHA在多种自身免疫性疾病(如系统性红斑狼疮、狼疮肾炎等)中表现出较强的抗炎作用,且具有作用位点广、毒性低等优点[8,9]。我们的前期工作显示,DHA可明显抑制HaCaT细胞所分泌的IL-17A和IL-23等细胞因子的表达,提示DHA可能通过IL-23/Th17轴影响银屑病的发生和发展[10]。近来研究证实,Th17分泌的细胞因子(IL-17、IL-22等)能够作用于角质形成细胞使其过度增殖,且分泌大量的促炎性介质,同时这些促炎性介质能够刺激免疫细胞的活化,构成维持银屑病皮肤炎症的恶性循环[11-13]。基于以上研究背景我们提出DHA基于IL-23/Th17轴影响角质形成细胞从而干预银屑病发生和发展的可能性。因此,本实验拟通过建立咪喹莫特诱导的小鼠银屑病模型,初步探讨DHA是否通过影响角质形成细胞抑制银屑病的发生和发展,旨在为寻找新的治疗银屑病药物提供实验依据。
1 材料与方法
1.1材料
1.1.1动物 8~10周龄BALB/c雌性小鼠购自延边大学动物实验中心,实验动物使用和操作严格遵循延边大学动物实验管理委员会相关规定。
1.1.2主要试剂 DHA购自中国食品药品检定研究院;咪喹莫特乳膏购自美国3M Health Care Limit公司;羧甲基纤维素钠(Carboxymethylcellulose sodium,CMC)购自美国Amresco公司;兔抗鼠NF-κB(p65)、p-p38、p38、p-ERK,ERK一抗购自CST公司;IL-1β、IL-6、IL-18及CXCL-1 ELISA检测试剂盒购自江苏酶标生物科技有限公司。
1.2实验方法
1.2.1小鼠银屑病模型的建立 8~10周龄雌性BALB/c小鼠剔除背部毛发,随机分成正常组、模型组、DHA低剂量组[25 mg/(kg·d)]和DHA高剂量组[50 mg/(kg·d)]。将62.5 mg咪喹莫特乳膏连续涂抹小鼠背部皮肤6 d构建银屑病动物模型,对照组给予同等剂量凡士林处理。DHA在咪喹莫特处理前1 h灌胃。每天观察小鼠状态,称体重,根据银屑、红斑、皮肤增厚对各组小鼠进行PASI临床评分。
1.2.2小鼠皮肤组织病理检测 第6天处死小鼠,取小鼠的皮肤组织用10%甲醛固定并制成石蜡切片,HE染色观察小鼠的皮肤组织病理变化。
1.2.3免疫组化 取小鼠皮肤组织,制作石蜡切片经脱蜡,柠檬酸缓冲液高温高压进行抗原修复后,加入3%过氧化氢阻断内源性过氧化物酶,PBS清洗,室温封闭30 min,加入1∶1 000 Anti-Ki67抗体于4℃避光孵育过夜,PBS清洗,二抗室温孵育30 min,DAB染色,苏木素复染。光镜下观察各组小鼠皮损表皮基底层中Ki67阳性表达情况。
1.2.4ELISA 取第3天和第6天小鼠皮肤组织,以1∶9 的比例将皮肤组织加入PBS中研磨并提取上清,实验操作按ELISA试剂盒说明书进行。简述如下,将待测样品及标准品加入96孔板内,加入一抗工作液,37℃孵育1 h,去除板内液体,再次充分洗涤5次,加入显色剂避光显色15 min后,加入终止液,在450 nm处测吸光值。
1.2.5蛋白免疫印迹法 以1∶10的比例将皮肤组织加入蛋白裂解液中研磨并提取蛋白,再向提取的蛋白中加入含有DTT的上样缓冲液煮沸变性,等量蛋白经10%SDS-PAGE凝胶电泳后转至PVDF膜,加入5%脱脂牛奶室温封闭1 h,加入适宜浓度一抗4℃封闭过夜,次日洗去未结合一抗,加入辣根过氧化物酶标记的二抗,加入化学发光显色液曝光显影。
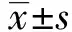
2 结果
2.1DHA改善IMQ诱导的小鼠银屑病皮肤炎症反应 DHA治疗6 d后观察各组小鼠背部皮肤变化。与模型组相比,DHA治疗组小鼠皮肤红斑、银屑显著减少,皮肤增厚明显缓解,以DHA高剂量组更为显著,并且DHA处理组PASI评分明显低于模型组,具有统计学意义(P<0.05)(图1A、B)。HE染色结果显示,相对于模型组,DHA治疗组小鼠皮肤中表皮层明显变薄且钉状凸起明显缩短,角化不全减少,伴随炎性细胞浸润减轻,并且DHA高剂量组Munro微脓肿消失(图1C)。以上结果提示,DHA可以明显缓解咪喹莫特诱导的小鼠银屑病样皮肤炎症。
2.2DHA抑制银屑病小鼠皮肤中角质形成细胞的过度增殖 使用免疫组织化学染色方法检测各组小鼠皮肤中Ki67阳性表达情况。如图2所示,与对照组相比,模型组Ki67阳性细胞数目明显增加,而给药组的Ki67阳性细胞数量明显少于模型组。以上结果提示,DHA能够抑制银屑病小鼠皮肤角质形成细胞的过度增殖。
2.3DHA抑制银屑病样小鼠皮损中角质形成细胞所分泌的细胞因子和趋化因子的表达 DHA处理后的第3天和第6天取小鼠皮损组织,经ELISA法检测组织上清中的细胞因子与趋化因子的表达。如图3所示,模型组小鼠在第3天和第6天皮肤上清液中IL-1β、IL-18、IL-6、CXCL-1表达明显上升,但是经过不同浓度DHA治疗后,表达明显下降,并且具有统计学意义(P<0.05)。有趣的是,第6天高剂量组IL-6的表达无统计学意义。以上结果提示,DHA能够抑制角质形成细胞所分泌的促炎性细胞因子和趋化因子的产生。
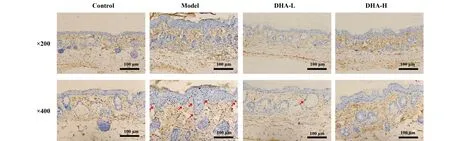
图2 DHA抑制银屑病小鼠皮肤中角质形成细胞的增殖Fig.2 DHA inhibited proliferation of keratinocytesin in psoriasis-like skin lesionsNote: Immunohistochemical images of keratinocytes proliferation in mice skin.Red arrow mean Ki67 positive cell.Scale bar=100 μm.
图3 DHA抑制银屑病样小鼠皮损中角质形成细胞所分泌的细胞因子和趋化因子的表达Fig.3 DHA inhibited expression of inflammatory cytokines in psoriasis-like skin lesionsNote: ELISA was performed to determine levels of IL-1β,IL-18,IL-6 and CXCL-1 in skin tissue.#.P PP PP P

图4 DHA抑制银屑病样小鼠皮肤中NF-κB(p65)、p-p38和p-ERK的表达Fig.4 DHA inhibited expression of NF-κB(p65),p-p38 and p-ERK in psoriasis-like skin lesionsNote: Protein levels of NF-κB(p65),which in nuclear,p-p38,p-ERK,p38 and ERK in the skin of mice.β-actin was used to confirm equal amount of protein.###.P PP P
2.4DHA抑制银屑病样小鼠皮肤中NF-κB(p65)、p-p38和p-ERK的表达 经蛋白印迹试验检测DHA给药后皮损中NF-κB和MAPK信号通路的表达变化。如图4所示,与正常组相比,模型组小鼠皮肤中NF-κB(P65)、p-p38和p-ERK水平增加,加入DHA后,低剂量组和高剂量组均能显著抑制NF-κB(p65)和p-p38水平,但只有在高剂量组时,p-ERK的表达降低,差异具有统计学意义(P<0.05)。以上结果说明DHA可能通过抑制NF-κB和MAPK信号通路,缓解咪喹莫特诱导的银屑病样皮肤炎症。
3 讨论
本研究结果显示,DHA可以显著缓解咪喹莫特诱导的小鼠银屑病样皮肤炎症反应。最近研究证实,银屑病皮损中角质形成细胞在Th17细胞所分泌炎症细胞因子IL-17和IL-22的刺激下,细胞内的Nrf2和Keap1分离,而分离后的Nrf2磷酸化转移到细胞核,在那里与角质形成细胞的角蛋白K6、K16和K17结合并上调它们的表达,导致角质形成细胞的增殖[14]。Li等[15]证明橘皮苷通过抑制角质形成细胞中的IRS-1Ser312的磷酸化以及p-ERK的表达,明显抑制银屑病样皮肤炎症中角质形成细胞的增殖,进而改善银屑病样皮肤炎症反应。此外研究发现,瞬时感受器电位香草酸受体Ⅰ型(TRPV1)基因敲除小鼠能够明显抑制银屑病皮损中角质形成细胞的增殖以及炎性细胞的浸润,进而改善银屑病样皮肤炎症反应[16]。本研究结果显示,相对于模型组,DHA处理组小鼠皮损中Ki67阳性细胞的数量明显减少。以上结果提示,DHA通过抑制角质形成细胞的增殖缓解银屑病的可能性。
角质形成细胞受到促炎性细胞因子(如IL-17、IL-22和IFN-γ等)刺激时,跨膜信号转导蛋白PlexinB2表达上升,活化NLRP3炎症小体,导致角质形成细胞分泌大量促炎性细胞因子和趋化因子,包括IL-1β、IL-18、CXCL-1和CCL-20等[13]。这些细胞因子和趋化因子在银屑病的发生发展中起到重要的作用。Cai等[17]发现在银屑病皮损中IL-1β能够协同IL-23促进γδT细胞增殖,进而产生大量的IL-17。相关研究显示,在银屑病中IL-18能与Th1细胞表面的IL-18R结合,进而促进IFN-γ的产生[18]。此外,IL-6与T细胞膜表面的IL-6受体gp130结合,通过STAT3通路刺激Th17细胞活化[19]。趋化因子CXCL-1能够与中性粒细胞表面受体CXCR2结合,使其浸润至皮肤组织引起皮肤银屑病样炎症反应[20]。近来研究表明,TRPV1的缺失能明显抑制银屑病小鼠皮肤中IL-1β、IL-6、IL-23和S100A8的表达,进而缓解小鼠银屑病样皮肤炎症反应[16]。同时,发现抗坏血酸衍生物DDH-1通过抑制咪喹莫特诱导的小鼠银屑病样皮肤中炎性细胞因子IL-1β和TNF-α的表达,改善小鼠银屑病样皮肤炎症[21]。本研究结果显示,与模型组相比,第3天和第6天DHA治疗组小鼠皮肤中细胞因子IL-1β、IL-18、IL-6和趋化因子CXCL-1的表达水平明显降低。以上结果提示,DHA能够减少角质形成细胞分泌的促炎性细胞因子和趋化因子的产生。
NF-κB是细胞内的一个重要转录因子,它的激活可诱导一些炎症细胞因子释放,在调控免疫反应和炎症反应中具有重要作用[22]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)则是一种丝氨酸苏氨酸蛋白激酶,当细胞受到胞外刺激时通过酶的级联反应把信号传递至核内,并通过调控下游的转录因子,从而调控多种细胞因子的表达,对调控炎症反应起着关键性作用[23]。最近研究表明,皮肤组织中角质形成细胞受到刺激时,NF-κB和MAPK信号通路被激活,导致角质形成细胞过度增殖并分泌大量的细胞因子,进而促进银屑病的发生和发展[13,24,25]。同时研究表明,低剂量羟氯喹和青蒿素的联合应用通过调节NF-κB的表达水平,改善系统性红斑狼疮导致的脾脏和肾脏的损伤[26]。本研究结果显示,DHA处理后可显著抑制小鼠皮损组织中NF-κB(p65)、p-p38和p-EKR的表达。以上结果表明,给予DHA可以显著抑制NF-κB和MAPK信号通路的激活,提示DHA的抗炎作用可能与NF-κB和MAPK信号通路有关。
综上所述,DHA改善咪喹莫特诱导的小鼠银屑病样皮肤炎症反应,其可能机制是通过MAPK/NF-κB信号通路抑制角质形成细胞的过度增殖及其所分泌的细胞因子。DHA表现出来的较强的抗炎作用,使其有望成为一种新型的抗银屑病药物。
