Tim-3及其配体Galectin-9在宫颈癌患者中的表达及意义①
2020-04-13薛茜文赵雅文张旭娟陈志芳
董 頔 杜 蓉 薛茜文 赵雅文 张旭娟 杨 艳 陈志芳
(新疆医科大学第一附属医院,乌鲁木齐 830054)
宫颈癌是女性中第二常见的生殖道恶性肿瘤。中国每年的新增病例约占全球病例的四分之一,且呈年轻病例逐年增加的趋势[1]。目前,宫颈癌的致病原因主要与人乳头瘤病毒(human papilloma virus,HPV)感染有关,但随着肿瘤免疫学的发展,对宫颈癌发病机制的研究也在逐渐深入,其中肿瘤的免疫逃逸机制是目前的一大热点[2]。近年来,Tim家族作为一类参与调解机体免疫的关键分子引起大家的重视[3-5]。Tim-3是在T细胞表面上表达的抑制性受体,在抑制T细胞对肿瘤的反应至关重要[6]。半乳糖凝集素9(Galectin-9)已被鉴定为Tim-3的配体,半乳糖凝集素9与Tim-3的结合导致T细胞的凋亡和T细胞免疫的负调节[7]。许多研究支持阻断Tim-3/Galectin-9途径可能具有恢复人类癌症中肿瘤浸润淋巴细胞功能的潜力[8-11]。由于目前关于Tim-3和Galectin-9与宫颈癌之间关系的研究尚不清楚,所以我们通过分析Tim-3和Galectin-9在宫颈癌组织、宫颈上皮内瘤变(cervical intraepi-thelial neoplasia,CIN)组织和正常宫颈组织中的表达以及宫颈癌患者的临床指标之间的关联来判断Tim-3和Galectin-9在宫颈癌发病过程中的作用。
1 资料与方法
1.1资料 我们选择了2016年5月至2019年2月新疆医科大学第一附属医院妇科住院行手术治疗或病理活检的宫颈癌患者的宫颈组织石蜡标本52例,CIN患者的宫颈组织石蜡标本30例,正常对照组为良性子宫肌瘤行子宫全切患者的正常宫颈25例,其中宫颈癌患者按2018 NCCN指南分期,年龄35~60岁,平均(49.3±6.07)岁,CIN患者年龄27~55岁,平均(48.5±6.13)岁,正常组年龄45~65岁,平均(51.3±5.15)岁,差异无统计学意义(P>0.05)。所有病理切片均经两名病理专家会诊确诊。宫颈癌患者中34例无淋巴结转移,18例有淋巴结转移;病理分化程度:高分化5例,中分化17例,低分化20例,分化程度不明10例。排除标准:糖尿病史、高血压、心血管疾病、妊娠、急性或慢性传染病、转移性肿瘤及术前行放、化疗的宫颈癌患者。本研究经新疆医科大学第一附属医院伦理委员会审批通过,研究对象均签署知情同意书。见表1。
1.2方法
1.2.1采用qRT-PCR检测宫颈癌组、CIN组、正常组组织样本中Tim-3和Galectin-9的表达 取各组组织样本106~107的细胞,用磷酸缓冲盐溶液(PBS,购自中杉金桥,pH值7.4)清洗细胞,去PBS后加1 ml的RNA抽提试剂采用酸性酚抽提法(TRIzol Reagent,购自ThermoFisher公司)抽提组织样本总RNA,经一步法反转录试剂盒(购自TaKaRa公司)进行反转录PCR后,采用QuantiNova SYBR Green PCR Kit试剂盒(购自QIAGEN公司),以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,以正常组作为参照物,循环参数设定为95℃ 15 min,95℃15 s,60℃ 15 s,72℃ 35 s,连续40个循环。每份标本重复2次,所有的qRT-PCR产物均经熔解曲线分析以分辨目的产物与非特异产物及引物二聚体。用Michael推导的数学公式2-ΔΔct来计算目的基因的相对表达量。其中RT-PCR引物序列如下。Tim-3正义链:5′-AGG CAG CAA CCC TCA CAA-3′;反义链:5′-CCC AGT TCA ATT CCC ATG-3′,产物长度200 bp。Galectin-9正义链:5′-ACC AGG TTT GCT GTG AAC T-3′;反义链:5′-CCA CGT ACC CTC CAT CTT-3′,产物长度91 bp。GAPDH正义链:5′-TGT TGC CAT CAA TGA CCC CTT-3′;反义链:5′-CTC CAC GAC GTA CTC AGC G-3′,产物长度202 bp。
1.2.2采用免疫组织化学法检测宫颈癌组、CIN组、正常组组织样本中Tim-3和Galectin-9的表达 石蜡切片逐级脱蜡至水,磷酸盐缓冲液洗5 min×3次;切片置于枸橼酸缓冲液(购自中杉金桥,pH值6.0)中,微波加热95℃进行抗原修复12 min;待其自然冷却至室温后,磷酸盐缓冲液洗5 min×3次,滴加过氧化酶(通用二步法试剂盒PV6000)阻断、室温下孵育10 min;滴加封闭血清购自中杉金桥,室温下孵育40 min;除去血清,分别滴加一抗Tim-3(Rabbit Anti- Tim 3 Polyclonal Anti-body购自BIOSS,1∶100)、Galectin-9(Rabbit Anti-Galectin-9 Polycl-onal Antibody购自BIOSS,1∶100),4℃过夜;冰箱内取出后,室温静置1 h,磷酸盐缓冲液洗5 min×3次,滴加二抗(通用二步法试剂盒PV6000),室温下孵育30 min;磷酸盐缓冲液洗5 min×3次,DAB显色,自来水冲洗;苏木素(中杉金桥)复染;脱水、透明、中性树胶封片,光镜下观察。应用彩色图像分析系统(Image.Pro Plus 6.0,美国Media Cybernetics公司)进行图像分析:吸光度校正,在HIS颜色模式下选中染色阳性区域,过滤背景干扰,测定每个视野的累积吸光度(integral optical density,IOD)值及阳性区域面积(area)值。每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性区域的IOD值和area值,计算平均光密度值MOD=IOD/area,以每组所有视野的MOD值的平均值作为该组的测量值。
表1 宫颈癌组患者临床特征
Tab.1 Clinical characteristics of cervical cancer patients
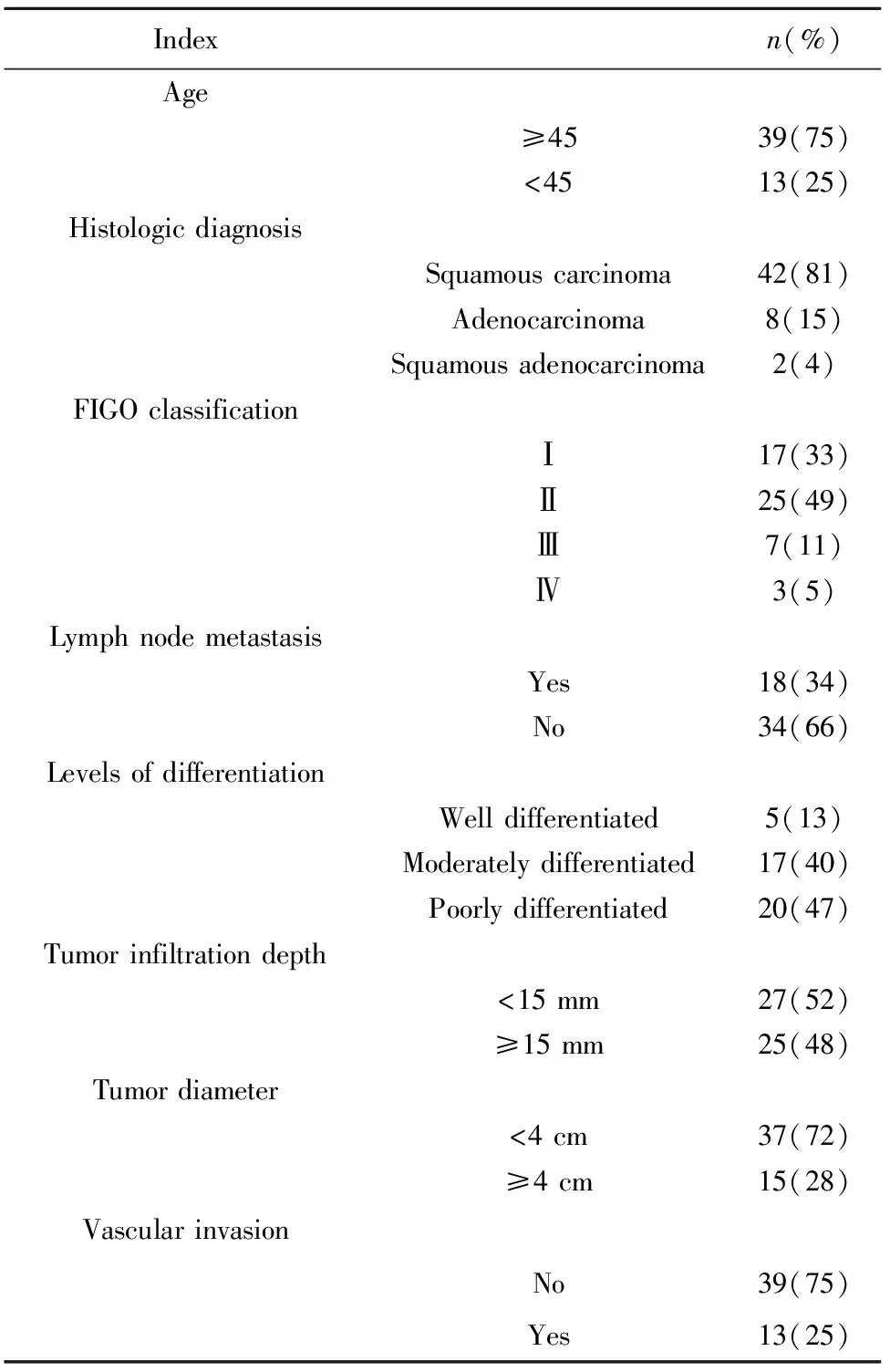
Indexn(%)Age≥4539(75)<4513(25)Histologic diagnosisSquamous carcinoma42(81)Adenocarcinoma8(15)Squamous adenocarcinoma2(4)FIGO classificationⅠ17(33)Ⅱ25(49)Ⅲ7(11)Ⅳ3(5)Lymph node metastasisYes18(34)No34(66)Levels of differentiationWell differentiated5(13)Moderately differentiated17(40)Poorly differentiated20(47)Tumor infiltration depth<15 mm27(52)≥15 mm25(48)Tumor diameter<4 cm37(72)≥4 cm15(28)Vascular invasionNo39(75)Yes13(25)
2 结果
2.1三组宫颈组织qRT-PCR检测结果 qRT-PCR结果显示,宫颈癌组和CIN组的组织样本中Tim-3和Galectin-9的表达均比对照组高,差异具有统计学意义(P<0.05);宫颈癌的组织样本中Tim-3和Galectin-9的表达比CIN组高,差异具有统计学意义(P<0.05)见表2。
2.2Tim-3和Galectin-9的mRNA表达水平与宫颈癌临床特征的关系 宫颈癌组织中Tim-3和Galectin-9的mRNA表达水平与FIGO分期(P<0.05)、分化程度(P<0.05)和有无淋巴结转移(P<0.05)均明显相关。但在不同年龄组间、病理分型、浸润深度、肿瘤大小和脉管侵犯中比较,差异无统计学意义(P>0.05)。见图1、2。
2.3三组宫颈组织中Tim-3和Galectin-9免疫组化表达结果 宫颈癌组织中,Tim-3和Galectin-9的阳性反应信号均为棕褐色(图3)。Tim-3主要在癌细胞中可见褐色着色,且在少数细胞也可见胞核着色;Galectin-9主要在癌中褐色着色。宫颈癌组织中Tim-3的MOD值显著高于CIN组和正常组(P<0.05),CIN组织中Tim-3的MOD值显著高于正常组(P<0.05)。宫颈癌组织中Galectin-9的MOD值显著高于CIN组和正常组(P<0.05),CIN组织中Galectin-9的MOD值显著高于正常组(P<0.05)。见表3。
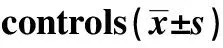

GroupsnmRNATim-3Galectin-9Cervical cancer52 28.43±15.501)2) 41.78±17.801)2)CIN3010.41±5.171)20.40±7.601)Control251.27±0.321.31±0.41
Note:1)P<0.05 compared with control group;2)P<0.05 compared with CIN group.
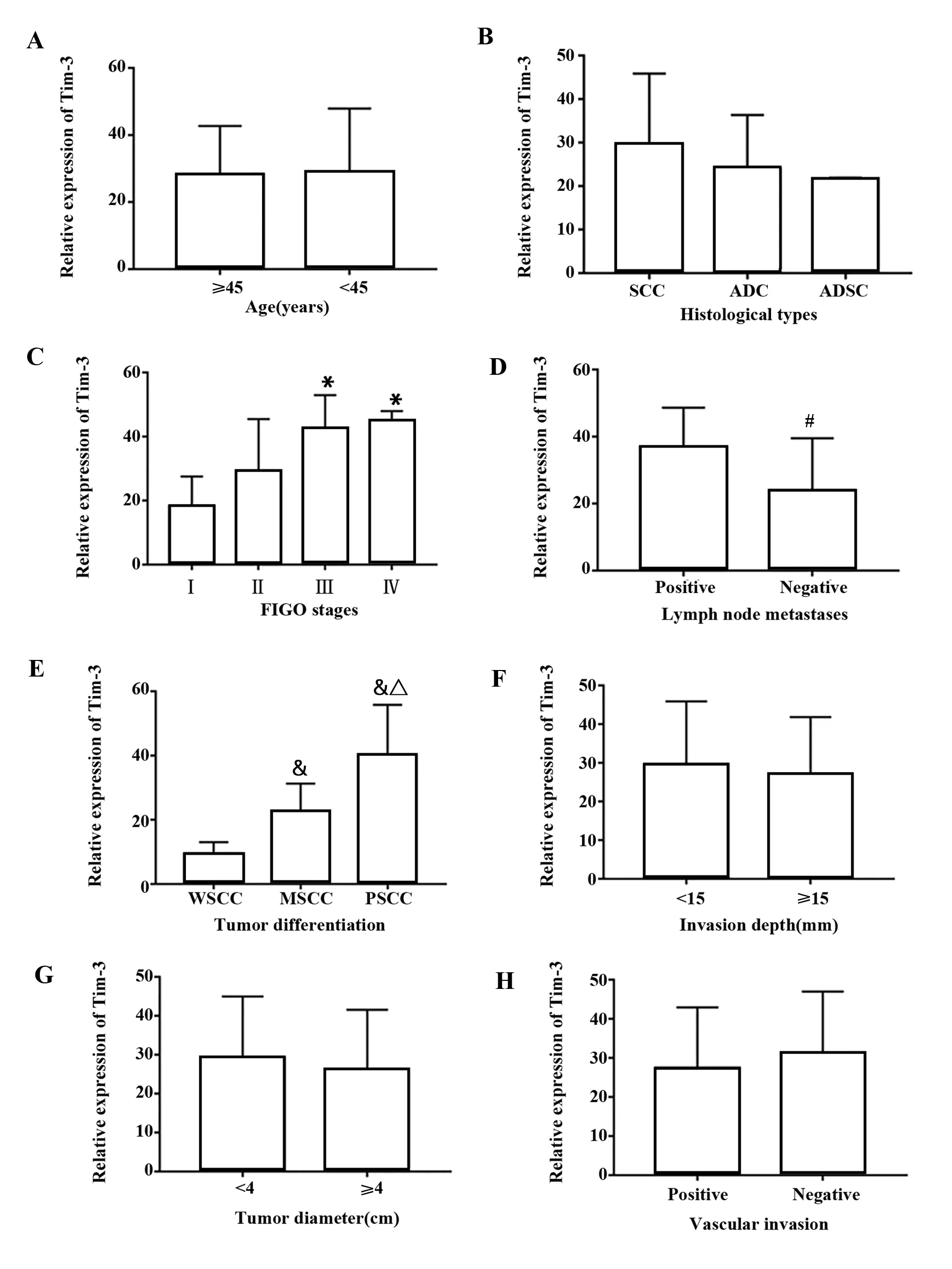
图1 Tim-3的mRNA表达水平与宫颈癌临床特征的关系Fig.1 Relationship between expression level of Tim-3 and clinical features of cervical cancerNote:A.Age;B.Histological types;C.FIGO stages;D.Lymph node metastasis;E.Tumor dierentiation;F.Invasion depth;G.Tumor diameter;H.Vascular invasion.Compared with the FIGO Ⅰ stage,*.P PP P
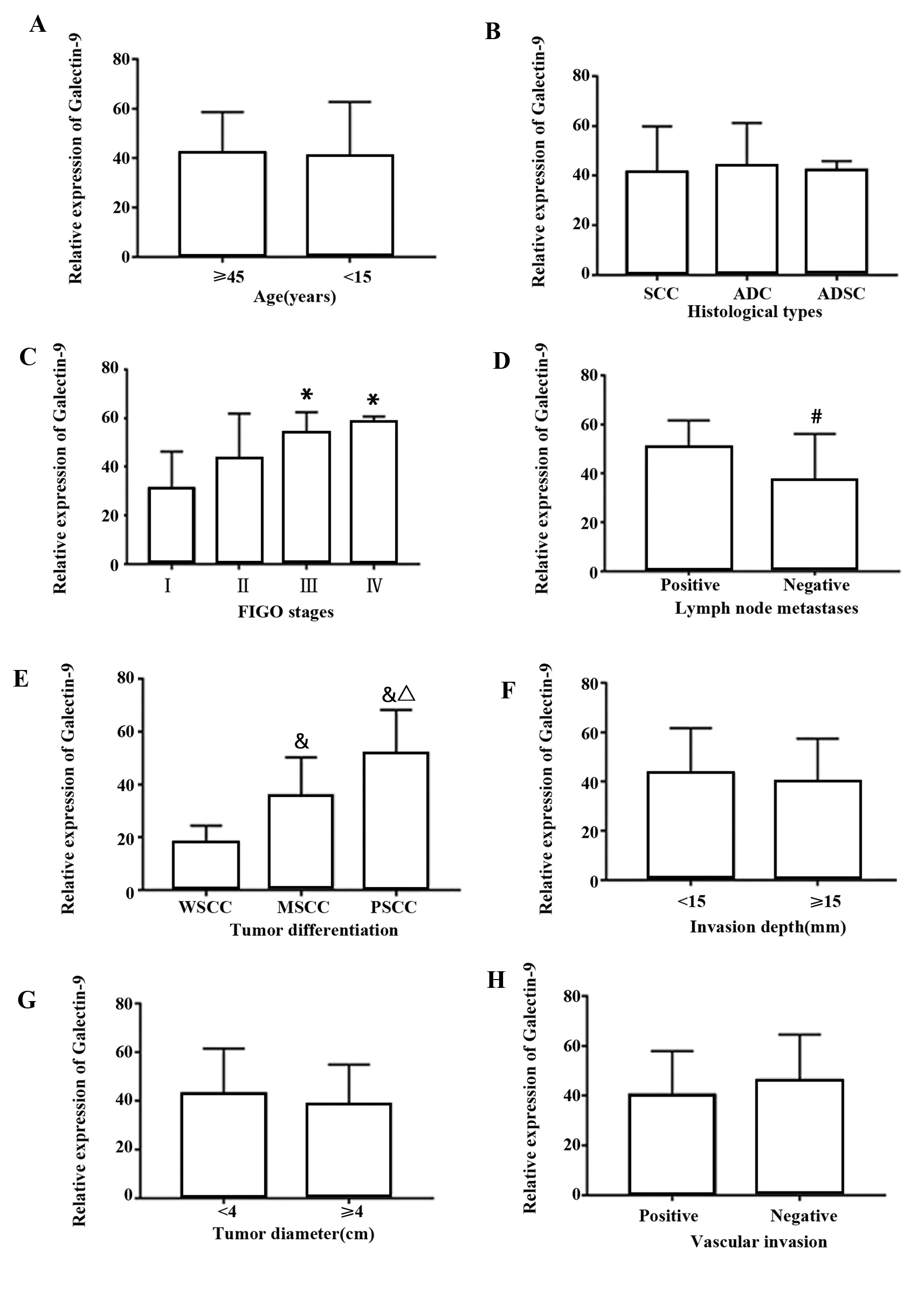
图2 Galectin-9的mRNA表达水平与宫颈癌临床特征的关系Fig.2 Relationship between expression level of Galectin-9 and clinical features of cervical cancerNote:A.Age;B.Histological types;C.FIGO stages;D.Lymph node metastasis;E.Tumor differentiation;F.Invasion depth;G.Tumor diameter;H.Vascular invasion.Compared with the positive lymph node metastasis,#.P PP
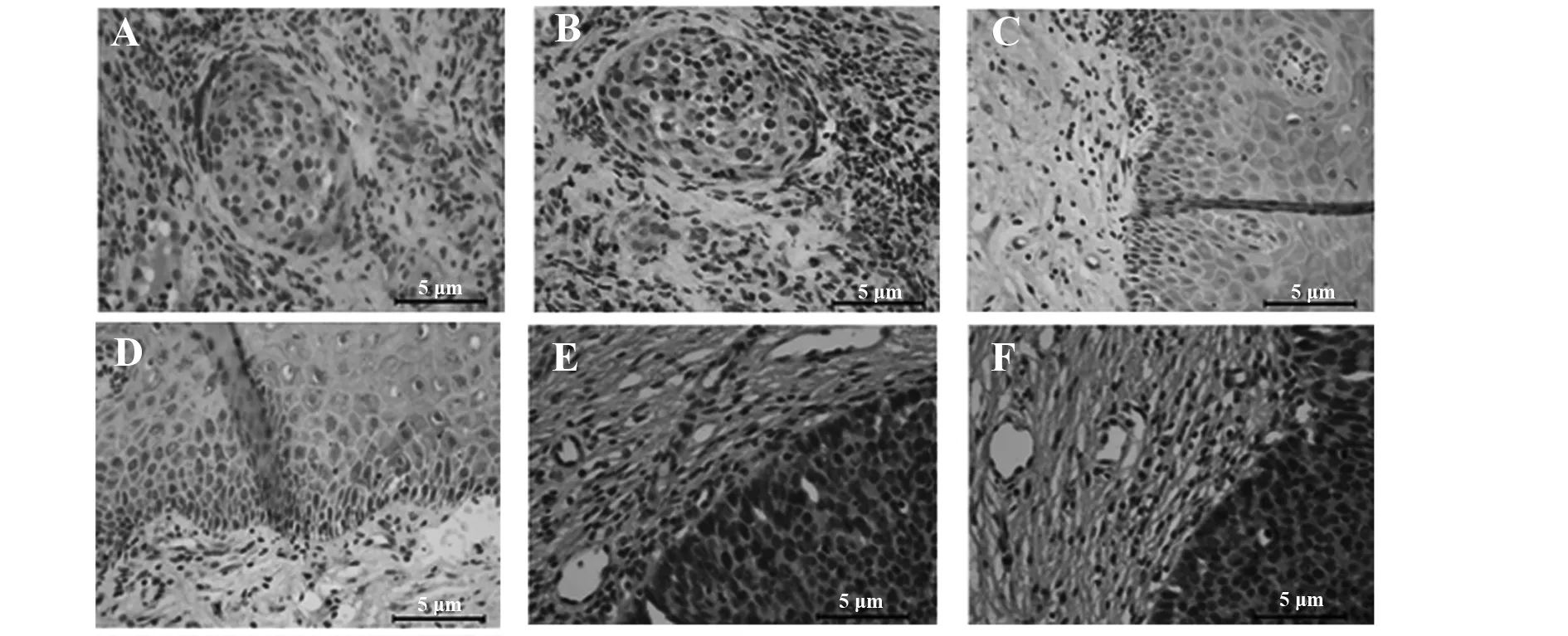
图3 宫颈癌组、CIN组和正常对照组Tim-3及Galectin-9免疫组化染色(×400)Fig.3 IHC of Tim-3 and Galectin-9 in the tissue of cervi-cal cancer patients,CIN patients and normal contr-ols(×400)Note:A.IHC of Tim-3 in the tissue of cervical cancer patients;B.IHC of Galectin-9 in the tissue of cervical cancer patients;C.IHC of Tim-3 in the tissue of CIN patients;D.IHC of Galectin-9 in the tissue of CIN patients;E.IHC of Tim-3 in the tissue of normal controls;F.IHC of Galectin-9 in the tissue of normal controls.
表3 宫颈癌组、CIN组和正常组Tim-3和Galectin-9的MOD值
Tab.3 MOD of Tim-3 and Galectin-9 in tissue of cervical cancer patients,CIN patients and normal controls
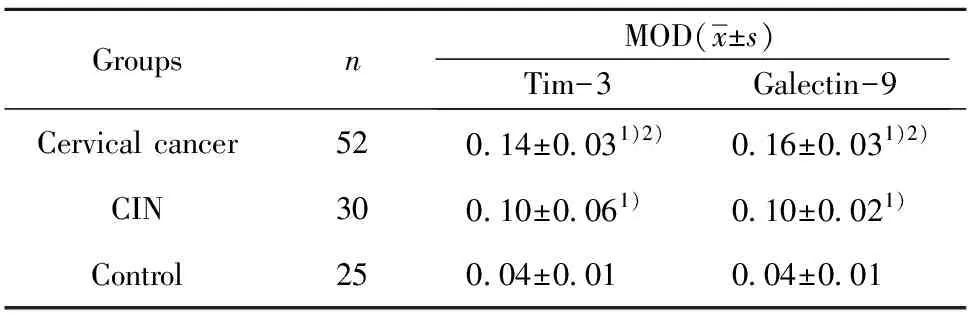
GroupsnMOD(x±s)Tim-3Galectin-9Cervical cancer520.14±0.031)2)0.16±0.031)2)CIN300.10±0.061)0.10±0.021)Control250.04±0.010.04±0.01
Note:1)P<0.05 compared with control group;2)P<0.05 compared with CIN group.

图4 Tim-3的MOD值与宫颈癌临床特征的关系Fig.4 Relationship between MOD of Tim-3 and clinical features of cervical cancerNote:A.Age;B.Histological types;C.FIGO stages;D.Lymph node metastasis;E.Tumor differentiation;F.Invasion depth;G.Tumor diameter;H.Vascular invasion.Compared with the ADSC,◇.P PP PP P
2.4Tim-3和Galectin-9的组织学表达与宫颈癌临床特征的关系 在宫颈癌组织中,Tim-3和Galectin-9的表达水平在不同年龄间和浸润深度比较,差异均无统计学意义(P>0.05);而在FIGO分期(P<0.05)、病理分型(P<0.05)、组织病理分化程度(P<0.05)和有无淋巴结转移(P<0.05)均明显相关,见图4、5。
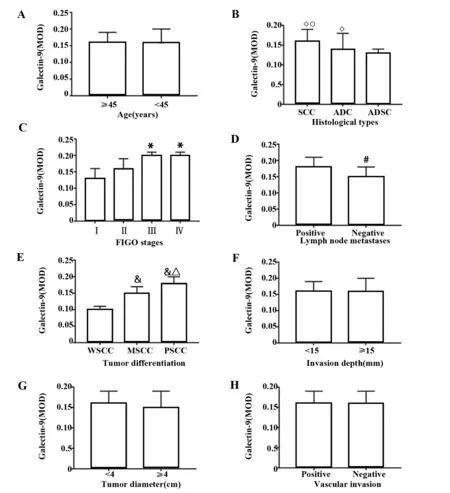
图5 Galectin-9的MOD值与宫颈癌临床特征的关系Fig.5 Relationship between MOD of Galectin-9 and clini-cal features of cervical cancerNote:A.Age;B.Histological types;C.FIGO stages;D.Lymph node metastasis;E.Tumor differentiation;F.Invasion depth;G.Tumor diameter;H.Vascular invasion.Compared with the ADSC,◇.P PP PP P
3 讨论
近年来,针对肿瘤免疫逃逸机制进行的癌症免疫疗法取得了令人瞩目的临床效果[12,13]。通过免疫疗法对抗癌症已经改变了对一些患者的治疗,并且针对诸如CTLA-4和PD-1的免疫检查点分子的疗法已经在黑色素瘤、肾癌、霍奇金病和肺癌中实现了持久的反应[14-17]。然而,这些治疗的成功率很低,并且包括结肠直肠癌在内的大量癌症在很大程度上仍然很难通过阻断CTLA-4和PD-1达到治愈[18]。这为寻找其他抑制性途径提供了动力,通过阻断这些抑制性途径可用于增强当前免疫治疗剂的应答率并实现针对癌症有效的免疫疗法。Tim-3及其配体Galectin-9已显示在传染病和肿瘤免疫等的小鼠模型中介导免疫耐受[19-21]。除了以上关于Tim-3在疾病的报道,Shen等[22]首次证实了Tim-3在小细胞肺癌患者肿瘤细胞中的表达,并且揭示了Tim-3作为小细胞肺癌患者的独立预后因素的重要作用。Tim-3在前列腺癌、肾癌、急性白血病及黑色素瘤等多种癌组织中呈强阳表达[23-26]。
qRT-PCR结果显示Tim-3在宫颈癌组织中的表达高于CIN组,并明显高于正常组,表明Tim-3的表达可能与宫颈病变恶性程度相关。同时免疫组化结果显示,宫颈癌组织中Tim-3的MOD值明显高于CIN组和正常组。说明Tim-3在宫颈癌组织中表达,且在宫颈癌发生过程中可能起着重要作用,关于其作用机制尚需进一步研究。对Tim-3的特异性配体Galectin-9的表达进行进一步研究。Galectin-9是Tim-3的主要配体,与Tim-3一同在抗肿瘤免疫中起着重要的负向调控作用[26]。qRT-PCR和免疫组化结果均发现,宫颈癌中Galectin-9的mRNA表达水平和MOD值明显高于CIN组和正常组,预示作为Tim-3的特异性配体Galectin-9可能在癌症发展过程中可能起着重要的调控作用。这与周晓曦等[27]的研究结果一致。
我们进一步分析Tim-3和Galectin-9的表达与宫颈癌不同临床病理参数的关系,发现Tim-3和Galectin-9的表达除了与病理分化程度和淋巴结转移有关外,这与Cao等[28]的研究结果相符。与冯秀兰等[29]研究结果不同的是,Tim-3和Galectin-9的表达也与宫颈癌FIGO分期相关。Tim-3和Galectin-9的表达在低分化宫颈鳞癌、中分化宫颈鳞癌和高分化宫颈鳞癌三组中有明显差异。因此Tim-3和Galectin-9的表达与宫颈癌病理分化程度的关系说明了Tim-3和Galectin-9可能可以作为临床宫颈鳞状细胞癌病理分化程度的重要指标,为宫颈鳞状细胞癌的预后提供有意义的参考。在有淋巴结转移患者的组织中,Tim-3和Galectin-9表达量明显高于无淋巴转移患者;在宫颈癌FIGO分期中,Tim-3和Galectin-9的表达在Ⅰ期和Ⅳ期间具有统计学差异。这说明Tim-3和Galectin-9可能参与了宫颈癌的发病进程,在其中扮演重要的角色,可以进行深入的研究。针对Tim-3和Galectin-9的表达与宫颈癌的病理分型关系分析,免疫组化和RT-PCR实验结果存在差异,这可能与mRNA的选择性翻译和甲基化有关,需进一步研究。但Tim-3和Galectin-9的表达与宫颈癌患者的年龄、浸润深度、肿瘤大小和脉管侵犯均无关。
综上所述,Tim-3和Galectin-9在正常宫颈组织中表达很少,而在宫颈癌及癌前病变组织中呈高表达,并且与宫颈癌的FIGO分期、组织分化程度及有无淋巴结转移等病理特征相关,说明Tim-3和Galectin-9的异常表达可能与宫颈病变的恶性进展存在密切相关性,并且在肿瘤形成后可能促进了宫颈癌的远处转移,使患者的预后明显变差。而Tim-3和Galectin-9是否可以作为宫颈癌的临床诊断和预后因素,还需要进一步的实验和分析。
