治疗前BALAD-2模型风险指数在肝细胞癌预后中的应用价值①
2020-04-13林莺莺陈岩松胡敏华崔兆磊
林莺莺 陈岩松 胡敏华 崔兆磊 陈 燕
(福建省肿瘤医院/福建医科大学附属肿瘤医院检验科,福州 350014)
《全球癌症统计报告2018版》显示,2018年全球约781 631人死于原发性肝癌,尤其在男性中,肝癌的死亡比例高达12.7%,死亡率位列第二[1]。在中国,肝癌居恶性肿瘤死因首位,其5年生存率只有12.1%[2]。早期诊断,及时评估预后,选择合理治疗方案成为提高肝癌生存率的重要手段。血清学检查对肝癌影像学及病理学诊断具有重要补充价值,异常凝血酶原(DCP)、甲胎蛋白(AFP)和甲胎蛋白异质体(AFP-L3)等标志物被各国或地区肝癌诊疗指南推荐用于肝癌的诊疗过程[3,4]。2014年英国学者Fox等[5]纳入了DCP、AFP和AFP-L3及血清胆红素(TBIL)、白蛋白(ALB)共计5项指标建立BALAD-2模型,通过队列研究发现该模型有助于肝癌患者的预后评估。由于中国肝癌在发病原因,流行病学特征和分期以及治疗策略等方面,都与欧美和日本等国的肝癌不同。BALAD-2模型对于国内肝癌是否同样适用需要进一步临床验证。因此,本研究旨在探讨治疗前BALAD-2模型在肝细胞癌(hepatocellular carcinoma,HCC)中的临床应用价值,从血清学角度帮助临床更准确判断肝癌预后。
1 资料与方法
1.1临床资料 本研究获得福建省肿瘤医院伦理委员会的审批,并经患者知情同意。选取2014年12月至2015年3月我院收治的HCC患者为研究对象。纳入标准:①患者入院前未接收任何肝癌等相关的临床治疗;②肝癌的诊断根据术后石蜡切片病理报告或符合2001年中国抗癌协会肝癌专业委员会修订的《原发性肝癌的临床诊断和分期标准》 ;③配合随访,临床病历和随访资料完整;④排除华法林抗凝治疗和酒精性肝硬化及严重黄疸患者。根据上述标准共有125例患者纳入本研究,其中男性117例,中位年龄51岁(范围26~84岁),女性8例,中位年龄46岁(范围28~68岁)。肿瘤分期按照2010年美国癌症联合会(AJCC)及国际抗癌联盟(UICC)制定的第7版原发性肝细胞癌TNM分期标准。肝硬化分级按Child-Pugh分级标准分为A、B、C三级。
1.2方法 抽取入组患者首次住院后第2天的静脉血样本3~5 ml,3 000 r/min离心5 min收集血清。应用贝克曼AU5800全自动生化流水线检测血清ALB、TBIL等生化指标。应用日本富士瑞比欧株式会社LUMIPULSE G1200全自动免疫分析仪及配套试剂(化学发光酶免疫法)检测血清DCP水平;用瑞士Roche公司E601全自动电化学发光分析仪及配套试剂(电化学发光法)检测血清AFP水平;用上海透景生物技术有限公司的AFP-L3试剂盒(微量离心柱法)检测血清AFP-L3水平。所有项目的检测过程严格按试剂和仪器操作说明书进行,质控品的测定值在要求范围内。BALAD-2计算模型[5]公式如下: BALAD-2=0.02×(AFP/1000-2.57)+0.012×(AFP-L3-14.19)+0.19×[LN(DCP/1000)-1.93]+0.17×[(TIBL)1/2-4.5]-0.09×(ALB-35.11)。AFP大于50 000 μg/L的数值以50 000代入模型计算,无法检测到的AFP-L3以0代入模型计算。BALAD-2模型的预后风险指数分为四级,其中Ⅰ级为(低风险,≤-1.74),Ⅱ级为(-0.91~>-1.74),Ⅲ级为(0.24~>-0.91),Ⅳ级为(高风险,>0.24)[5]。
1.3随访 收集入组HCC患者首次住院时的临床资料,包括性别、年龄、有效联系方式、发现肿瘤途径、乙肝表面抗原、肝硬化、腹水、消化道出血、肿瘤直径、肿瘤数目、门静脉癌栓、肝静脉癌栓、下腔静脉癌栓、肿瘤分期、转移情况、CH分级、治疗方案等。自患者开始治疗后,每个月通过电子病历查询和手机邮箱联系的方式登记患者生存状态,每隔3~6个月对入组患者进行随访,复查动态CT或MRI,更新患者治疗相关信息资料。按照实体瘤的疗效评价标准(RECIST)评估治疗的反应/进展,记录患者肿瘤进展时间。随访截止时间为患者死亡时间或自入院起存活满三年时间。本研究随访时间截至2018年3月。
2 结果
2.1HCC患者治疗前实验室检查指标和BALAD-2模型风险指数 入组的125例HCC患者中男性117例,占总数的93.6%;乙肝病毒感染患者110例,占总数的88%。肝癌患者的性别、乙肝病毒感染状态、肝硬化情况、肿瘤大小和数量与BALAD-2模型风险指数分级相关,四组间比较,差异均具有统计学意义(P均<0.05)。同时,在BALAD-2模型风险指数Ⅳ级高风险组中,这些指标分别与Ⅰ级低风险组相比,差异均具统计学意义(P均<0.05)。而肝癌患者的年龄与BALAD-2模型风险指数分级无关,四组间比较,差异无统计学意义(P>0.05)(表1)。
2.2治疗前BALAD-2模型风险指数不同分级组的生存率比较 随访至终点,125位HCC患者无一例失访,平均中位无进展时间(progression-free-survival,PFS)为3.2个月,3年无进展生存率为 9.6%;平均生存时间(overall-survival,OS)为4.0个月,3年总生存率为16.0%。患者的生存时间和生存率与BALAD-2模型风险指数显著相关,并随着BALAD-2模型风险指数的升级而逐渐降低,差异有统计学意义(P=0.000)。BALAD-2模型风险指数Ⅳ级高风险患者有57例(占总人数的45.6%),其平均中位PFS为2.0个月,中位OS为2.6个月,3年无进展生存率和总生存率均为3.5%。BALAD-2模型风险指数Ⅰ级低风险患者有10例(占总人数的8%),平均中位PFS为18.0个月,3年无进展生存率为30.0%,中位OS为20.7个月,3年总生存率为40.0%。两组患者相比,差异有统计学意义(P=0.000)(表2和图1)。
表1 HCC患者治疗前的实验室检查指标和BALAD-2模型风险指数
Tab.1 Laboratory indexes and calculated BALAD-2 model of all HCC cases before treatment
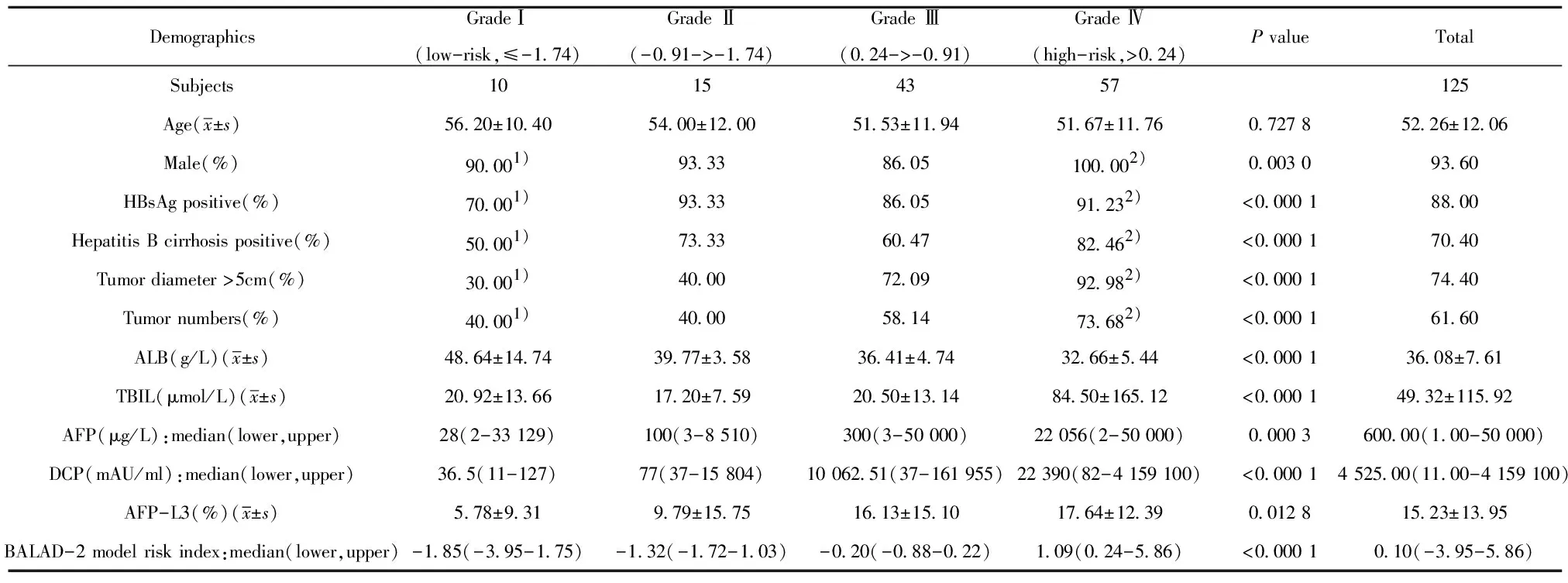
DemographicsGradeⅠ(low-risk,≤-1.74)Grade Ⅱ(-0.91->-1.74)Grade Ⅲ(0.24->-0.91)Grade Ⅳ(high-risk,>0.24)P valueTotalSubjects10154357125Age(x±s)56.20±10.4054.00±12.0051.53±11.9451.67±11.760.727 852.26±12.06Male(%)90.001)93.3386.05100.002)0.003 093.60HBsAg positive(%)70.001)93.3386.0591.232)<0.000 188.00Hepatitis B cirrhosis positive(%)50.001)73.3360.4782.462)<0.000 170.40Tumor diameter >5cm(%)30.001)40.0072.0992.982)<0.000 174.40Tumor numbers(%)40.001)40.0058.1473.682)<0.000 161.60ALB(g/L)(x±s)48.64±14.7439.77±3.5836.41±4.7432.66±5.44<0.000 136.08±7.61TBIL(μmol/L)(x±s)20.92±13.6617.20±7.5920.50±13.1484.50±165.12<0.000 149.32±115.92AFP(μg/L):median(lower,upper)28(2-33 129)100(3-8 510)300(3-50 000)22 056(2-50 000)0.000 3600.00(1.00-50 000)DCP(mAU/ml):median(lower,upper)36.5(11-127)77(37-15 804)10 062.51(37-161 955)22 390(82-4 159 100)<0.000 14 525.00(11.00-4 159 100)AFP-L3(%)(x±s)5.78±9.319.79±15.7516.13±15.1017.64±12.390.012 815.23±13.95BALAD-2 model risk index:median(lower,upper)-1.85(-3.95-1.75)-1.32(-1.72-1.03)-0.20(-0.88-0.22)1.09(0.24-5.86)<0.000 10.10(-3.95-5.86)
Note:1)Compared with Grade IV BALAD-2 model risk index,P<0.05;2)Compared with Grade I BALAD-2 model risk index,P<0.05.
表2 治疗前BALAD-2模型风险指数不同分级组的生存率比较
Tab.2 Comparison of survival rate HCC patients before treatment grouped based on different BALAD-2 model risk index

ItemGrade Ⅰ(low-risk,≤-1.74)Grade Ⅱ(-0.91->-1.74)Grade Ⅲ(0.24->-0.91)Grade Ⅳ(high-risk,>0.24)P valueTotalSubjects10154357125Median PFS(months)18.01)6.03.62.02)0.0003.2Half-year PFS%(ratio)70.0(7/10)53.3(8/15)37.2(16/43)17.5(10/57)0.00015.2(19/125)One-year PFS%(ratio)70.0(7/10)33.3(5/15)25.6(11/43)10.5(6/57)0.00022.4(28/125)Two-years PFS%(ratio)30.0(3/10)20.0(3/15)14.0(6/43)7.0(4/57)0.00013.6(17/125)Three-years PFS%(ratio)30.0(3/10)1)13.3(2/15)11.6(5/43)3.5(2/57)2)0.0009.6(12/125)Median OS(months)20.71)18.05.42.62)0.0004.0Half-year OS%(ratio)70.0(7/10)66.7(10/15)46.5(20/43)17.5(10/57)0.00037.6(47/125)One-year OS%(ratio)70.0(7/10)66.7(10/15)32.6(14/43)10.5(6/57)0.00030.4(38/125)Two-years OS%(ratio)40.0(4/10)33.3(5/15)23.3(10/43)7.0(4/57)0.00019.2(24/125)Three-years OS%(ratio)40.0(4/10)1)26.7(4/15)18.6(8/43)3.5(2/57)2)0.00016.0(20/125)
Note:Compared with Grade Ⅳ BALAD-2 model risk index,1)P<0.05;compared with Grade Ⅰ BALAD-2 model risk index,2)P<0.05.
表3 HCC患者无进展生存率的预后影响因素分析
Tab.3 Analysis of prognostic factors for progression-free survival rate of HCC patients
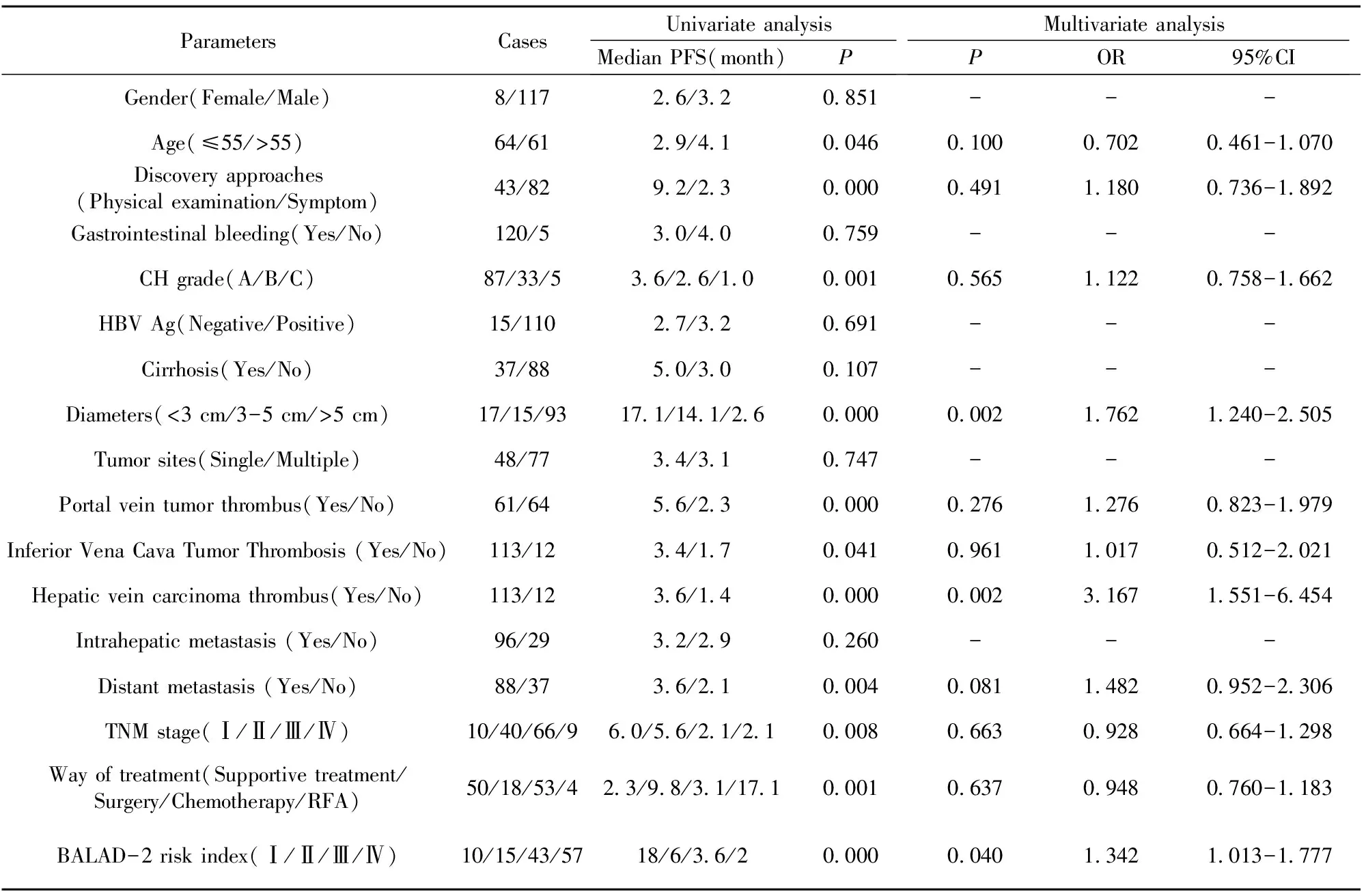
ParametersCasesUnivariate analysisMedian PFS(month)PMultivariate analysisPOR95%CIGender(Female/Male)8/1172.6/3.20.851---Age(≤55/>55)64/612.9/4.10.0460.1000.7020.461-1.070Discovery approaches(Physical examination/Symptom)43/829.2/2.30.0000.4911.1800.736-1.892Gastrointestinal bleeding(Yes/No)120/53.0/4.00.759---CH grade(A/B/C)87/33/53.6/2.6/1.00.0010.5651.1220.758-1.662HBV Ag(Negative/Positive)15/1102.7/3.20.691---Cirrhosis(Yes/No)37/885.0/3.00.107---Diameters(<3 cm/3-5 cm/>5 cm)17/15/9317.1/14.1/2.60.0000.0021.7621.240-2.505Tumor sites(Single/Multiple)48/773.4/3.10.747---Portal vein tumor thrombus(Yes/No)61/645.6/2.30.0000.2761.2760.823-1.979Inferior Vena Cava Tumor Thrombosis (Yes/No)113/123.4/1.70.0410.9611.0170.512-2.021Hepatic vein carcinoma thrombus(Yes/No)113/123.6/1.40.0000.0023.1671.551-6.454Intrahepatic metastasis (Yes/No)96/293.2/2.90.260---Distant metastasis (Yes/No)88/373.6/2.10.0040.0811.4820.952-2.306TNM stage(Ⅰ/Ⅱ/Ⅲ/Ⅳ)10/40/66/96.0/5.6/2.1/2.10.0080.6630.9280.664-1.298Way of treatment(Supportive treatment/Surgery/Chemotherapy/RFA)50/18/53/42.3/9.8/3.1/17.10.0010.6370.9480.760-1.183BALAD-2 risk index(Ⅰ/Ⅱ/Ⅲ/Ⅳ)10/15/43/5718/6/3.6/20.0000.0401.3421.013-1.777
表4 HCC患者总生存率预后影响因素分析
Tab.4 Analysis of prognostic factors for overall survival rate of HCC patients
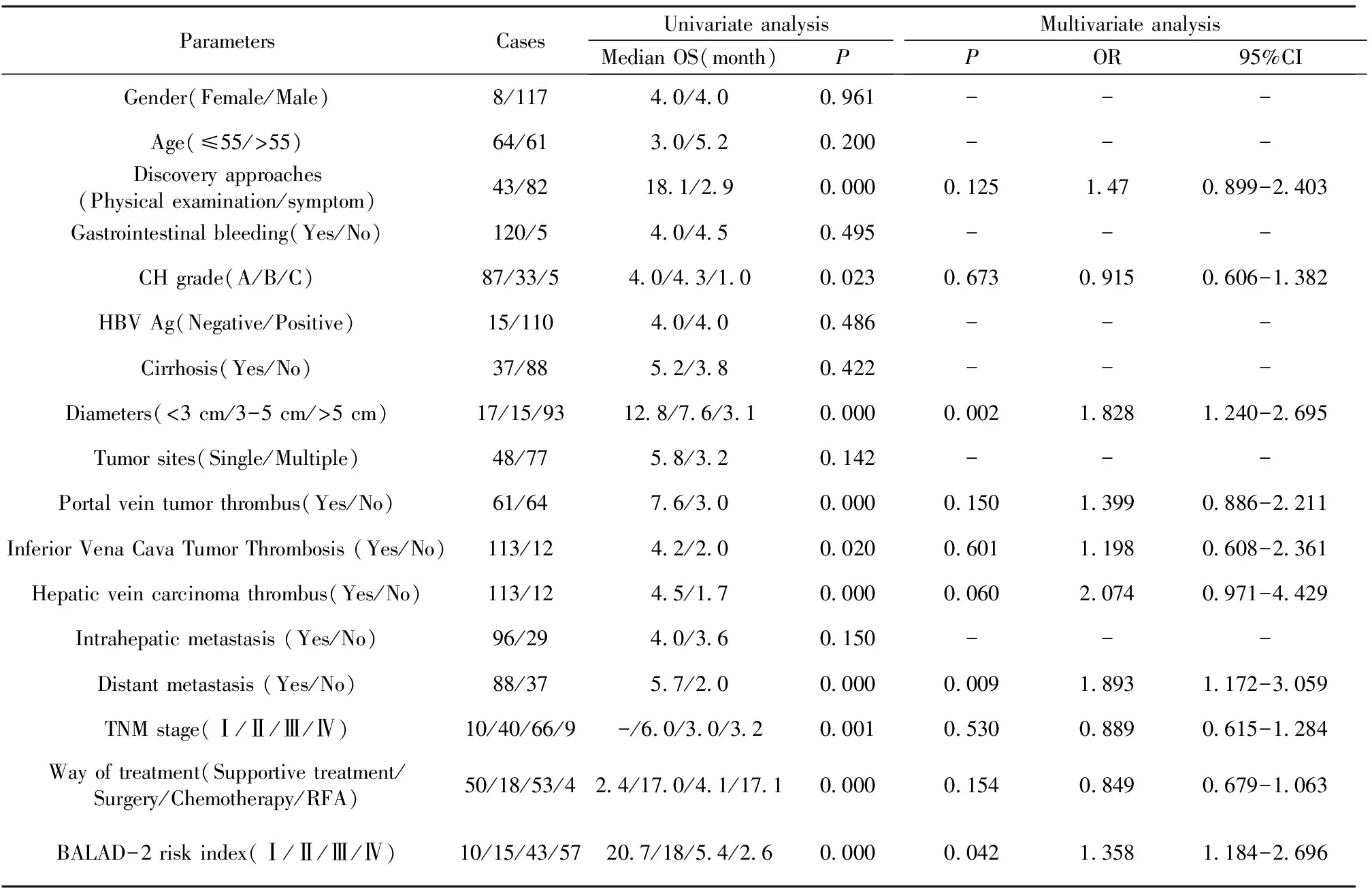
ParametersCasesUnivariate analysisMedian OS(month)PMultivariate analysisPOR95%CIGender(Female/Male)8/1174.0/4.00.961---Age(≤55/>55)64/613.0/5.20.200---Discovery approaches(Physical examination/symptom)43/8218.1/2.90.0000.1251.470.899-2.403Gastrointestinal bleeding(Yes/No)120/54.0/4.50.495---CH grade(A/B/C)87/33/54.0/4.3/1.00.0230.6730.9150.606-1.382HBV Ag(Negative/Positive)15/1104.0/4.00.486---Cirrhosis(Yes/No)37/885.2/3.80.422---Diameters(<3 cm/3-5 cm/>5 cm)17/15/9312.8/7.6/3.10.0000.0021.8281.240-2.695Tumor sites(Single/Multiple)48/775.8/3.20.142---Portal vein tumor thrombus(Yes/No)61/647.6/3.00.0000.1501.3990.886-2.211Inferior Vena Cava Tumor Thrombosis (Yes/No)113/124.2/2.00.0200.6011.1980.608-2.361Hepatic vein carcinoma thrombus(Yes/No)113/124.5/1.70.0000.0602.0740.971-4.429Intrahepatic metastasis (Yes/No)96/294.0/3.60.150---Distant metastasis (Yes/No)88/375.7/2.00.0000.0091.8931.172-3.059TNM stage(Ⅰ/Ⅱ/Ⅲ/Ⅳ)10/40/66/9-/6.0/3.0/3.20.0010.5300.8890.615-1.284Way of treatment(Supportive treatment/Surgery/Chemotherapy/RFA)50/18/53/42.4/17.0/4.1/17.10.0000.1540.8490.679-1.063BALAD-2 risk index(Ⅰ/Ⅱ/Ⅲ/Ⅳ)10/15/43/5720.7/18/5.4/2.60.0000.0421.3581.184-2.696
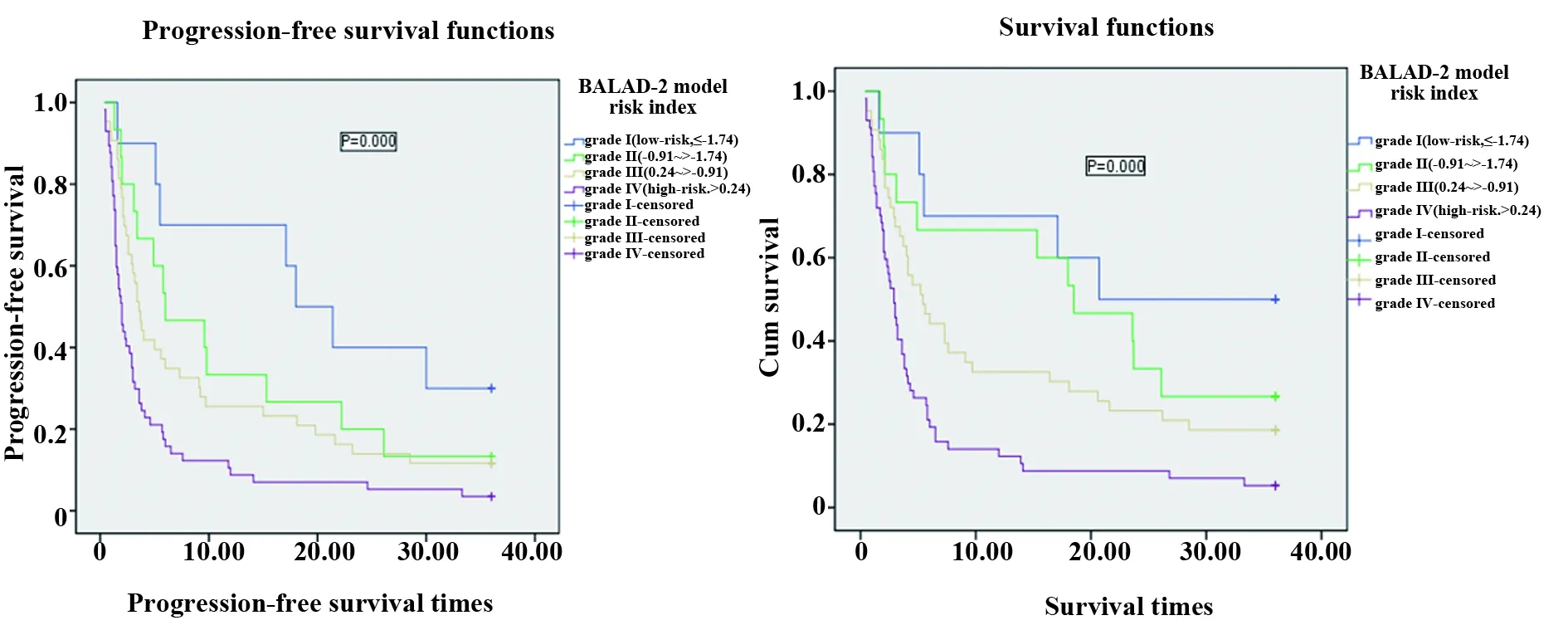
图1 治疗前BALAD-2模型风险指数不同分级组的HCC患者生存曲线Fig.1 Survival curves of HCC patients group based on different BALAD-2 model risk index before treatment
2.3治疗前BALAD-2模型与原发性肝癌患者无进展生存率的相关性 表3单因素分析表明,年龄、发现肿瘤途径、CH分级、肿瘤直径、门脉癌栓、下腔静脉癌栓、肝静脉癌栓、远处转移临床分期、治疗方式以及治疗前BALAD-2模型风险指数均为患者无进展生存率的影响因素。多因素Cox回归分析显示,治疗前BALAD-2模型风险指数Ⅳ级(高风险,>0.24)(OR=1.342;95%CI:1.013~1.777,P=0.040),肿瘤直径>5 cm(OR=1.762;95%CI:1.240~2.505,P=0.002)和肝静脉癌栓(OR=3.167;95%CI:1.551~6.454,P=0.002)均为患者无进展生存率预后较差的独立影响因素(表3)。
2.4BALAD-2模型风险指数与治疗前HCC患者总生存率的相关性 单因素分析表明,发现肿瘤途径、child-pugh分级、肿瘤直径、门脉癌栓、下腔静脉癌栓、肝静脉癌栓、远处转移临床分期、治疗方式以及治疗前BALAD-2模型风险指数均是患者总生存率的影响因素(P均<0.05,见表4)。多因素Cox回归分析显示治疗前BALAD-2模型风险指数Ⅳ级(高风险,>0.24)(OR=1.358;95%CI:1.184~2.696,P=0.042),肿瘤直径>5 cm(OR=1.828;95%CI:1.240~2.695,P=0.002)和远处转移(OR=1.893;95%CI:1.172~3.059,P=0.009)是影响患者总生存率预后较差的独立因素(表4)。
3 讨论
目前临床上对于肝癌预后影响因素众说纷纭,多数研究表明肿瘤直径、分期、肝功能指标、微血管侵犯等均有可能是影响肝癌术后预后的重要因素[6-8]。这些评估多是基于肝癌切除术后或移植后的影像学检查和创伤性病理检查,而且影像学检查很难发现肝癌微血管侵犯和微卫星病灶[9]。AFP、AFP-L3和DCP作为我国和亚洲国家肝癌诊断依据的血清肿瘤标志物[10],在肝癌预后方面的价值成为近年来的研究热点。有研究发现在HBV相关肝癌患者中,肝癌根治术前升高的AFP和DCP水平与术后较高的复发率和较短的DFS相关[11]。还有研究表明术后不论是DCP还是AFP升高,都会导致不良预后,二者也是术后复发的独立危险因素[12]。此外,Nakagawa等[13]将AFP、AFP-L3、DCP和CH分级通过逐步Cox回归模型,建立肿瘤标记物分期系统(TMS)。有研究认为相较于单一标志物,该分期系统可更有效预测术后复发[13]。BALAD模型是由日本学者Toyoda等[14]于2006年首次提出,该模型纳入了反映肝脏肿瘤负荷的AFP、AFP-L3、DCP及反映肝功能的血清胆红素、白蛋白等5项指标进行建模[14]。此后,英国的Fox等[5]教授团队纳入2 599例日本患者(HBV感染率12.4%)和319例英国患者(HBV感染率9.1%)进行研究,将BALAD模型改良为BALAD-2模型,通过引入复杂的数据分析得到更直观的结果。欧美多中心研究证明BALAD-2模型可评估不同分级患者的生存率[15,16]。日本一项纳入24 029例肝细胞癌患者(HBV感染率16%)的全国性调查也发现,基于血清学的预后评分模型,特别是BALAD-2模型,有助于对肝细胞癌的分期和预后进行评估[17]。
肿瘤发生过程中,肝硬化结节转变为癌前病变被广泛证实及接受,绝大多数肝癌患者有肝炎及肝硬化背景[18]。在我国,80%肝细胞癌是由HBV感染引起的,与上述欧美和日本等国研究的肝癌有所不同。本研究根据国内肝癌流行学特征,纳入的125位HCC患者中,男性占总数的93.6%,88%患者感染乙肝病毒。结果发现,肝癌患者的性别和乙肝病毒感染状态、乙肝肝硬化情况与BALAD-2模型风险指数分级相关。BALAD-2模型风险指数Ⅳ级高风险组中,男性占100%,乙肝病毒感染者占91.23%,乙肝肝硬化者占70.8%,显著高于Ⅰ级低风险组,说明BALAD-2模型对HBV感染的肝细胞癌人群同样适用,BALAD-2模型高风险的患者感染乙肝病毒的概率高。由于HBV感染是肝癌发生的一个重要危险因素,因此随着BALAD-2模型风险指数分级的升高,肝癌发病的相对危险度显著增加。同时,与国外研究相似[17],本研究中肝癌患者的肿块大小和数量也与BALAD-2模型风险指数分级相关,随着分级的升高而增大,间接提示BALAD-2模型风险指数分级可从血清学角度预测肝癌预后。
本研究中125例HCC患者的生存时间和生存率与BALAD-2模型风险指数显著相关,随着BALAD-2模型风险指数的升级而逐渐降低。BALAD-2模型风险指数Ⅳ级高风险患者的中位无进展生存期、总生存期、3年无进展生存率和总生存率均显著低于BALAD-2模型风险指数Ⅰ级低风险患者。通过单因素分析发现治疗前BALAD-2模型风险指数、发现肿瘤途径、CH分级、肿瘤直径、临床分期、微血管侵犯、远处转移以及治疗方式等多指标均为患者无进展生存率和总体生存率的影响因素,与国内外研究基本一致。本研究多元回归分析发现治疗前BALAD-2模型风险指数Ⅳ级高风险和肿瘤直径>5 cm是患者无进展生存率和总体生存率预后较差的两个独立影响因素。因此,笔者建议在肝癌患者入院后即检测DCP、AFP和AFP-L3等标志物水平和血清ALB、TBIL等肝功能指标并计算BALAD-2模型风险指数,对于指导下一步诊疗及评估预后有较好的临床指导价值,尤其对BALAD-2模型风险指数Ⅳ级高风险的患者,应更加慎重地选择治疗方案,以进一步提高患者生存质量和存活率。
综上所述,BALAD-2模型风险指数可作为乙肝相关HCC患者良好的预后指标,且治疗前BALAD-2模型风险指数Ⅳ级高风险提示肝癌不良预后。