虎杖苷对严重烧伤小鼠早期肠损伤及SIRT1/NF-κB通路的影响
2020-04-13王曌华裴敬仲
王曌华 张 永 裴敬仲
(新乡市第二人民医院烧伤科,新乡 453000)
肠道作为人体最大的免疫器官,在正常生理条件下肠黏膜能够阻止内毒素、肠道细菌进入血液内循环,而在感染、严重烧伤等病理条件下,肠黏膜屏障被破坏,机体免疫力下降,导致肠道内毒素和细菌进入全身循环,从而引发机体多器官功能障碍、炎症反应、脓毒症等症状[1,2]。因此保护烧伤后肠道黏膜屏障是治疗的关键所在。虎杖(polygonum cuspidatum sieb,et zucc)中医临床上常用于肺热咳嗽、关节疼痛、跌打伤、湿热黄疸、水火烫伤等[3]。虎杖苷(polydatin,PD)作为中医虎杖的主要成分,在治疗急性脑中风、急性肺损伤方面疗效显著[4,5]。最近研究发现,PD具有抗氧化、抗炎的药理作用[5,6]。沉默调节蛋白1(sirtuin 1,SIRT1)能够通过烟酰胺腺嘌呤二核苷酸/NADH的信号转导,进而经多转录因子调控蛋白表达,研究发现上调SIRT1水平能够抑制NF-κB炎症通路活性,缓解炎症反应症状[7]。
研究发现,PD可以激活SIRT1表达,下调COX-2、NOS、TNF-α、IL-6表达水平,抑制大鼠脊髓炎症和氧化应激反应,改善大鼠急性脊髓损伤症状,促进运动功能恢复[8]。PD能否缓解严重烧伤小鼠早期肠损症状未见相关报道,因此本研究拟建立严重烧伤小鼠早期肠损伤模型,观察不同浓度PD给药后肠损伤缓解情况及对SIRT1/NF-κB通路的影响。
1 材料与方法
1.1材料
1.1.1试剂和仪器 虎杖苷(polydatin,PD、货号:J43812、≥99%)购自上海金穗生物科技有限公司;谷氨酰胺(货号:NR61055,≥99%)购自北京诺博莱德科技有限公司;阿利新兰8GX(货号:JM8313,≥99%)购自北京吉美生物技术有限公司;兔抗鼠SIRT1(货号:T845-EKB)、兔抗鼠NF-κB p65(货号:YT827-NJI)、羊抗兔二抗(货号:BL0924-ILN)均购自北京百奥莱博科技有限公司;TNF-α[货号:JK-(a)-0016]、IL-1β[货号:JK-(a)-1438]、IL-10[货号:JK-(a)-1490]、NO[货号:JK-(a)-5116]、一氧化氮合酶[iNOS,货号:JK-(a)-5101]、MDA[货号:JK-(a)-5002]ELISA试剂盒均购自上海晶抗生物工程有限公司;RM2235型石蜡转轮切片机购自德国徕卡公司;DYS-338倒置生物显微镜购自上海点应光学仪器有限公司;ZF-288型全自动凝胶成像分析系统购自上海金鹏分析仪器有限公司。
1.1.2实验动物 雌性BALB/c小鼠,体质量20~30 g,8周龄,均购自河南省实验动物中心,许可证号:SCXK(豫)-2018-0002。适应性饲养一周,均自由饮食、饮水。严重烧伤小鼠模型构建采用陈琦等[9]建立的方法,即选取小鼠背部相应区域电动剃毛,随后用8%硫化钠脱毛,造模前禁食12 h,供自由饮水。烧伤面积(S)=0.0913W2/3,W为小鼠体重(g),严重烧伤(15%TBSAⅢ)小鼠模型面积为S×30%。用2%戊巴比妥钠以2 ml/kg剂量腹腔注射麻醉小鼠,水浴锅水温设置为100℃,根据烧伤面积制作木质平面板洞口,并盖在水浴锅上,将小鼠背部脱毛处置于洞口处,烫伤8 s,致使小鼠背部30%TBSAⅢ烫伤(下称烧伤)。烫伤结束后立刻腹腔注射1 ml生理盐水,背部涂抹碘伏,每日一次。假烧伤组30℃水烫伤,不注射生理盐水和涂抹碘伏,建模1 d后,观察小鼠建模情况,并进行分组。实验分组:①假烧伤组;②烧伤组;③低剂量PD组(5 mg/kg);④中剂量PD组(10 mg/kg);⑤高剂量PD组(20 mg/kg)[10];⑥谷氨酰胺组(1 g/ml)[11],均200 μl 灌胃,每天一次,给药7 d,假烧伤组灌胃等体积生理盐水,每组20只。
1.2方法
1.2.1样本采集和保存 给药治疗结束后,各组小鼠鼠尾采血,离心取上清液,血清置于-80℃冰箱中待用。随后脱颈处死小鼠,其中任选10只小鼠取回肠段,清洗干净,除去脂肪和肠系膜待用。另外10只小鼠立刻取回肠段组织,一部分置于液氮中保存,另一部分置于4%多聚甲醛固定。另外10只小鼠取全部肠段,除去脂肪和肠系膜待用。
1.2.2各组小鼠小肠黏液含量的测定 利用阿利新兰和黏液中糖蛋白结合,从而形成不溶性复合物的特点,测定各组小鼠黏液含量。将5 ml阿利新兰溶液充分浸没回肠段黏液组织,25℃孵育2 h,随后吸取染液,离心后取上清,使用分光光度计测定615 nm 处的OD值,标准曲线计算黏液结合的阿利新兰量以表示黏液含量。
1.2.3各组小鼠回肠病理学组织HE染色 将固定后的回肠段组织常规石蜡包埋,切片、苏木素-伊红染色,在光学显微镜下观察肠黏膜受损情况。
1.2.4蛋白印迹法(Western blot,WB)测定各组小鼠回肠组织中SIRT1、NF-κB p65表达水平 从液氮中取出各组小鼠回肠组织,称重后放入研钵中,向研钵中加入含有蛋白酶抑制剂的裂解液,随后充分研磨至无组织碎片。50 μg蛋白缓冲液升温至100℃,保持10 min,上样电泳。首先调节电压80 V,电泳30 min,随后升高电压至120 V,电泳120 min,湿法转至PVDF膜,室温下5%BSA封闭结合位点1 h,分别加入兔抗鼠SIRT1、兔抗鼠NF-κB p65、兔抗鼠内参β-Actin(均为1∶1 000),4℃孵育24 h,加入羊抗兔二抗(1∶1 000),室温孵育2 h后,洗膜、ECL显色、暗室曝光、观察。
1.2.5酶联免疫法(enzyme linked immunosorbent assay,ELISA)检测各组小鼠血清中TNF-α、IL-1β、IL-10、NO、iNOS、MDA表达水平 从-80℃冰箱中取出各组小鼠血清,按照ELISA试剂盒说明书进行测定各组小鼠血清中TNF-α、IL-1β、IL-10、NO、iNOS、MDA表达水平。
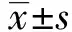
2 结果
2.1各组小鼠创面愈合情况观察 造模后可见小鼠烧伤部位有渗血、感染、水肿发生,不同浓度虎杖苷给药治疗后,小鼠创面有褐色痂壳形成,创面皱缩,随后出现创面上皮爬行、干燥,高剂量组治疗结束后痂壳脱离,创面平整、红润,基本愈合。谷氨酰胺组症状缓解情况与高剂量组相当。
表1 各组小鼠回肠黏液相对含量
Tab.1 Relative content of ileal mucus in mice of each group
GroupsnRelative content of mucus(mg)Sham burn group102.29±0.26Burn group101.14±0.141)Low dose PD group101.42±0.151)2)Medium dose PD group101.62±0.161)2)3)High dose PD group101.87±0.251)2)3)4)Glutamine group101.88±0.261)2)3)4)F-36.687P-<0.001
Note:Compared with the sham burn group,1)P<0.05;compared with the burn group,2)P<0.05,Compared with the low dose PD groups,3)P<0.05;compared with the medium dose PD groups,4)P<0.05.
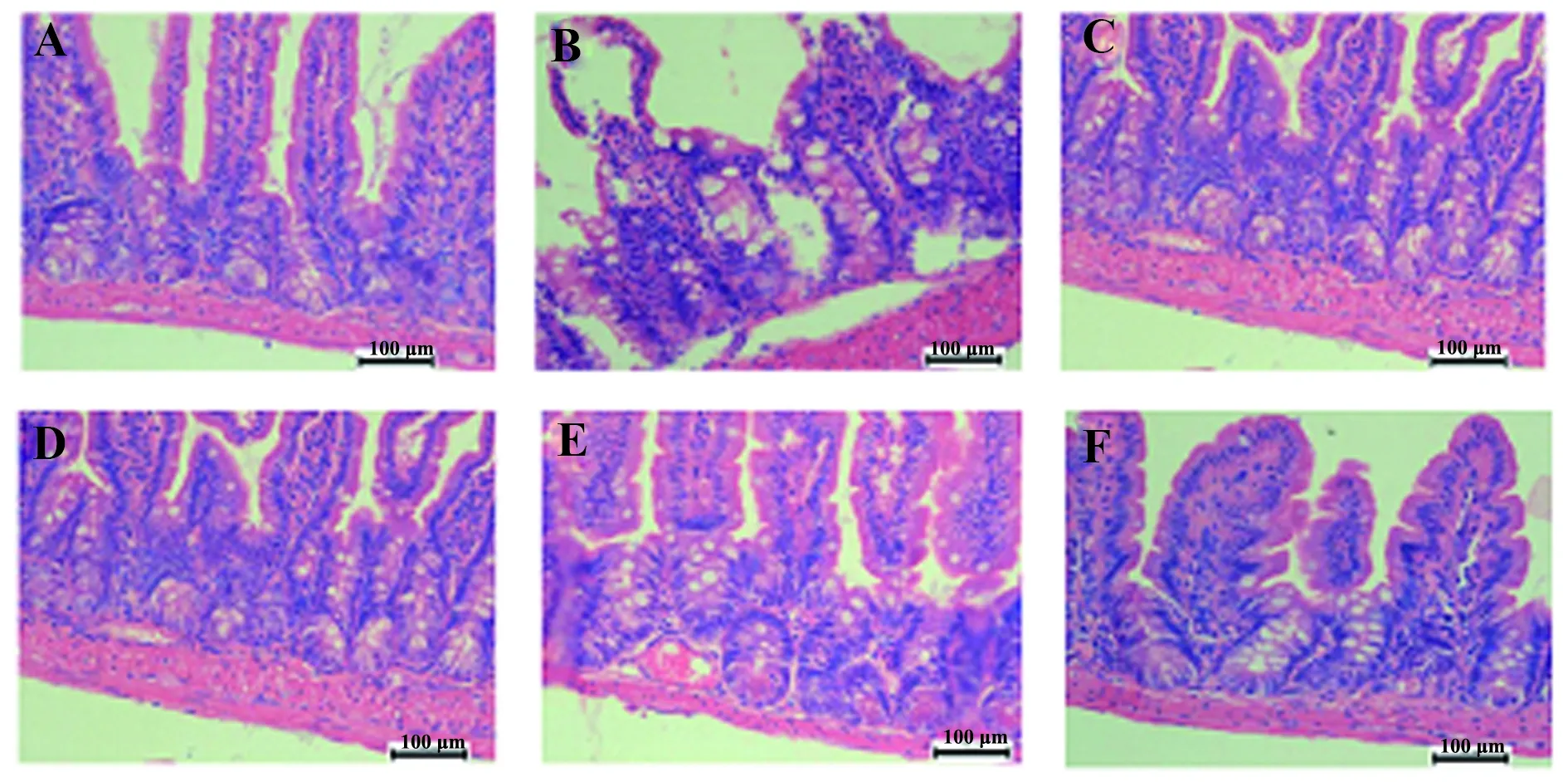
图1 各组小鼠回肠段绒毛病理学组织HE染色比较(×400)Fig.1 Comparison of HE staining of ileum villous pathology in mice of each group(×400)Note: A.Sham burn group;B.Burn group;C.Low dose PD groups;D.Medium dose PD groups;E.High dose PD groups;F.Glut-amine group.
2.2各组小鼠回肠黏液相对含量的测定 与假烧伤组相比,烧伤组回肠黏液相对含量显著降低(P<0.05),与烧伤组相比,低、中、高剂量PD组,回肠黏液相对含量显著升高(P<0.05),随着PD给药剂量的升高,回肠黏液相对含量随之升高,任意两组相比差异有统计学意义(P<0.05)。谷氨酰胺组回肠黏液相对含量与烧伤组相比显著升高(P<0.05),与高剂量PD组相比差异无统计学意义(P>0.05),见表1。
2.3各组小鼠回肠病理学组织HE染色 假烧伤组(图1A)回肠黏膜分布均匀,绒毛形态正常,烧伤组(图1B)回肠黏膜水肿、充血,大量杯状细胞分泌,淋巴细胞浸润,绒毛断裂坏死。PD给药治疗后,随着剂量的增加,黏膜充血水肿减弱,淋巴细胞浸润减少,绒毛形态恢复正常,高剂量组(图1E)治疗后黏膜趋向正常。谷氨酰胺组(图1F)症状缓解情况与高剂量组相当。
2.4各组小鼠回肠组织中SIRT1、NF-κB p65表达水平 与假烧伤组相比,烧伤组SIRT1蛋白表达水平显著降低,NF-κB p65蛋白表达水平显著升高(P<0.05);与烧伤组相比,低、中、高剂量PD组SIRT1蛋白表达水平显著升高,NF-κB p65蛋白表达水平显著降低(P<0.05),随着PD给药剂量升高,SIRT1蛋白表达水平随之升高,NF-κB p65蛋白表达水平随之降低,任意两组相比差异有统计学意义(P<0.05)。谷氨酰胺组与烧伤组相比,SIRT1蛋白表达水平显著升高,NF-κB p65蛋白表达水平显著降低(P<0.05),与高剂量PD组相比差异无统计学意义(P>0.05),见图2、表2。

图2 各组小鼠回肠组织中SIRT1、NF-κB p65表达水平Fig.2 Expression levels of SIRT1,NF-κB p65 in ileum tissue of mice in each groupNote: 1.Sham burn group;2.Burn group;3.Low dose PD groups;4.Medium dose PD groups;5.High dose PD groups;6.Glutamine group.
表2 各组小鼠回肠组织中SIRT1、NF-κB p65表达水平
Tab.2 Expression levels of SIRT1,NF-κB p65 in ileum tissue of mice in each group
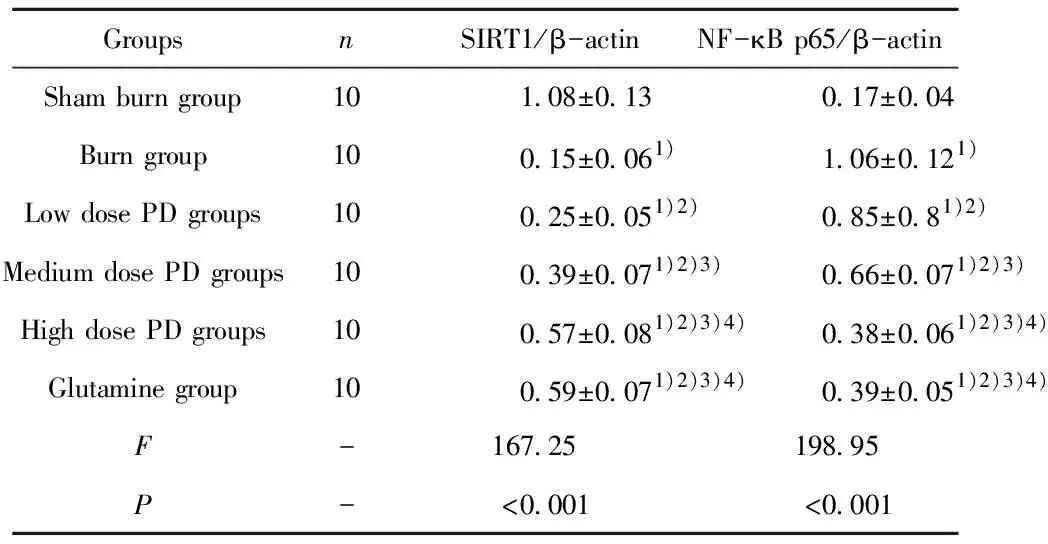
GroupsnSIRT1/β-actinNF-κB p65/β-actinSham burn group101.08±0.130.17±0.04Burn group100.15±0.061)1.06±0.121)Low dose PD groups100.25±0.051)2)0.85±0.81)2)Medium dose PD groups100.39±0.071)2)3)0.66±0.071)2)3)High dose PD groups100.57±0.081)2)3)4)0.38±0.061)2)3)4)Glutamine group100.59±0.071)2)3)4)0.39±0.051)2)3)4)F-167.25198.95P-<0.001<0.001
Note:Compared with the sham burn group,1)P<0.05;compared with the burn group,2)P<0.05,Compared with the low dose PD groups,3)P<0.05;compared with the medium dose PD groups,4)P<0.05.
表3 各组小鼠血清中TNF-α、IL-1β、IL-10表达水平
Tab.3 TNF-α,IL-1β,IL-10 expression levels in serum of mice in each group

GroupsnTNF-α(pg/ml)IL-1β(ng/L)IL-10(ng/ml)Sham burn group1015.07±1.1912.97±1.58325.13±34.86Burn group10156.48±18.761)28.46±2.611)93.44±15.071)Low dose PD group10121.92±13.511)2)24.75±2.431)2)126.26±15.221)2)Medium dose PD group1082.49±9.721)2)3)21.29±2.021)2)3)198.99±20.901)2)3)High dose PD group1048.17±5.281)2)3)4)17.68±2.201)2)3)4)254.37±24.081)2)3)4)Glutamine group1047.09±4.471)2)3)4)17.30±2.541)2)3)4)256.63±23.481)2)3)4)F-246.1561.56141.08P-<0.001<0.001<0.001
Note:Compared with the sham burn group,1)P<0.05;compared with the burn group,2)P<0.05;Compared with the low dose PD groups,3)P<0.05;compared with the medium dose PD groups,4)P<0.05.
表4 各组小鼠回肠组织中NO、iNOS、MDA表达水平
Tab.4 Expression levels of NO,iNOS,MDA in ileum tissue of mice in each group

GroupsnNO(μmol/g)iNOS(U/mg)MDA(nmol/mg)Sham burn group102.08±0.271.27±0.132.23±0.27Burn group108.49±0.841)4.01±0.461)5.51±0.461)Low dose PD groups106.90±0.621)2)3.45±0.34ab4.45±0.441)2)Medium dose PD groups105.11±0.591)2)3)2.61±0.251)2)3)3.48±0.391)2)3)High dose PD groups103.84±0.321)2)3)4)1.98±0.161)2)3)4)2.91±0.381)2)3)4)Glutamine group103.89±0.351)2)3)4)1.93±0.151)2)3)4)2.90±0.391)2)3)4)F-185.89139.6795.68P-<0.001<0.001<0.001
Note:Compared with the sham burn group,1)P<0.05;compared with the burn group,2)P<0.05;compared with the low dose PD groups,3)P<0.05;compared with the medium dose PD groups,4)P<0.05.
2.5各组小鼠血清中TNF-α、IL-1β、IL-10表达水平 与假烧伤组相比,烧伤组TNF-α、IL-1β表达水平显著升高,IL-10表达水平显著降低(P<0.05);与烧伤组相比,低、中、高剂量PD组TNF-α、IL-1β表达水平显著降低、IL-10表达水平显著升高(P<0.05),随着PD给药剂量升高,TNF-α、IL-1β表达水平随之降低、IL-10表达水平随之升高,任意两组相比差异有统计学意义(P<0.05)。谷氨酰胺组与烧伤组相比,TNF-α、IL-1β表达水平显著降低,IL-10表达水平显著升高(P<0.05),与高剂量PD组相比差异无统计学意义(P>0.05),见表3。
2.6各组小鼠回肠组织中NO、iNOS、MDA表达水平 与假烧伤组相比,烧伤组NO、iNOS、MDA表达水平显著升高(P<0.05);与烧伤组相比,低、中、高剂量PD组NO、iNOS、MDA表达水平显著降低,随着PD给药剂量升高,NO、iNOS、MDA表达水平随之降低,任意两组相比差异有统计学意义(P<0.05)。谷氨酰胺组与烧伤组相比,NO、iNOS、MDA表达水平显著降低(P<0.05),与高剂量PD组相比差异无统计学意义(P>0.05),见表4。
3 讨论
肠黏膜屏障是人们机体内环境与外部环境的隔离带,主要包含黏液屏障、机械屏障、免疫屏障和生物屏障,可阻碍有害物质进入内循环,从而维护机体内环境动态平衡[12]。烧伤后,肠道黏膜屏障受损是引发感染和其他并发症的病理基础,因此如何缓解烧伤后肠道黏膜损伤,保持肠道黏膜结构稳定,维持屏障功能是临床上治疗烧伤的重要问题。本研究构建严重烧伤小鼠模型,一般情况观察可见小鼠烧伤部位有渗血、感染、水肿发生,说明模型构建成功。与假烧伤组相比,烧伤组回肠黏液相对含量显著降低,黏膜水肿、充血,大量杯状细胞分泌,淋巴细胞浸润,绒毛断裂坏死,说明处理后,小鼠肠道受损,模型构建成功。
本研究发现经PD治疗后,严重烧伤小鼠创面有褐色痂壳形成,创面皱缩,随后出现创面上皮爬行、干燥,高剂量组治疗结束后痂壳脱离,创面平整、红润,基本愈合,回肠黏液含量显著升高,黏膜充血水肿减弱,淋巴细胞浸润减少,绒毛形态恢复正常,说明PD治疗后,能够缓解严重烧伤小鼠肠损伤症状,提示PD有望成为治疗严重烧伤肠损伤的备选药物。但是PD通过何种途径以缓解此症状还有待进一步研究。高友光等[13]研究发现,经PD治疗后,脓毒症急性肾损伤小鼠血清中IL-6、IL-1β、MDA水平显著降低,SOD、GSH水平显著升高,提示PD可通过抗氧化、抗炎作用,缓解肾损伤。而本研究同样证明,经PD治疗后TNF-α、IL-1β水平降低,IL-10水平升高,TNF-α可诱导炎症因子IL-1β、IL-18、IL-6产生释放,放大和加强炎症信号[14]。IL-10可抑制巨噬/单核细胞分泌TNF-α、IL-6、IL-1β等促炎症因此,抑制炎症免疫反应[15]。说明PD能够缓解炎症反应,减轻肠道损伤。一氧化氮合酶(iNOS)可由TNF-α、LPS、IL-1β等促炎症因子诱导上调,进一步产生大量NO,对机体致炎和氧化损伤[16]。丙二醛(MDA)作为质子过氧化物最终产物能够间接反映组织氧化应激损伤程度[17]。而本研究证明经PD治疗后,NO、iNOS、MDA水平显著降低,说明经PD治疗后,能够缓解肠道氧化应激反应,保护肠道免受损伤。而文献报道同样证明,PD可能通过激活p38 MAPK/Nrf2/HO-1信号通路,下调MDA水平,上调SOD、CATS水平,经抗氧化途径发挥抗炎的药理作用[18]。
本研究初步探究PD通过调控何种信号通路参与严重烧伤小鼠早期肠损伤进程,有研究报道发现活化SIRT1能够下调Bax、IL-1β、TNF-α水平,上调Bcl-2、IL-10水平,以改善严重烧伤大鼠肾功能,减轻炎症反应[19]。而本研究发现,经PD治疗后SIRT1蛋白水平升高,NF-κB p65蛋白水平降低,说明PD治疗后SIRT1被活化,PD可能基于此通路发挥抗炎、抗氧化作用。白智晓等[20]同样发现,活化SIRT1后,可降低TNF-α、IL-1β、Bax及剪切型半胱氨酸天冬氨酸蛋白酶3的表达水平,缓解大鼠严重烧伤早期诱发的心肌损伤。
综上所述,PD可能通过抑制炎症和氧化应激反应以缓解严重烧伤小鼠早期肠损伤症状,可能与SIRT1/NF-κB通路相关,但是具体作用机制还有待进一步探究。
