服用扶正抗癌方前后非小细胞肺癌患者CD8+T细胞表达NKG2D与其细胞毒活性的相关性分析①
2020-04-13吴姗姗王柏山李志静
吴姗姗 王柏山 严 峰 张 宁 张 程 李志静
(辽宁中医药大学附属医院临床检验中心,沈阳 110032)
肺癌是目前世界最常见的癌症类型,占全部癌症病例的11.6%,并且是癌症相关性死亡的主要原因[1]。这些足以证明肺癌的巨大危害,世界卫生组织基于生物学特性、治疗和预后等因素,将肺癌主要划分为两大类,即非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(smal cell lung cancer,SCLC),NSCLC更加常见占所有肺癌病例的80%以上[2],NSCLC包括鳞癌、腺癌、腺鳞癌和大细胞肺癌等。尽管在过去的几十年已经研发多种化疗方案,但是多数NSCLC仍会发生转移或复发[3]。近年来众多研究发现扶正抗癌方联合化疗,能有效增加化疗药物敏感性并减低其毒副作用[4,5]。扶正抗癌方能扶正补虚和抗癌抑瘤,提高患者的免疫功能但具体机制尚不清楚。CD8+T细胞又称为细胞毒性T细胞(cytotoxic T cell,CTL),是体内免疫监视肿瘤细胞的主要细胞。CD8+T细胞也可表达一些NK相关受体,如活化性受体NKG2D和抑制性受体NKG2A等,通过识别靶细胞上相应的配体传递抑制或活化信号,抑制与活化信号叠加,最终决定CD8+T细胞能否杀伤靶细胞[6]。Vivier等[7]的研究发现T细胞上的NKG2D是作为TCR激活的一个重要共刺激分子。而且结肠癌患者的CD8+T细胞可以分别通过TCR或NKG2D受体识别自体和同种异体的肿瘤细胞[8]。Ⅲ/Ⅳ期食道癌患者的CD8+T细胞表达NKG2D显著低于Ⅰ/Ⅱ期患者,与疾病的严重程度密切相关[9]。有报道称由CTL介导的肿瘤杀伤机制主要依赖于穿孔素和颗粒酶[10]。CD8+T细胞表面表达CD107a是其激活诱导脱颗粒的标志[11]。抗原反应性T细胞可分泌IFN-γ和TNF-α等多种细胞因子,上述细胞因子可加强CTL对肿瘤细胞杀伤的敏感性[12]。因此颗粒酶、CD107a和IFN-γ可作为评价CD8+T细胞细胞毒活性的指标。本研究旨在通过观察非小细胞肺癌患者服用扶正抗癌方前后CD8+T细胞表达NKG2D和NKG2A与其细胞毒活性的相关性,初步探索扶正抗癌方的作用机制。
1 资料与方法
1.1资料
1.1.1研究对象 本研究通过本院伦理委员会审批以及患者的知情同意。选择我院2018年5月至2019年1月期间收治的有病理学明确诊断的NSCLC晚期患者31例,其中男性18例,女性13例;年龄35~79岁,平均年龄(45.5±3.8)岁,其中鳞癌14例,腺癌17例;TNM分期Ⅲa期8例,Ⅲb期11例,Ⅳ期12例。上述患者为治疗组,根据服用扶正抗癌方前后分别定义为治疗前组和治疗后组。
1.1.2病例入选标准 入选标准:①患者符合原发性NSCLC诊断标准[13]且无其他肿瘤史;②患者不伴发自身免疫性疾病,如系统性红斑狼疮、风湿性骨关节病等;③患者未服用激素类药物或接受免疫抑制剂的治疗;④除外活动性(病毒)感染。Karnofsky评分≥70分。选择与患者性别年龄相匹配的健康人21例即健康对照组,其中男11例,女10例;年龄32~77岁,平均(42.3±3.5)岁。
1.2方法
1.2.1药物干预 治疗组服用院内扶正抗癌方(基本组成:苦参15 g,生白术12 g,生甘草5 g,半夏15 g,大贝20 g,半枝莲15 g,白花蛇草30 g,茯苓20 g,陈皮15 g,生苡仁30 g)。辨证加减:反复咳嗽并痰中带血可加三七和仙鹤草等;胸痛者可加枳壳、香附、延胡索等;阴虚者可加沙参和麦冬等;阳虚者加巴戟天、肉苁蓉和杜仲等。上述中药由我院药房提供并按正规流程制备,每日一剂水煎至150 ml,每日3 次,连续服用30日为一个疗程。
1.2.2T淋巴细胞绝对数量检测 完全依照1997年美国CDC颁布的《CD4+T细胞和CD8+T细胞绝对值检测指导方法》严格执行。具体步骤:将20 μl CD4FITC/CD8PE/CD3PerCP试剂加入BD公司TruCOUNT管中,逆向加样法加入50 μl EDTA抗凝血,室温避光15 min,加入经10倍稀释的免洗溶血素450 μl,室温避光15 min,样本溶血充分后采用流式细胞仪FACSCalibur检测,MULTISET 软件进行分析。
1.2.3CD8+T细胞表面NKG2D和NKG2A的表达 具体步骤:采用荧光标记的单克隆抗体组合CD3 PE-Cy7/CD8 Percp-Cy5.5/NKG2D APC/NKG2A PE 对治疗组和健康对照组的外周静脉血进行表面染色,即每个研究对象均有一管按上述组合染色的样本管,另设一管同型对照管。样本管内加入100 μl EDTA抗凝全血,按上述组合的单克隆抗体分别加入样本管内,室温避光25 min后加入溶血素3 ml,继续室温避光8 min溶血充分后,300 g离心10 min弃上清。加入3 ml PBS进行洗涤,室温下300 g离心10 min后弃上清,共洗涤2次。最终加入含有1%多聚甲醛的PBS 200 μl悬浮,采用BD FACSCalibur的CellQuest软件检测,FlowJo7.6软件分析。
1.2.4CD8+T淋巴细胞体外功能检测 具体步骤:使用Ficoll-Hypaque通过密度梯度离心法,提取外周静脉血单个核细胞(PBMC),用含10%胎牛血清的RPMI1640培养液将PBMC的浓度调整为2.0×105ml-1,加入50 ng/ml的PMA和1 μg/ml的离子霉素,加入抗 CD107a 抗体和GolgiStop,在96孔板中进行培养,同时孔板底部加入100 μg/ml的链霉素和100 U/ml的青霉素。37℃ 5% CO2浓度的培养箱共同孵育4 h。用抗体组合CD3-PE/CD8-Percp进行表面染色。使用BD Cytofix/CytopermTMFixation/Permeabilization Kit在4℃破膜30 min,4℃下进行胞内染色 IFN-γ-FITC和granzyme B-FITC避光30 min,最终用含有1%多聚甲醛的PBS 200 μl悬浮。采用FACSCalibur的CellQuest软件检测,FlowJo7.6软件分析。
1.2.5生存质量评价 根据Karnofsky评分评价患者的生存质量。降低:比治疗前评分减少≥10分;平稳:治疗前后评分变化幅度≤10分;提升:比治疗前评分升高≥10分[14]。
1.3统计学处理 采用SPSS20.0软件进行分析,计量资料用中位数的95%可信区间表示。各组间两两比较采用Mann-WhitneyU检验,筛选影响因素采用有序多元Logistic回归分析,相关性采用Spearman 秩相关检验,P<0.05表示差异有统计学意义。
2 结果
2.1CD4+T和CD8+T细胞绝对值在NC组、治疗前组和治疗后组的差异 NC组的CD4+T细胞绝对值显著高于治疗前组和治疗后组(P<0.01);治疗前组和治疗后组的CD4+T细胞绝对值无显著性差异,见表1。NC组的CD8+T细胞绝对值显著高于治疗前组和治疗后组(P<0.01);治疗后组的CD8+T细胞绝对值显著高于治疗前组(P<0.01),见表1和图1A。
2.2CD8+T细胞表面NKG2D+和NKG2A+的百分比在NC组、治疗前组和治疗后组表达的差异
2.2.1NC组的NKG2D+CD8+T细胞的百分比显著高于治疗前组和治疗后组(P<0.01);治疗后组显著高于治疗前组(P<0.05),见表1和图1B。
2.2.2NC组的NKG2A+CD8+T细胞的百分比显著低于治疗前组(P<0.01);NC组也显著低于治疗后组(P<0.05);而治疗前组和治疗后组差异无统计学意义,见表1和图1C。
2.3NC组、治疗前组和治疗后组CD8+T细胞表达CD107a、颗粒酶B以及分泌IFN-γ占百分比
2.3.1治疗前组CD107a+CD8+T细胞的百分比显著低于NC组(P<0.01);治疗后组CD107a+CD8+T细胞的百分比也显著低于NC组(P<0.01);但是治疗前组和治疗后组间差异无统计学意义,见表1、图2A。
2.3.2治疗前组Granzyme B+CD8+T细胞的百分比显著低于NC组(P<0.01);治疗后组Granzyme B+CD8+T细胞的百分比也显著低于NC组(P<0.01);但是治疗前组和治疗后组间差异无统计学意义,见表1、图2B。
2.3.3治疗前组IFN-γ+CD8+T细胞的百分比显著低于NC组(P<0.01);治疗后组IFN-γ+CD8+T细胞的百分比显著低于NC组(P<0.01);治疗后组IFN-γ+CD8+T细胞的百分比显著高于治疗前组(P<0.01),见表1、图2C。
2.4治疗前组和治疗后组相关性分析
2.4.1在治疗前组,NKG2D+CD8+T与CD107a+CD8+T细胞的百分比呈正相关(P<0.05,r=0.39),见图3A;NKG2D+CD8+T与IFN-γ+CD8+T的百分比呈正相关(P<0.05,r=0.38),见图3B。
2.4.2在治疗后组,NKG2D+CD8+T与CD107a+CD8+T细胞的百分比呈正相关(P<0.01,r=0.49),见图4A;NKG2D+CD8+T与Granzyme B+CD8+T细胞的百分比呈正相关(P<0.05,r=0.38),见图4B;NKG2D+CD8+T与IFN-γ+CD8+T的百分比呈正相关(P<0.05,r=0.36),见图4C。
2.5治疗后生存质量评价 31例患者治疗前后Karnofsky评分的变化,其中7例患者评分升高≥10分,占总体的22.0%;19例患者评分变化幅度≤10分,占总体的61.2%;5例患者评分减少≥10分,占总体的16.1%。83.9%的患者治疗后生存质量都稳中有升。
表1 治疗前、治疗后和NC组各项指标的比较(%,中位数的95%可信区间)
Tab.1 Comparison of indicators in pre-treatment group, post-treatment group and NC group (%,median and 95%CI)

GroupsnCD4+T(cells/μl)CD8+T(cells/μl)NKG2D+(%)NKG2A+(%)CD107a+CD8+T(%)Granzyme B+CD8+T(%)IFN-γ+CD8+T(%)Pre31449(268,623)347(241,437)2)87.5(77.6,90.0)2)9.2(3.7,15.1)2)33.3(26.5,38.8)2)6.4(3.7,7.2)2)13.5(5.4,16.5)2)Post31495(343,672)426(366,547)2)89.9(83.2,93.7)2)5.6(2.6,10.9)1)34.6(29.0,39.8)2)6.5(5.2,8.5)2)17.9(11.5,22.7)2)NC21946(746,1138)679(527,863)95.4(92.2,97.1)2.9(2.2,4.9)50.9(45.3,55.5)28.8(25.5,32.0)56.3(51.1,60.0)
Note:Compared with NC group,1)P<0.05,2)P<0.01.
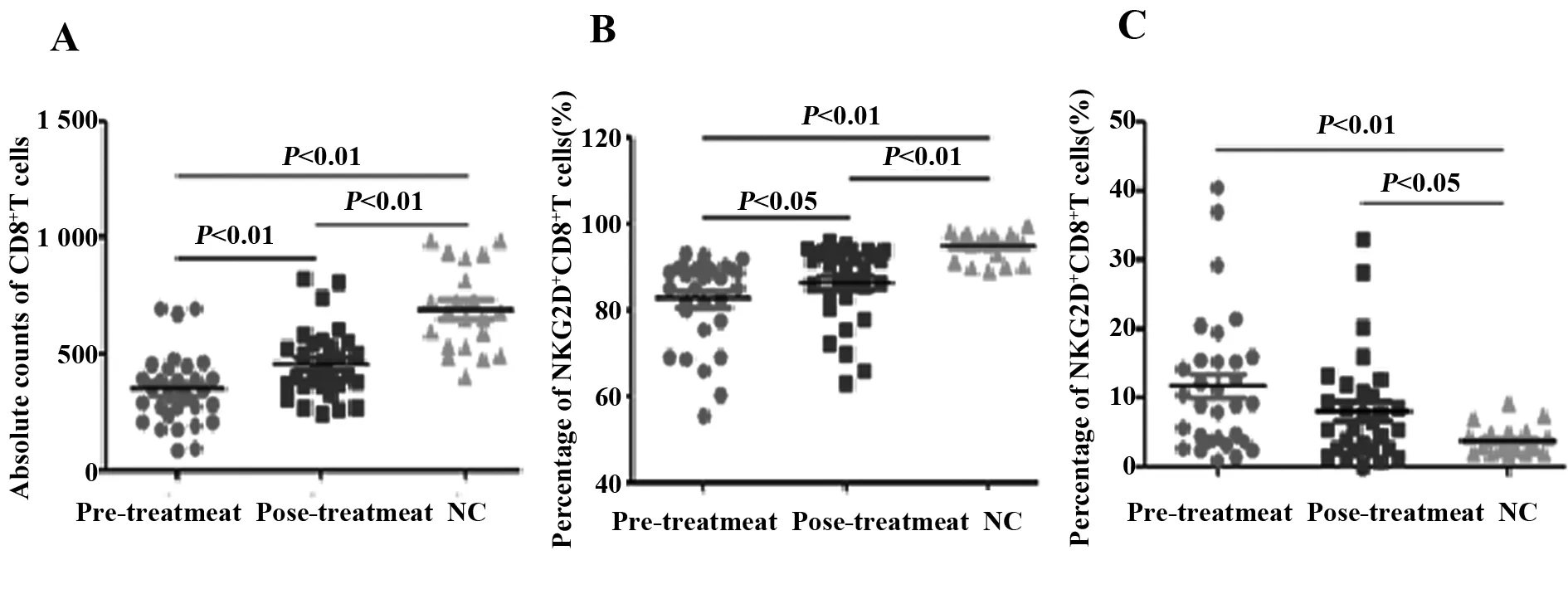
图1 治疗前组、治疗后组和NC组CD8+T细胞绝对值、NKG2D+CD8+T(%)、NKG2A+CD8+T(%)Fig.1 Percentage of NKG2D+CD8+T cells,NKG2A+CD8+T cells and absolute counts of CD8+T cells among pre-treatment group,post-treatment group and NC groupsNote: A.Ccomparison of the absolute counts of CD8+T cells;B.Percentage of NKG2D+CD8+T cells;C.The percentage of NKG2A+CD8+T cells.
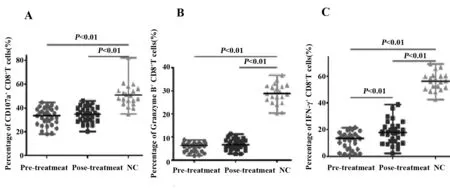
图2 治疗前组、治疗后组和NC组的CD107a+CD8+T(%)、Granzyme B+CD8+T(%)、IFN-γ+CD8+T(%)Fig.2 Percentage of CD107a+CD8+T cells,Granzyme B+CD8+T cells,IFN-γ+CD8+T cells among pre-treatment group,post-treatment group and NC groupNote: A.Percentage of CD107a+CD8+T cells;B.Percentage of Granzyme B+CD8+T cells;C.Percentage of IFN-γ+CD8+T cells.
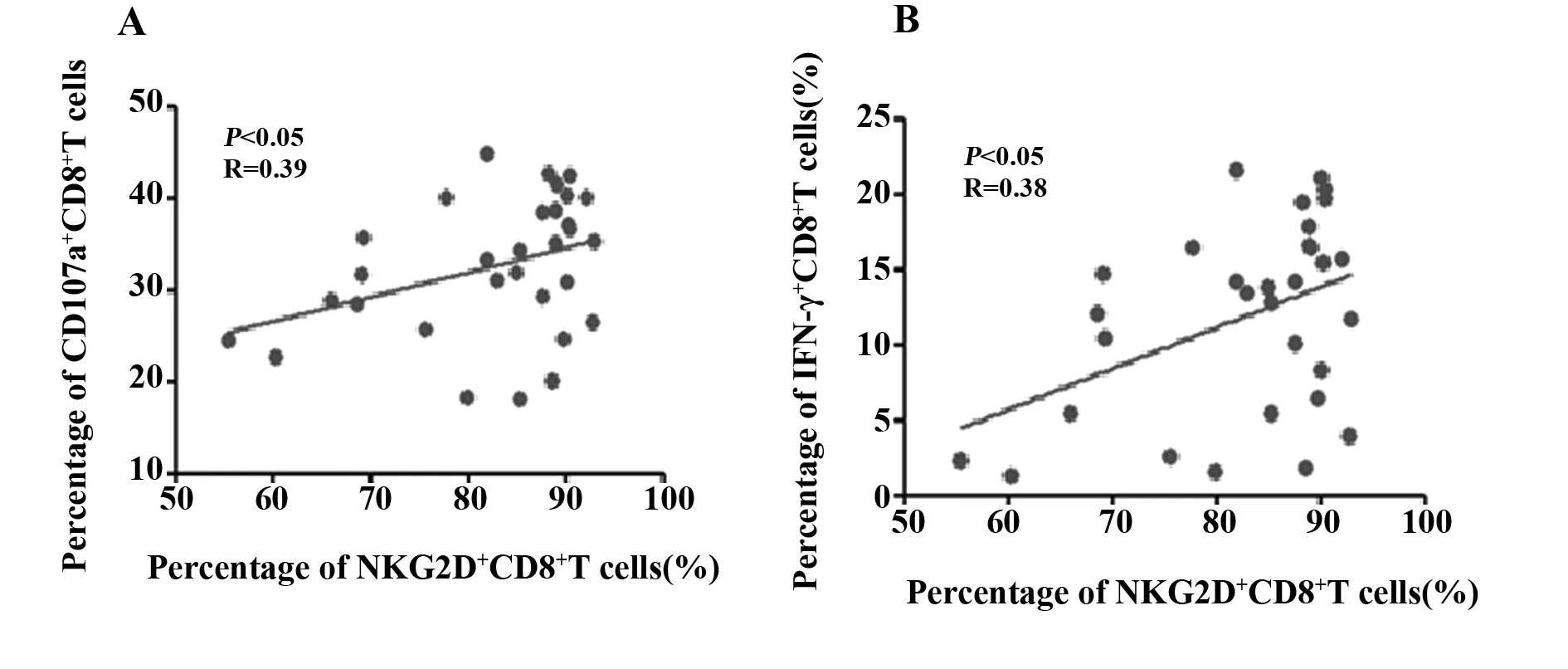
图3 NSCLC患者治疗前组的相关性分析Fig.3 Correlation analysis of pre-treatment group in patients with NSCLCNote: A.The correlation of the percentage of NKG2D+CD8+T cells and percentage of CD107a+CD8+T cells in pre-treatment group;B.The correlation of the percentage of NKG2D+CD8+T cells and percentage of IFN-γ+CD8+T cells in pre-treatment group.
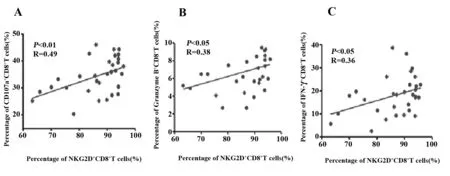
图4 NSCLC患者治疗后组的相关性分析Fig.4 Correlation analysis of post-treatment group in patients with NSCLCNote: A.The correlation of the percentage of NKG2D+CD8+T cells and percentage of CD107a+CD8+T cells in post-treatment group;B.The correlation of the percentage of NKG2D+CD8+T cells and percentage of Granzyme B+CD8+T cells in post-treatment group;C.The correlation of the percentage of NKG2D+CD8+T cells and percentage of IFN-γ+CD8+T cells in post-treatment group.
表2 有序多元logistic回归分析
Tab.2 Ordered multiple logistic regression analysis
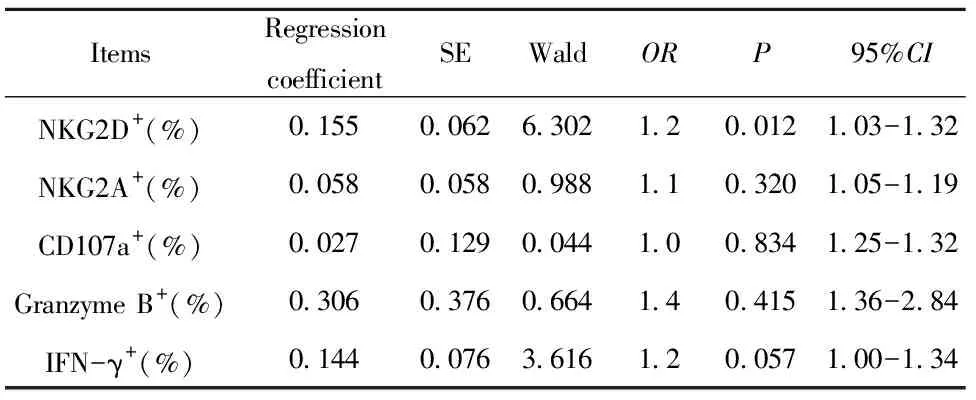
ItemsRegressioncoefficientSEWaldORP95%CINKG2D+(%)0.1550.0626.3021.20.0121.03-1.32NKG2A+(%)0.0580.0580.9881.10.3201.05-1.19CD107a+(%)0.0270.1290.0441.00.8341.25-1.32Granzyme B+(%)0.3060.3760.6641.40.4151.36-2.84IFN-γ+(%)0.1440.0763.6161.20.0571.00-1.34
2.6有序多元Logistic回归分析 建立有序多元Logistic回归模型,以NKG2D+、NKG2A+、CD107a+、Granzyme B+、IFN-γ+CD8+T的百分比为协变量,以服用扶正抗癌方后生存质量评价由降低、平稳至提升的不同等级作为因变量进行Logistic回归分析,结果显示NKG2D+CD8+T的百分比的升高与治疗后生存质量评价等级的提升有关(P<0.05,见表2);IFN-γ+CD8+T的百分比的升高可能与治疗后生存质量评价等级的提升有关(P=0.057,见表2),其他因素暂时未发现与治疗后生存质量评价等级的提升有关。
3 讨论
肺癌因虚得病,因虚致实。肺癌患者正气虚损突出,应始终重视顾护正气。临床上扶正抗癌方常联合手术、放化疗、靶向治疗等治疗晚期肺癌,大量研究证实可明显改善晚期患者的生存质量、机体免疫力,并提升放化疗效敏感性减少其毒副作用[4,5]。中医的正气理论与现代医学的免疫理论有相通之处但不可等同,本研究旨在探索NSCLC晚期患者CD8+T细胞表达NKG2D和NKG2A受体与其细胞毒活性的关联。
众多研究表明,CTL能够有效抑制恶性实体瘤的生长[15]。本研究发现NSCLC晚期患者CD8+T细胞绝对值显著低于NC组,应用扶正抗癌方后CD8+T细胞绝对值较治疗前明显升高,有利于抑制患者体内肿瘤的生长。肿瘤浸润的NKG2D+CD8+T细胞可以识别并消除表达NKG2D配体的肿瘤细胞[16]。有研究发现CD8+T细胞表达NKG2D水平可用于判断胃癌的预后,NKG2D表达下降可能是肿瘤发生免疫逃逸的机制[17]。本研究发现治疗前组和治疗后组NKG2D+CD8+T细胞的百分比均显著低于NC组,治疗后组较治疗前组NKG2D+CD8+T细胞的百分比显著升高。NKG2A是含有酪氨酸抑制性基序的NK相关性受体,既表达于NK细胞又表达于T细胞[18]。NKG2A/CD94形成的异二聚体可与人类非经典的MHCⅠ类分子复合物HLA-E结合,传导抑制信号从而抑制NK和CD8+T细胞的活性[19]。最新研究发现:阻断CD8+T细胞表面的NKG2A受体,可以提高机体对治疗性肿瘤疫苗的临床反应[20]。本研究发现治疗前和治疗后组NKG2A+CD8+T细胞的百分比均显著高于NC组,治疗前和治疗后组无显著性差异。服用扶正抗癌方后较治疗前NKG2A+CD8+T细胞的百分比虽无统计学差异但有下降的趋势,可能是由于本研究纳入的样本量偏小。
CD107a通常不存在于T 细胞的表面,只有细胞活化脱颗粒后才暴露于细胞表面,可作为CD8+T细胞脱颗粒的标志[21]。颗粒酶B主要存在于CTL的颗粒内,其破坏靶细胞需要依赖于穿孔素[22,23]。本研究发现治疗前组和治疗后组CD107a+CD8+T和Granzyme B+CD8+T细胞的百分比均显著低于NC组,而治疗前和治疗后组却无显著性差异。说明NSCLC晚期患者CD8+T细胞的脱颗粒细胞毒活性即溶解肿瘤细胞的能力较健康人显著下降。服用扶正抗癌方后 CD8+T细胞的脱颗粒活性虽有小幅度升高,但并未产生显著性差异可能是由于纳入样本量偏少。IFN-γ不仅可以诱导抗原提呈细胞(APC)的提呈作用,还可以上调APC上的MHCⅠ/肽复合物,使抗原特异性CD8+T细胞再次活化和增殖,活化的肿瘤抗原特异性CD8+T细胞可识别肿瘤细胞并向其传送致肿瘤细胞死亡剂量的细胞毒性分子[24]。因此IFN-γ是抗肿瘤和细胞内病原体的关键细胞因子。本研究发现治疗前和治疗后组IFN-γ+CD8+T细胞的百分比均显著低于NC组,服用扶正抗癌方后较治疗前IFN-γ+CD8+T细胞的百分比显著升高。上述结果表明扶正抗癌方能有效提升CD8+T细胞IFN-γ的释放,有利于清除患者体内的肿瘤细胞。
本研究发现无论是治疗前还是治疗后组NKG2D+CD8+T与IFN-γ+CD8+T的百分比均呈正相关,NKG2D+CD8+T与CD107a+CD8+T细胞的百分比也均呈正相关。在治疗后组NKG2D+CD8+T与Granzyme B+CD8+T细胞的百分比呈正相关。上述结果说明NSCLC晚期患者CD8+T细胞表达活化性受体NKG2D水平与其细胞毒活性呈正相关,服用扶正抗癌方后CD8+T细胞表达NKG2D和分泌IFN-γ显著升高,说明扶正抗癌方确实可以明显改善CD8+T细胞杀伤肿瘤细胞的细胞毒活性。与上述结果相对应的患者服用扶正抗癌方后,83.9%的患者生存质量评价稳中有升,只有16.1%的患者生存质量评价下降。Logistic回归分析结果显示服用扶正抗癌方后,NKG2D+CD8+T的百分比的升高与治疗后生存质量评价等级的提升有关。印证扶正抗癌方可以明显改善CD8+T细胞的细胞毒活性和患者的生存质量。近年来兴起的T细胞治疗和NK细胞治疗等免疫治疗手段,已被证实联合应用可增强抗肿瘤的疗效。为了获得更好的疗效也可以尝试靶向治疗等多种疗法与扶正抗癌方的联合应用[25]。
综上所述,NSCLC晚期患者遵循辨证施治原则,服用扶正抗癌方一个月后大部分患者生存质量稳中有升,相应的CD8+T细胞的绝对数量以及表达NKG2D和分泌IFN-γ均显著升高,而且表达NKG2D升高与细胞毒活性提升呈正相关,所以扶正抗癌方有助改善患者预后和提高生活质量。