新型腺病毒载体肺结核疫苗的免疫原性研究①
2020-04-13史晓雨隋秀文高德进魏梦函
史晓雨 隋秀文 苗 伟 高德进 王 畅 魏梦函 朱 涛
(天津科技大学,天津 300457)
结核病(tuberculosis,TB)是全球领先的传染性疾病杀手,新的结核病疫苗对于预这一流行病至关重要[1]。自从1921年引入目前唯一获得许可的卡介苗(Bacillus calmette guerin,BCG)以来,很少有新的候选疫苗或策略进入临床实验,并且BCG只有效保护儿童,对成人肺结核没有保护力[2]。Ag85A抗原是结核分枝杆菌(mycobacterium tuberculosis,MTB)表面抗原中免疫原性最强的蛋白之一,主要诱导T细胞免疫应答[3]。单独接种Ag85A疫苗能够有效激发机体特异性免疫应答,从而抑制MTB侵染能力[4]。但是,MVA-85A新型肺结核疫苗在临床Ⅱb期的失败[5]说明,单独Ag85A抗原诱导的免疫应答,并不足以成功预防肺结核。相关文献指出,将MTB早期分泌靶点抗原ESAT6、杆菌潜伏期抗原rv3407、杆菌复苏相关抗原RpfB三个基因融合,Ad5作为病毒载体来表达3Ag融合蛋白,在小鼠模型中显示了很好的免疫原性[6]。本实验开发了一种以Ad5为载体的新型双价肺结核疫苗,涵盖了Ag85A、ESAT6、rv3407以及RpfB四种不同抗原,扩大了抗原的保护范围,为肺结核各个阶段提供较为全面的保护。
1 材料与方法
1.1材料
1.1.1试验动物 试验用鼠购自北京维通利华实验动物技术有限公司,普通级别BALB/c雌性小鼠,4~6周龄。
1.1.2免疫材料及试剂 Ad5-TPA-3Ag与Ad5-Ag85A毒种均由康希诺生物股份公司纯化保存;ELISpot试剂盒购自瑞典Mabtech公司;细胞因子染色试剂盒购自德国美天旎生物技术有限公司;ELISA检测用辣根过氧化物酶标记(HRP*)的山羊抗小鼠抗体购自北京博奥龙免疫技术有限公司;ELISA平板与1640培养基购自美国康宁公司。
1.2方法
1.2.1单价和双价疫苗制备 Ad5-Ag85A单价疫苗以5×107IF U/ml剂量免疫,双价疫苗Ad5-Ag85A与Ad5-TPA-3Ag分别以1∶0.2、1∶1、1∶2、1∶4 剂量进行配制,同时设置生理盐水组作为阴性对照,充分混匀,备用。
1.2.2试验分组及免疫流程 BALB/c雌性鼠随机分配为六组,42只/组,共252只。第一组接种Ad-Ag85A单价疫苗,第二至第五组分别接种剂量比例为1∶0.2、1∶1、1∶2、1∶4的双价疫苗。共进行3次免疫,免疫间隔14 d,注射途径为后腿肌肉注射,100 μl/只。分别于每次免疫后28 d对小鼠眼球采全血及断颈处死,检测抗体效价和细胞因子水平。
1.2.3小鼠血清IgG抗体检测 原核表达的Ag85A和TPA-3Ag抗原包被浓度分别为1 μg/ml和0.25 μg/ml,4℃过夜。洗涤液(PBST)洗3次,使用1%BSA在37℃条件下封闭1 h。供试品血清进行倍比稀释,37℃孵育1 h。Ag85A板中的酶标抗体进行1∶8 000稀释,TPA-3Ag板中的酶标抗体进行1∶15 000稀释,37℃孵育1 h。TMB避光显色10 min,使用2 mol/L硫酸终止反应。于酶标仪450 nm处测定吸光度值,阴性血清OD450平均值与2.1乘积为Cutoff值,样品血清OD450大于Cutoff值为阳性,对应最大稀释倍数作为抗体效价。
1.2.4小鼠脾细胞分离及体外刺激 小鼠断颈处死,取出脾脏,浸入3 ml RPMI1640培养基于培养皿中,剪碎研磨出脾细胞,400 g,4℃离心5 min。去上清,每脾加3 ml ACK裂解液常温裂解5 min,加入12 ml PBS终止裂解,400 g,4℃离心5 min。去上清后重悬于4.2 ml RPMI完全培养基中,分至96孔U板中,每孔2×106个细胞,100 μl/孔。分别加入用RPMI培养基稀释的Ag85A和TPA-3Ag肽库,终浓度2 μg/ml,终体积200 μl。充分混匀后置于37℃,5%CO2培养箱培养2 h后加入1∶1 500倍稀释的高尔基体阻断剂(GolgiStop),每孔30 μl,继续刺激4 h后收集细胞,进行细胞染色。
1.2.5细胞内细胞因子染色(ICS) 经6 h刺激的脾细胞400 g,4℃离心5 min,弃上清,重悬于MACS缓冲液,100 μl/孔,并转移至96 V孔板,400 g,4℃离心5 min。准备MACS Buffer稀释好的CD3-FITC,CD4-PerCP荧光抗体,每孔50 μl,4℃避光孵育20 min。孵育结束后每孔加入150 μl PBS溶液,离心弃上清重悬于MACS缓冲液,充分吹打混匀,立刻加入Cytofix/Cytoperm TM Fixation and Permeabilizaiton Solution,150 μl/孔,反复吹打混匀,4℃过夜后离心去上清,每孔加入100 μl 1×Perm/wash Buffer,孵育5 min,400 g,4℃离心5 min。准备1×Perm/wash Buffer稀释好的IFNγ-PE和IL2-APC荧光抗体,每孔加入50 μl,4℃孵育30 min。结束后加入150 μl PBS溶液,离心去上清,重悬细胞于200 μl/孔MACS Buffer,混匀,4℃储存。分析时,转移至流式细胞仪分析用管,并加PBS至终体积500 μl上样。
1.2.6ELISpot检测IFN-γ 按照试剂盒说明书将ELISpot平板用70%乙醇活化2 min,加入浓度为5 μg/ml 抗小鼠IFN-γ抗体,4℃过夜包被,RPMI1640完全培养基室温封闭2 h。按照每孔1×105个细胞接种平板,每孔50 μl,Ag85A和TPA-3Ag肽库按照终浓度2 μg/ml分别与脾细胞1∶1 混合,同时设置PMA刺激孔作为阳性对照,无细胞刺激孔为阴性对照,置于37℃,5%CO2培养箱过夜培养。次日用PBS洗板5次拍干,加入以1∶1 000 PBS稀释的R4-6A2-biotin抗体,每孔50 μl,室温孵育2 h。孵育结束后弃去液体,PBS溶液洗5次,加入50 μl用PBS按1∶1 000倍稀释好的Streptavidin-ALP,室温孵育1 h。之后弃去液体,PBS洗5次,每孔加入100 μl BCIP/NBT,用0.45 μm滤膜过滤,直到出现明显的斑点,随后用大量纯化水温柔清洗以终止反应。晾干平板后读数。
1.3统计学处理 统计分析采用GraphPad InStat软件,对抗原特异性IgG的滴度ELISA检测,抗原特异性免疫应答细胞的ELISpot和ICS检测的结果进行分析,组间比较分析采用t检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1体液免疫应答评价 使用ELISA法检测小鼠血清中Ag85A特异性和TPA-3Ag特异性IgG抗体滴度,结果如图1所示。对于Ag85A特异性抗体反应结果,单价和双价疫苗均引起体液免疫应答;两次免疫抗体水平最佳;单价Ag85A优于各双组分疫苗,双价疫苗间无明显差异。对于TPA-3Ag特异性抗体滴度结果,双价疫苗各组均产生很强的体液免疫应答;第三次免疫抗体水平最高,效果最好;除双价1∶0.2剂量组一免IgG抗体滴度显著低于其他组外(P<0.05),各双组分疫苗之间无差异。
2.2ICS结果 首先,划分出淋巴细胞中的CD4+细胞,再分析此细胞群落的IFNγ+、IFNγ+IL2+、IFNγ-IL2+细胞,结果如图2所示。
图3展示了Ag85A特异性细胞免疫检测。一免(A)、二免(B)和三免(C)后ICS检测Ag85A特异性CD4+T细胞的数量。图中可以看出,单价和双价疫苗均引起Ag85A特异性细胞免疫应答;一免时,1∶1剂量组比1∶2和1∶4组CD4+T细胞数量多,其他组无显著差异;第二次产生针对Ag85A特异性CD4+T细胞的数量最多,双价1∶1剂量组较1∶0.2组有明显差异,1∶4组有差异;三免中1∶1剂量组诱导CD4+T细胞比1∶0.2和1∶2组多,有差异。
图4反映了TPA-3Ag特异性细胞免疫检测。一免(A)、二免(B)和三免(C)后ICS检测TPA-3Ag特异性CD4+T细胞数量。一、二、三免中,各双价疫苗组均引起明显的细胞免疫应答;两针免疫表现效果最优,以1∶0.2剂量组最低,有差异(P<0.05),其他双价组无明显差异;三免中1∶4配比组产生的TPA-3Ag特异性CD4+T细胞数量最多,其他剂量组无差异。

图1 Ag85A特异性和TPA-3Ag特异性IgG抗体滴度Fig.1 Titration of Ag85A-specific and TPA-3Ag-specific IgG antibodiesNote: *.P
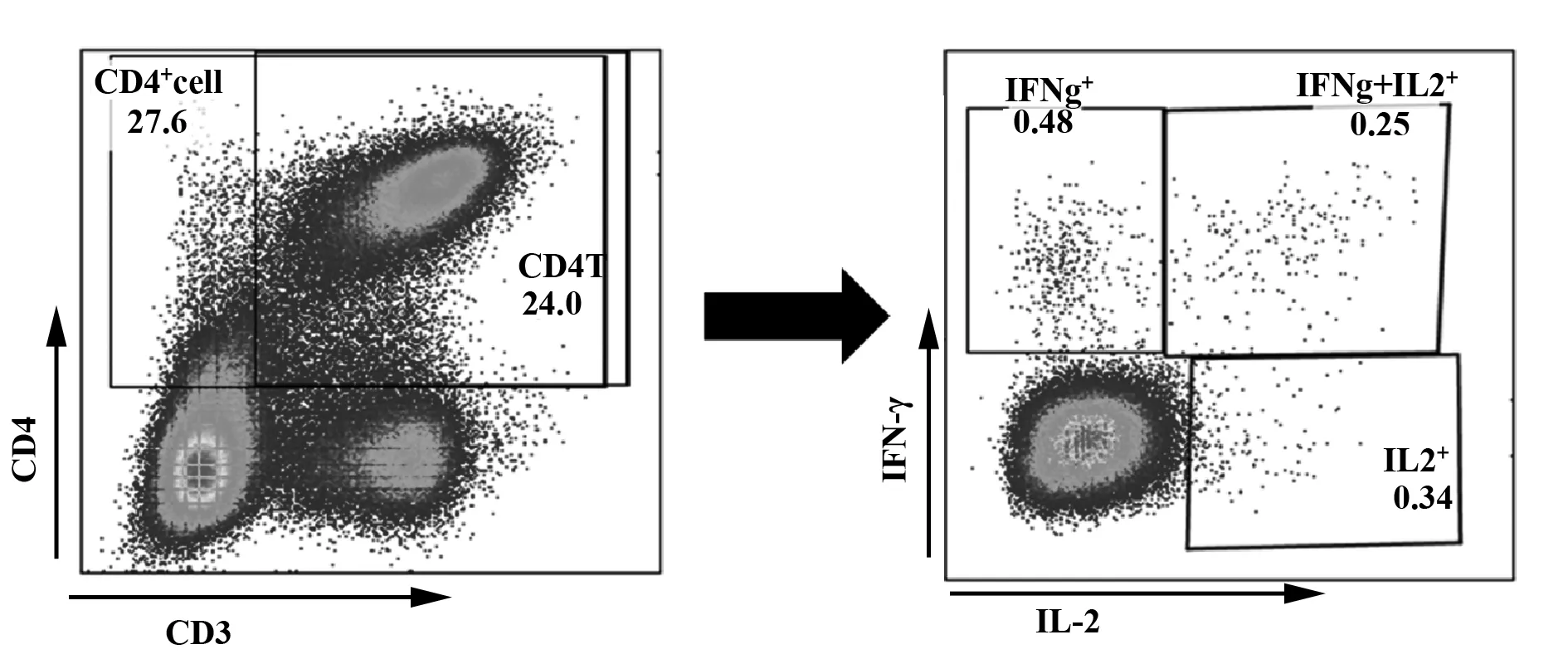
图2 流式细胞仪划分细胞步骤Fig.2 Gating strategy of flow cytometry
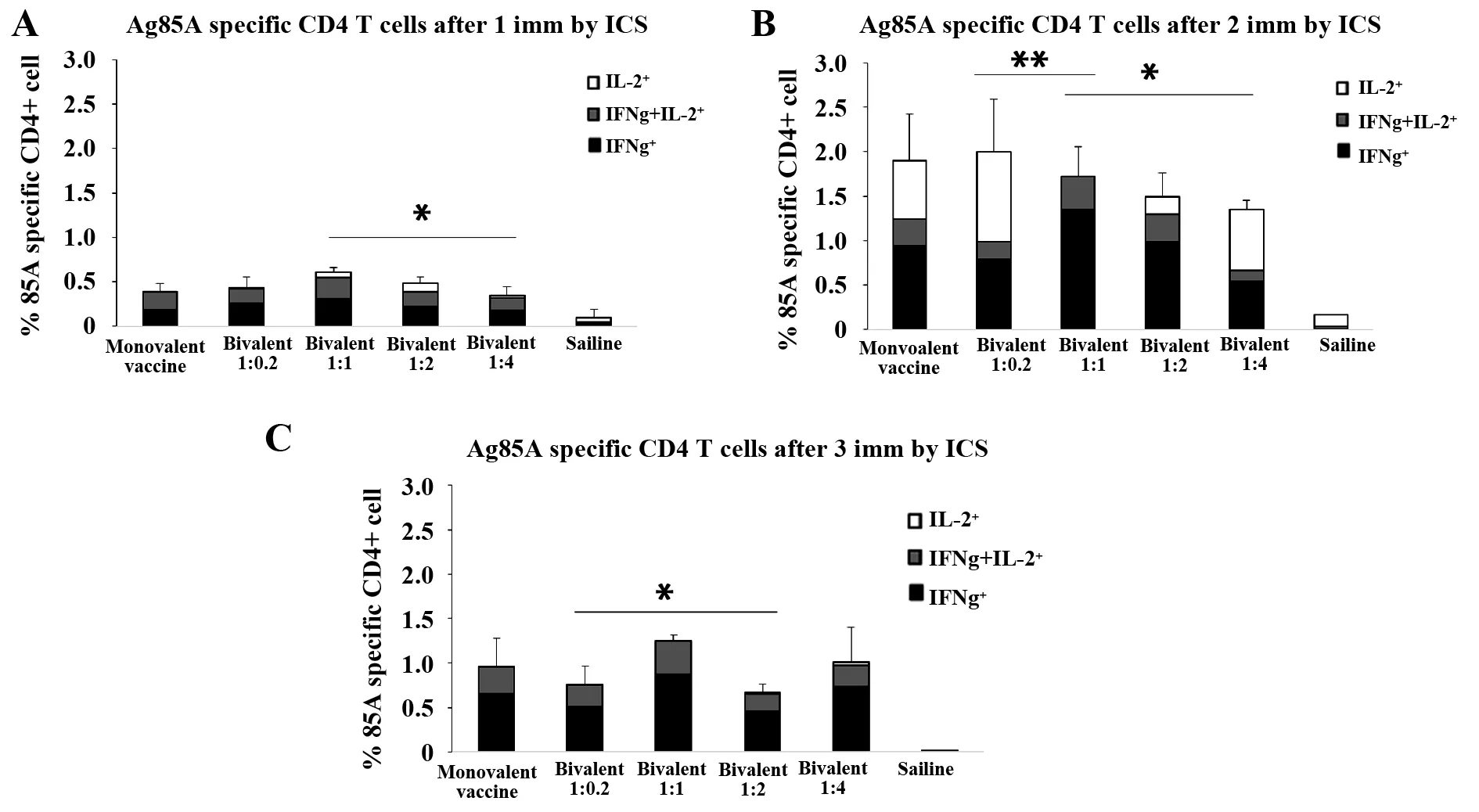
图3 Ag85A特异性细胞免疫检测Fig.3 Ag85A specific cellular immunoassayNote: *.P P
2.3ELISpot结果 Ag85A特异性IFN-γ应答细胞的数量如图5所示。A、B分别表示二免和三免产生IFN-γ应答的细胞情况。单价和双价疫苗组均产生IFN-γ,且三免强度最大;二免时,各比例组无明显差异;三免中,以双价1∶1配比组产生IFN-γ应答细胞最多(P<0.05)。
对于TPA-3Ag特异性IFN-γ应答细胞数量情况,如图6所示。各双价配比组均有相应IFN-γ应答细胞产生,且三针免疫诱导的响应细胞普遍比二免多;二免时,各组无显著性差异(图6A);三免中(图6B),双价1∶1组明显优于其他剂量组(P<0.05)。
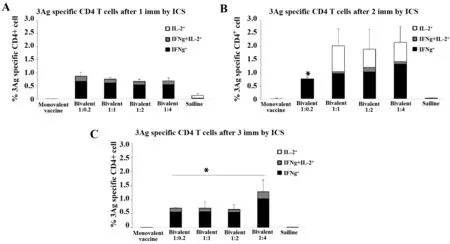
图4 TPA-3Ag特异性细胞免疫检测Fig.4 TB3-Ag specific cellular immunoassayNote:*.P
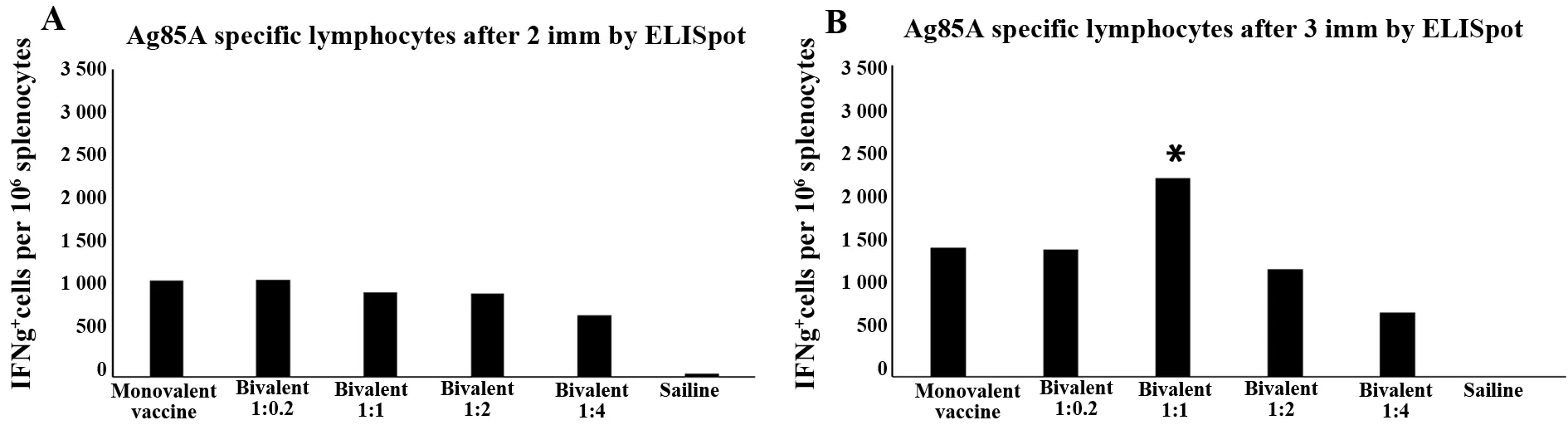
图5 Ag85A特异性细胞免疫检测Fig.5 Ag85A specific cellular immunoassayNote:*.P
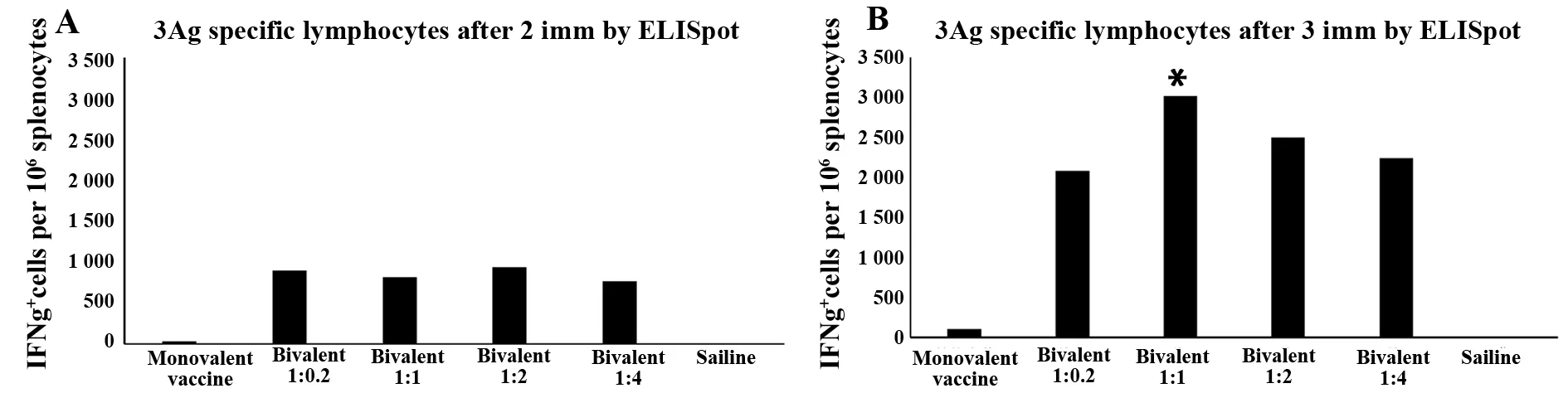
图6 TPA-3Ag特异性细胞免疫检测Fig.6 TB3Ag specific cellular immunoassayNote:*.P
3 讨论
MTB是结核病的病原体,是导致死亡的主要原因[7]。2017年,大约有1 000万人患上结核病,其中有160万人死于这种疾病,23%的世界人口有潜在结核病感染的风险,因此开发一款有效对抗结核病的疫苗刻不容缓[8]。复制缺陷型腺病毒载体安全性高,具有无佐剂参与便能引起针对病原体更为快速、有效保护效果的优点,对于预防病毒类病原体具有强大的潜力,成为疫苗领域常用的病毒载体[9]。由于腺病毒与结核分枝杆菌(mycobacterium tuberculosis,MTB)作用的靶器官均为肺,因此有文献报道使用腺病毒作为载体开发对抗结核病的新型疫苗[10]。本研究在Ag85A抗原基础上,引入MTB另外三种抗原(ESAT6、rv3407、RpfB),通过增加结核分枝杆菌不同时期的抗原,对结核病的发作进行全面预防。实验通过两种腺病毒疫苗的不同比例,进一步评价其免疫原性。
体液免疫应答结果表明,对于Ad5-Ag85A,单价Ad5-Ag85A疫苗在三次免疫下均产生体液免疫应答,且高于各组双价疫苗。Ad5-TPA-3Ag的加入,并没有增强针对Ag85A的抗体应答,反而会有抑制;针对TPA-3Ag,双价疫苗各组均产生很强的体液免疫应答;三免效果最好,且各组无明显差异。
ICS结果表明,对于Ag85A特异性细胞免疫检测,三次免疫下,各双价疫苗均产生了特异性CD4+T细胞,且1∶1剂量组表现出更好的优势。对于免疫针次,两次免疫诱导产生的特异性CD4+T细胞普遍偏高。
ELISpot结果显示,无论从Ag85A还是TPA-3Ag角度分析,两免产生的对应IFN-γ应答细胞数量比三免低,三免中以1∶1 配比最佳,其他组无差异。
大量研究表明,结核病的预防以诱导细胞免疫保护为主,即消灭细胞内病原体的免疫保护力。因此,检测抗原特异性Th1类免疫应答,即检测分泌IFN-γ细胞因子的CD4 T细胞,是评价细胞免疫保护作用的重要指标[11]。针对三免后细胞免疫应答普遍下降情况,可能与腺病毒预存免疫有关。人体内存在较高针对5型腺病毒的抗体水平,多次免疫可降低病毒载体的转录及表达,从而降低免疫原性[12]。
综上所述,双价疫苗能够诱导产生良好的体液免疫和细胞免疫应答,有望成为新型肺结核疫苗。
