鸡γ干扰素与补体C3d主要片段的串联表达及活性测定①
2020-04-13牛明福范逸文杜梦璇鲍永毅
牛明福 范逸文 杜梦璇 鲍永毅 宫 强 侯 颖
(河南科技大学食品与生物工程学院/河南省食品微生物生物工程技术中心,洛阳 471023)
干扰素(interferon,IFN)是一种具有广谱抗病毒活性的蛋白[1],具有抵抗感染和免疫调节等多种生物学活性[2]。鸡IFN-γ(chicken IFNγ,chIFN-γ)是由Sekellick等[3]从有丝分裂原刺激的鸡脾淋巴细胞中发现的,随后Digby 等[4]也成功克隆了chIFN-γ基因,进一步研究发现,chIFN-γ具有与哺乳动物一样的免疫功能[5-8],且具有疫苗佐剂效果。补体C3分子是补体三条激活途径中的枢纽,是机体防御机制中的关键分子。C3d是C3分子的裂解片段,研究发现C3d可以与CD21的结合位点存在,使其能够发挥分子佐剂的作用从而在抗原诱导的体液免疫应答中发挥重要的调节作用,不仅可以增强机体的初次免疫应答,且对再次免疫应答也具有良好的增强作用[9-12]。新型疫苗的研发离不开良好的疫苗佐剂的辅助,干扰素和补体分子单独作为免疫佐剂时具有良好的佐剂效应,而免疫细胞表面同时存在干扰素和补体分子的受体,本实验将干扰素与补体分子串联表达,研究其在鸡胚内的抗病毒活性,并作为鸡DNA疫苗的佐剂共同免疫,观察其作为免疫佐剂的效应,为疫苗佐剂的研发提供新方向。
1 材料与方法
1.1材料E.coliBL21、表达载体pET29a(+)、鸡新城疫病毒(NDV)均由本实验室保存;海兰白壳种蛋和一日龄小鸡购自洛阳公华禽业公司;限制酶、T4 DNA连接酶、Taq酶等均购自TaKaRa公司;其余试剂购自上海生工生物工程有限公司;pcDNA3.1-HA质粒为本实验构建并保存。
1.2方法
1.2.1目的基因的设计合成 根据Digby等[4]发表的chIFN-γ和C3d cDNA序列设计基因片段chIFN-γ和chIFN-γ-C3d,并分别在5′和3′端加入NdeⅠ和XhoⅠ酶切位点,由通用生物系统(安徽)有限公司合成,并分别导入表达载体pET29a(+)中构建成pET29a-chIFN-γ和pET29a-chIFN-γ-C3d载体。
1.2.2融合蛋白诱导表达 制备E.coliBL21感受态细胞,将pET29a-chIFN-γ和pET29a-chIFN-γ-C3d质粒转化导入,卡那霉素抗性筛选阳性重组子,阳性菌株提取质粒双酶切鉴定并送生工生物工程有限公司测序鉴定。鉴定正确的菌株按1%比例接入300 ml 含有卡那霉素的LB液体培养基中,37℃摇床培养3.5~4 h使OD600值达到0.6~0.8,1 mmol/L 的IPTG诱导表达。诱导后收集菌体和上清一起进行SDS-PAGE检测,分析重组蛋白的表达方式,并对诱导条件进行优化,表达产物进行Western blot检测(一抗为兔抗6×His 标签多抗,二抗为HRP标记的羊抗兔IgG单抗),检测正确后镍柱纯化重组蛋白,使用NanoDrop One超微量核酸蛋白测定仪测定蛋白含量。
1.2.3鸡胚内抗病毒活性测定 病毒滴度为210的NDV病毒液用PBS稀释至27,chIFN-γ和chIFN-γ-C3d重组蛋白浓度分别设置梯度为1 μg/ml、5 μg/ml和10 μg/ml,组别分别标记为γ-1、γ-5、γ-10、γ+C-1、γ+C-5和γ+C-10,另设NDV组和鸡胚空白组。将病毒和蛋白1∶1 混合置于37℃孵育2 h后,按100 μl/胚的剂量接种到9日龄鸡胚中,NDV组病毒与PBS 1∶1 混合,100 μl/胚注射,鸡胚空白组每胚仅注射100 μl PBS,每组样品设置3个平行。接种后鸡胚继续培养,弃去24 h内死亡的,72 h后抽取尿囊液测病毒滴度,并观察鸡胚状态。
1.2.4免疫佐剂效应测定 将30日龄海兰白壳蛋鸡随机分为6组:单独的chIFN-γ组(γ组)、chIFN-γ-C3d组(γ+C组)、PcDNA3.1-HA组(HA组)、chIFN-γ+PcDNA3.1-HA组(γ+HA组)、chIFN-γ-C3d+PcDNA3.1-HA组(γ+C+HA组)、空白对照组,每组10只。chIFN-γ和chIFN-γ-C3d蛋白的用量为20 μg/只,PcDNA3.1-HA质粒为50 μg/只。在鸡30日龄时采血然后进行首免、二免和三免分别间隔两周进行。首免后每周鸡翅静脉采血分离血清测抗体,一直测到首免后的第8周。首免后第3、4、6和8周采血分离淋巴细胞,MTT法测定鸡淋巴细胞的增殖水平;并在首免后第3、6和9周采血并测量鸡体重、胸腺、脾脏和法氏囊重量,计算免疫器官指数。
2 结果
2.1重组载体的双酶切及测序鉴定结果 筛选阳性转化子并提取质粒,用XbaⅠ和XhoⅠ进行双酶切鉴定,在电泳图上显示大小约为5 000 bp和500 bp 的条带,空载体酶切后仅一个5 000 bp左右的条带,与预期片段大小相同(图1)。测序结果用DNA Star的MegAlign与模板序列比对,结果100%吻合,证明表达系统构建成功。
2.2重组蛋白表达检测和Western blot鉴定 阳性菌株诱导表达后,离心分离上清和菌体,经SDS-PAGE电泳检测,发现蛋白主要以包涵体形式存在于菌体中(图2A)。重组蛋白chIFN-γ与chIFN-γ-C3d大小分别在17 kD和21 kD,与理论值大小相符,说明蛋白可成功在E.coli中诱导表达。重组蛋白进行Western blot检测,两者都在相应位置处显色,证明两种蛋白均得以正确表达(图2B)。将菌体破碎后用镍柱对重组蛋白进行纯化(图2C),纯化后用透析袋对重组蛋白进行浓缩,浓缩后的蛋白含量为chIFN-γ 0.67 mg/ml、chIFN-γ-C3d 1.273 mg/ml。
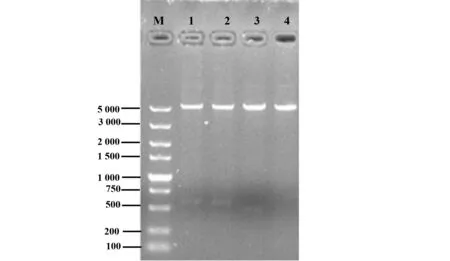
图1 重组质粒的双酶切鉴定Fig.1 Double enzyme digestion of recombinant plasmidNote:M.DL5000 marker;1,2.pET29a-chIFN-γ-C3d double digestion;3.pET29a-chIFN-γ double digestion;4.pET29a empty vector for double digestion.

图2 重组蛋白的表达纯化及Western blot鉴定Fig.2 Expression and purification of recombinant protein and Western blot identificationNote:A.1,2.chIFN-γ-C3d supernatant sample;3.chIFN-γ-supernatant sample;M.pre-stained marker (9-180)kD;4,5.chIFN-γ-C3d bacterial cell precipitation sample;6.chIFN-γ bacterial cell precipitation sample;B.1.Low molecular weight marker (14.4-97.4)kD;2,3.chIFN-γ-C3d sample;4.chIFN-γ sample;5,6.chIFN-γ-C3d immunoblot sample;7.chIFN-γ Immunoblot sample;C.1.Purified γ protein;2.Purified γ+C protein;3.Low molecular weight marker (14.4-97.4)kD.
2.3重组蛋白chIFN-γ-C3d表达条件的优化 对chIFN-γ-C3d诱导表达的菌种接种量、诱导前菌液浓度、不同诱导温度、不同IPTG浓度以及不同诱导时间等条件进行优化,结果见图3,发现菌种最适接种量为1%;诱导前菌液最适浓度OD600=0.6;最适诱导温度为37℃;IPTG浓度为1 mmol/L;诱导时间12 h。
2.4鸡胚内抗病毒活性测定结果 收集8组鸡胚尿囊液测定病毒滴度,结果见图4,可见不同浓度的chIFN-γ和chIFN-γ-C3d组的病毒滴度均低于NDV对照组,chIFN-γ组随着蛋白浓度增加,病毒滴度下降,chIFN-γ-C3d蛋白低浓度时,病毒滴度降低,蛋白浓度高时病毒滴度反而上升,是串联表达的影响、鸡胚个体原因、还是实验误差,后续将进一步实验验证。γ-10组和γ+c-1、γ+c-5组与NDV对照组相比均降低了3个滴度,差异性极显著(P<0.01),说明表达的chIFN-γ-C3d与chIFN-γ都具有抗病毒活性。
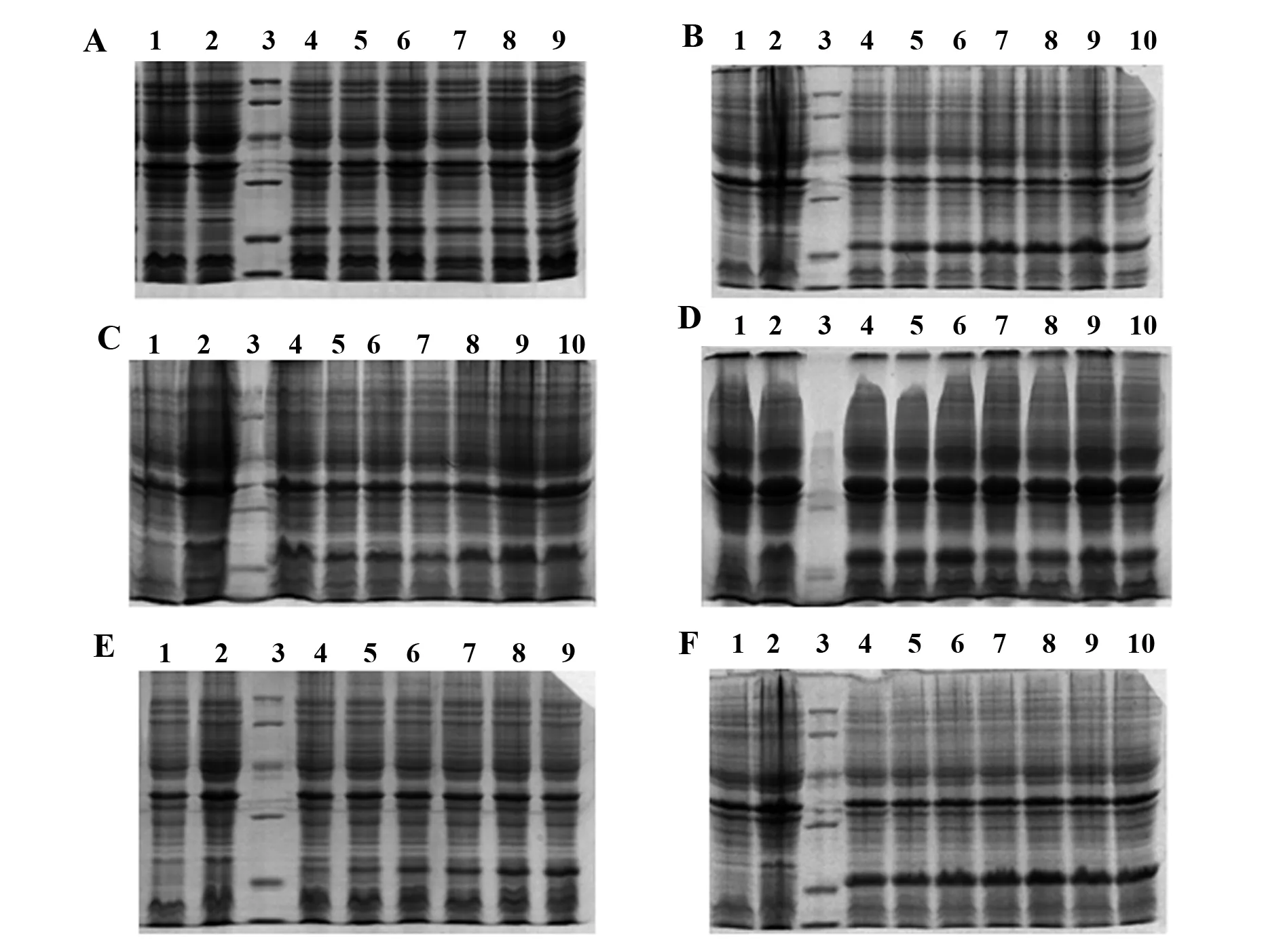
图3 不同诱导条件表达的chIFN-γ-C3d的SDS-PAGE电泳图Fig.3 SDS-PAGE electropherogram of different optimi-zation conditionsNote:1.Empty vector control;2.Uninduced control 3.Low protein marker (14.4-97.4)kD;A4-9.Inoculum 1%,2%,3%,4%,5%,6%;B4-10.different concentrations of OD600:0.2,0.4,0.5,0.6,0.7,0.8,and 1.0;C4-10.Induction at different tem-peratures:16℃,18℃,20℃,30℃,37℃,42℃;D4-10.Cons-entration of IPTG:0.5,0.75,1,1.5,2,2.5 and 3 mmol/L;E4-9.Induction time:1 h,2 h,4 h,6 h,8 h,10 h;F4-10.Induction time:12 h,14 h,16 h,18 h,20 h,22 h,24 h.

图4 鸡胚内抗病毒活性测定Fig.4 Determination of antiviral activity in chicken embryos

图5 免疫后鸡血清HI抗体变化Fig.5 Chicken serum HI antibody curve after immunization
鸡胚胚体观察,NDV对照组24 h死亡一只,存活的鸡胚胚体通红,背部、脑后、翅下多处大面积出血;空白组体表未见出血点,体型特征正常;γ-1、γ+c-1组背部、脑后均可见出血点,但出血点与出血点面积少于NDV对照组;γ-5、γ+c-5组背部均未见出血点,仅脑后可见出血点;γ-10、γ+c-10组背部和脑后均未见出血点,但胚体比空白组小(图略)。
2.5鸡体内HI抗体水平检测结果 抗体检测结果见图5,HA组、γ+HA和γ+C+HA组抗体水平持续升高,且与HA组相比,γ+C+HA组抗体水平更高,差异极显著(P<0.01)。第7周开始γ+C+HA组的抗体水平均高于γ+HA组,差异有极显著统计学意义(P<0.01)。初步说明chIFN-γ和chIFN-γ-C3d都可以促进鸡体内抗体的产生,且chIFN-γ-C3d的作用比chIFN-γ更显著。
2.6鸡淋巴细胞MTT检测结果 分离鸡外周血淋巴细胞,MTT法测定免疫细胞增殖活性,结果见图6。

图6 淋巴细胞增殖试验结果Fig.6 Lymphocyte proliferation test results

图7 免疫器官指数变化Fig.7 Changes of immune organs IndexNote: A.Spleen;B.Thymus;C.Bursa.
HA、γ+HA和γ+C+HA组淋巴细胞均显示出较高的增殖活性,且γ+C+HA组增殖活性更高,与HA组差异有极显著统计学意义(P<0.01),与γ+HA相比差异显著(P<0.05),说明chIFN-γ-C3d、chIFN-γ都具有促进淋巴细胞增殖的作用,并且chIFN-γ-C3d比chIFN-γ作用更强,差异显著(P<0.05)。
2.7鸡免疫器官增长指数测定结果 首免后第3、6和9周每组分别随机选取3只鸡,测量体重,脾脏、胸腺和法氏囊重量,计算免疫器官指数,结果见图7。各组免疫器官指数在第6周最高,第9周已经降低,这应该与鸡免疫器官的发育规律有关,但从免疫器官指数可以看出,虽然第6周时γ+C+HA组都不是最高,甚至低于其他组,但到第9周时,γ+C+HA组胸腺指数和法氏囊指数都高于其他组,与γ+HA组相比差异极显著(P<0.01),说明chIFN-γ-C3d可以明显延缓免疫器官衰退的时间,有助于维持机体的免疫功能。
3 讨论
在国内外干扰素和补体的研究中,人和哺乳动物均有报道[13,14],可作为佐剂在多种疾病的预防和治疗中产生良好效果。Schlaepfer等[15]发现IFN-α基因对HIV的复制具有良好抑制作用。Zhao等[11]发现含有C3d的融合蛋白表达可提高免疫效果,Amanda 等[12]发现补体是抗微生物抗体的反应中的关键佐剂。对禽类的相关研究,禹航等[16]将鸡的IFN-γ在大肠杆菌中表达并分析了抗IBDV活性,表明IFN-γ对IBDV有明显的抑制作用。刘栋[17]研究了重组鸡C3d的免疫佐剂效果,证明不管是体外表达的C3d蛋白还是与DNA共同构建成疫苗,都具有较好的免疫增强效果。
本实验在大肠杆菌中串联表达的chIFN-γ与补体C3d的主要片段,鸡胚内抗NDV测定表明,chIFN-γ-C3d和单独表达的chIFN-γ都有抑制NDV病毒增殖的作用。与DNA疫苗共同免疫的测定表明chIFN-γ-C3d比单独的chIFN-γ能辅助DNA疫苗产生更高水平的抗体,促进淋巴细胞的增殖,延缓免疫器官的衰退时间。结果表明原核表达的chIFN-γ-C3d对PcDNA3.1-HA具有免疫佐剂作用,可以作为一种新型疫苗佐剂应用于DNA疫苗。
