miR-34a通过靶向SIRT1对MPP+诱导的帕金森病模型细胞凋亡和氧化应激损伤的影响①
2020-04-13刘金泉孙永胜刘春云
刘金泉 孙永胜 刘春云
(山西大同大学神经病学与精神病学教研室,大同 037009 )
微小RNAs(miRNAs)是一类长度通常为22~30 nt的小分子RNA,通过降解靶基因或抑制靶基因翻译调控转录后的基因表达,被证实在帕金森病(parkinson′s disease,PD)神经细胞凋亡和氧化应激等过程中发挥着重要作用[1-3]。1-甲基-4-苯基吡啶离子(MPP+)是一种可引起神经细胞氧化应激损伤和细胞凋亡的神经毒,常被作为帕金森病细胞模型的诱导剂[4,5]。近年来,有研究显示,在MPP+诱导的帕金森病细胞模型中miR-34a表达上调,且miR-34a与PD神经细胞凋亡和氧化应激损伤密切相关[6,7],但其具体的调控机制尚不完全清楚。沉默信息调控因子1(SIRT1)是一种组蛋白去乙酰化酶,具有烟酰胺腺嘌呤二核苷酸依赖性脱乙酰酶活性,被认为在PD发病过程中具有神经保护的作用[8]。本研究通过生物信息学软件预测发现,miR-34a与SIRT1 3′-非编码区存在互补的核苷酸序列,猜测miR-34a可能通过靶向调控SIRT1表达影响PD神经细胞凋亡和氧化应激反应。因此,本研究以人神经母细胞瘤SH-SY5Y为研究对象,构建MPP+诱导的PD细胞模型,拟探讨miR-34a低表达能否通过靶向SIRT1抑制MPP+诱导的SH-SY5Y细胞凋亡和氧化应激损伤。
1 材料与方法
1.1材料 人神经母细胞瘤株SH-SY5Y购于广州中山大学细胞库。兔抗人SIRT1和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体购于美国Santa Cruz公司,MPP+、噻唑蓝(MTT)和二甲基亚砜购于美国Sigma公司,青链霉素混合液购于北京索莱宝公司,胎牛血清、胰蛋白酶和DMEM/F12培养基购于美国Gibco公司,乳酸脱氢酶(LDH)活性检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒和丙二醛(MDA)含量试剂盒购于南京建成有限公司,脂质体2000、Trizol试剂膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒和RT-PCR试剂盒购于美国Invitrogen公司,二喹啉甲酸(BCA)蛋白检测试剂盒购于北京鼎国昌盛公司。miR-34a模拟物(5′-UGGCAGUGUCUUAGGU-GGUUGU-3′)、miR-34a抑制剂(5′-UGGCAGUGUCUUAGGUGGUUGU-3′)及其相应的阴性对照miR-NC(5′-UUCUCCGAACGUGU-CACGUTT-3′)和anti-miR-NC(5′-CAGUACUUUU-GUGUAGUACAA-3′)购于百奥迈科生物公司。荧光素酶报告基因检测试剂盒购于碧云天生物技术研究所。SIRT1干扰序列siSIRT1及其阴性对照序列siNC是由上海吉玛公司设计合成。
1.2方法
1.2.1细胞培养 SH-SY5Y细胞以含10%胎牛血清和1%青链霉素混液的DMEM/F12培养基于 5%CO2的37℃恒温培养箱内常规培养。使用倒置显微镜定期观察,2 d换一次培养液,待细胞铺满瓶底80%时,以1∶3比例加入胰蛋白酶消化传代。采用生长状况良好的第3代指数期细胞进行实验。
1.2.2MPP+作用浓度的筛选 将指数期的SH-SY5Y细胞以每孔200 μl(浓度为6×104个/ml)种植于96孔细胞板上,置于细胞培养箱内常规培养12 h后,加入终浓度为500、1 000和2 000 μmol/L的MPP+,其中每个浓度设置5个平行孔。于培养箱内培养48 h后,弃培养液加入150 μl(浓度为0.5 mg/ml)的MTT溶液于培养箱内反应4 h。弃上清液后,加入二甲基亚砜150 μl振荡反应10 min使MTT结晶充分溶解。采用酶标仪检测各组细胞的吸光度值,检测波长为490 nm,以对照组的百分比表示各组细胞活力。
1.2.3RT-PCR检测miR-34a和SIRT1 mRNA的表达 将指数期的SH-SY5Y细胞按照每孔3×105个种植于6孔细胞板上,于培养箱内培养12 h后加入500、1 000和2 000 μmol/L浓度的MPP+作用48 h。收集各组细胞后,参照Trizol试剂说明书步骤提取细胞总RNA,将RNA逆转录合成cDNA后,根据上海生工生物合成的PCR引物(miR-34a F:5′-CCCACTCACCGTACTAA-3′,R:5′-GTGGTTTCAAGGCCAGATGT-3′;内参U6 F:5′-CTCGCTTCGGC-AGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′;SIRT1F:5′-TGAAAGTGATGAGGAGGATAGAGCC-3′,R:5′-CAACCTGTTCCAGCGTGTCTATGT-3′;内参GAPDH F:5′-GGGAAACTGTGGCGTGAT-3′,R:5′-GAGTGGGTGTCGCTGTTGA-3′)将配制的25 μl反应体系(包含2 μl cDNA、SYRY Premix Ex TaqⅡ12.5 μl、上下引物各1 μl和ddH2O 8.5 μl)上PCR仪按照95℃ 预变性5 min,95℃变性30 s、60℃退火30 s、72℃ 延伸30 s,共循环38次的反应条件进行扩增。2-ΔΔCt法计算各组细胞中miR-34a和SIRT1 mRNA的表达。实验重复3次。
1.2.4Western blot检测 收集不同浓度MPP+作用48 h后的各组细胞,加入细胞裂解液提取总蛋白,以BCA法定量。取沸水浴变性后的总蛋白样品60 μg进行SDS-PAGE凝胶电泳分离。待分离结束后,转至聚偏二氟乙烯膜上。经含5%脱脂奶粉的封闭液室温封闭处理1 h后,加入SIRT1抗体(1∶500)和GAPDH抗体(1∶1 000)4℃下孵育24 h。以封闭液洗膜3次后,加入辣根过氧化酶标记山羊抗兔或抗鼠IgG的二抗(1∶2 000)室温孵育1 h。封闭液再次洗膜后,加入显影液显影,凝胶成像系统检测。实验重复3次。
1.2.5脂质体介导miR-34a过表达或低表达 将指数期的SH-SY5Y细胞以每孔105个种植于6孔细胞板上,置于培养箱内培养过夜。待细胞汇合度达70%时,参照脂质体2000转染试剂说明书步骤将终浓度为20 nmol/L的miR-34a模拟物、miR-34a抑制剂及其相应的对照miR-NC和anti-miR-NC转染至miR-34a组、anti-miR-34a组、miR-NC组和anti-miR-NC组中。待转染48 h后,收集各组细胞分别采用RT-PCR检测各组细胞中miR-34a、SIRT1 mRNA的表达,Western blot检测SIRT1蛋白的表达。实验重复3次。
1.2.6荧光素酶实验检测miR-34a与SIRT1的靶向关系 采用TargetscanHuman软件预测发现SIRT1可能是miR-34a的潜在靶基因。为了验证miR-34a和SIRT1是否存在靶向关系,将SIRT1的3′UTR片段克隆到psiCHECK-2荧光素酶载体上,作为SIRT1野生型(SIRT1-WT)载体;利用TaKaRa点突变试剂盒突变SIRT1 3′UTR和miR-34a的结合位点,再克隆到psiCHECK-2荧光素酶载体上,作为SIRT1突变型(SIRT1-MUT)载体。将指数期的SH-SY5Y细胞以每孔104个细胞种植于96孔细胞板上,将其分为miR-34a/anti-miR-34a+SIRT1-WT组、miR-NC/anti-miR-NC+SIRT1-WT组、miR-34a/anti-miR34a +SIRT1-MUT组和miR-NC/anti-miR-NC+SIRT1-MUT组。每组实验设置3个重复。参照脂质体2000说明书先将miR-34a模拟物、miR-34a抑制剂及其阴性对照miR-NC和anti-miR-NC分别与SIRT1-WT、SIRT1-MUT共转染至SH-SY5Y细胞中。待转染48 h后,收集各组细胞并参照荧光素酶试剂盒说明书步骤检测各组细胞的荧光素酶活性。实验重复3次。
1.2.7凋亡实验和氧化应激实验分组及处理 实验分为Control组:加入等量培养液;MPP+组:加入2 000 μmol/L MPP+;MPP++anti-miR-NC组:转染miR-NC后给予2 000 μmol/L MPP+;MPP++anti-miR-34a组:转染miR-34a抑制剂后给予2 000 μmol/L MPP+;MPP++anti-miR-34a+siNC组:共转染miR-34a抑制剂和SIRT1干扰序列的阴性对照后,给予2 000 μmol/L MPP+;MPP++anti-miR-34a+siSIRT1组:共转染miR-34a抑制剂和SIRT1干扰序列后,给予2 000 μmol/L MPP+。经MPP+作用48 h后,收集各组细胞采用流式细胞仪检测各组细胞的凋亡率,试剂盒检测细胞上清液中MDA含量和SOD、LDH活性。实验重复3次。
1.2.8流式细胞仪检测细胞凋亡 收集MPP+处理48 h后的各组SH-SY5Y细胞,以预冷的磷酸缓冲液漂洗后,加入Binding buffer 100 μl重悬细胞,分别加入Annexin V-FITC 5 μl和PI 10 μl于避光条件下染色15 min后,再次加入Binding buffer 400 μl,1 h内上流式细胞仪检测各组细胞的凋亡率。实验重复3次。
1.2.9试剂盒检测细胞上清液中MDA含量和SOD、LDH活性 收集MPP+处理48 h后的各组SH-SY5Y细胞上清液,分别参照LDH试剂盒、SOD试剂盒和MDA试剂盒说明书步骤检测各组细胞上清液中LDH、SOD活性和MDA含量。实验重复3次。

2 结果
2.1不同浓度MPP+对SH-SY5Y细胞存活及miR-34a和SIRT1表达的影响 不同浓度MPP+处理SH-SY5Y细胞后miR-34a表达升高而SIRT1表达降低,MPP+对SH-SY5Y细胞的损伤随着MPP+作用浓度的增加而增大,表现出细胞存活率较对照组显著降低(P<0.05);同时,与对照组相比,不同浓度的MPP+可引起SH-SY5Y细胞中miR-34a表达升高,而SIRT1 mRNA和蛋白的表达水平降低(P<0.05),且呈浓度依赖性。故后续选用2 000 μmol/L作为MPP+最佳损伤浓度。见图1、表1。

图1 Western blot检测SIRT1蛋白的表达Fig.1 Detection of SIRT1 protein expression by Western blot
表1 MPP+对SH-SY5Y细胞存活率、miR-34a表达和SIRT1表达的影响
Tab.1 Effects of MPP+on SH-SY5Y cell survival rate,expression of miR-34a and SIRT1

GroupsCell survival rate(%)miR-34aSIRT1 mRNASIRT1 proteinControl97.08±7.521.01±0.081.00±0.060.80±0.07500 μmol/L MPP+85.16±5.051)1.46±0.121)0.72±0.041)0.48±0.041)1 000 μmol/L MPP+68.43±3.121)2.02±0.251)0.52±0.031)0.31±0.031)2 000 μmol/L MPP+43.08±3.251)2.75±0.281)0.35±0.021)0.18±0.021)F64.21341.811144.169110.603P0.0000.0000.0000.000
Note:Compared with the control group,1)P<0.05;n=3.
2.2miR-34a靶向调控SIRT1的表达 图2和表2结果显示,与miR-NC组相比,在miR-34a过表达的miR-34a组中SIRT1 mRNA和蛋白的表达水平显著降低(P<0.05);而在miR-34a低表达的anti-miR-34a组中SIRT1 mRNA和蛋白的表达水平较anti-miR-NC组显著升高(P<0.05)。
2.3双荧光素酶报告实验 TargetScan软件预测结果显示miR-34a与SIRT1 3′ UTR 存在互补的结合位点。采用荧光素酶实验检测发现,miR-34a过表达可降低SIRT1-WT质粒转染的SH-SY5Y细胞的荧光素酶活性;而miR-34a低表达则升高SIRT1-WT质粒转染的SH-SY5Y细胞的荧光素酶活性,与相应对照组相比差异均有统计学意义(P<0.05);但miR-34a表达对SIRT1-MUT质粒转染的SH-SY5Y细胞的荧光素酶活性无显著影响。见表3、4。
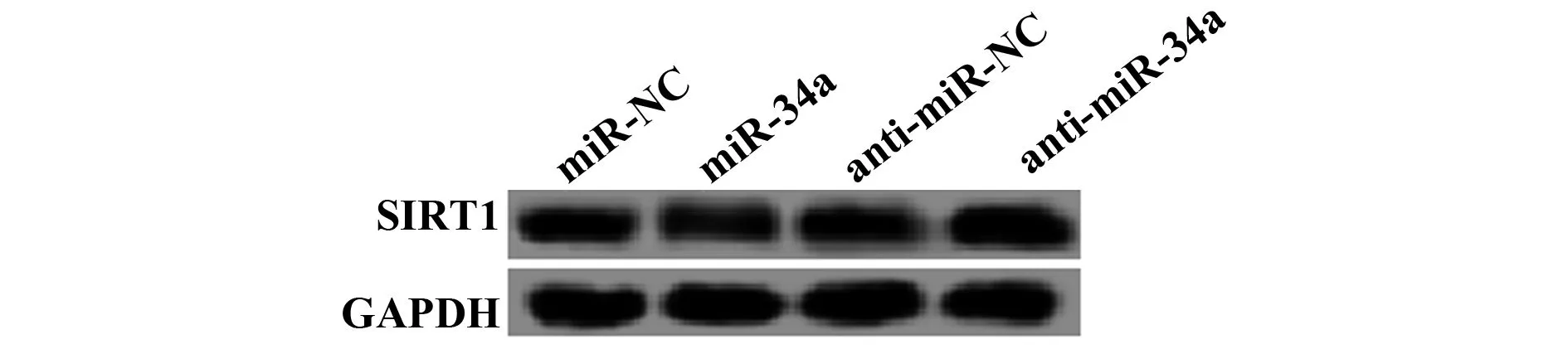
图2 Western blot检测SIRT1蛋白的表达Fig.2 Detection of SIRT1 protein expression by Western blot
表2 miR-34a对SIRT1表达的影响
Tab.2 Effects of miR-34a on SIRT1 expression

GroupsmiR-34aSIRT1 mRNASIRT1 proteinmiR-NC1.00±0.08 0.59±0.040.79±0.06miR-34a3.85±0.131) 0.31±0.031)0.21±0.031)anti-miR-NC0.97±0.060.62±0.050.75±0.08anti-miR-34a0.24±0.022)1.22±0.072)1.18±0.092)F545.070177.818100.395P0.0000.0000.000
Note:Compared with the miR-NC group,1)P<0.05;compared with the anti-miR-NC group,2)P<0.05;n=3.
表3 SIRT13′ UTR与miR-34a的结合位点
Tab.3 Binding sites of SIRT1 3′UTR to miR-34a

GeneComplementary nucleotide sequencesBinding positionSIRT15′...AUCUUCACCACAAAUACUGCCAA...3′755-761 of SIRT1miR-34a3′...UGUUGGUCGAUUCUGUGACGGU...5′3′ UTR
2.4miR-34a低表达通过靶向SIRT1抑制MPP+诱导的SH-SY5Y细胞凋亡 图3和表5结果显示,与对照组相比,2 000 μmol/L MPP+处理后可引起miR-34a 表达和细胞凋亡率升高,而SIRT1 mRNA和蛋白表达降低(P<0.05);与MPP+组相比,转染miR-34a抑制剂的MPP++anti-miR-34a组中miR-34a表达和细胞凋亡率显著降低,而SIRT1 mRNA和蛋白的表达显著升高(P<0.05);而转染miR-34a抑制剂阴性对照的MPP++anti-miR-NC组与MPP+组间无显著差异(P>0.05)。与MPP++anti-miR-34a+siNC组相比,转染SIRT1干扰序列的MPP++anti-miR-34a+siSIRT1组细胞中SIRT1 mRNA和蛋白的表达显著降低,而细胞凋亡率显著升高(P<0.05);另外,转染无意义序列的MPP++anti-miR-34a+siNC组与MPP++anti-miR-34a+siNC组相比无显著差异(P>0.05)。
表4 各组细胞的荧光素酶活性
Tab.4 Luciferase activity of cells in each group

GroupsLuciferase activitySIRT1-WTSIRT1-MUTmiR-NC1.03±0.081.01±0.07miR-34a0.37±0.041)1.03±0.09anti-miR-NC0.99±0.070.96±0.08anti-miR-34a2.46±0.182)0.98±0.07F207.4060.477P0.0000.707
Note:Compared with the miR-NC group,1)P<0.05;compared with the anti-miR-NC group,2)P<0.05;n=3.

图3 miR-34a靶向SIRT1表达对MPP+ 诱导的SH-SY5Y细胞凋亡的影响Fig.3 Effect of SIRT1 expression targeting by miR-34a on MPP+ induced SH-SY5Y cell apoptosisNote: A.Detection of SIRT1 protein expression by Western blot;B.Detection of apoptosis by flow cytometry.
表5 miR-34a靶向SIRT1表达对MPP+诱导的SH-SY5Y细胞凋亡的影响
Tab.5 Effect of SIRT1 expression targeting by miR-34a on MPP+induced SH-SY5Y cell apoptosis
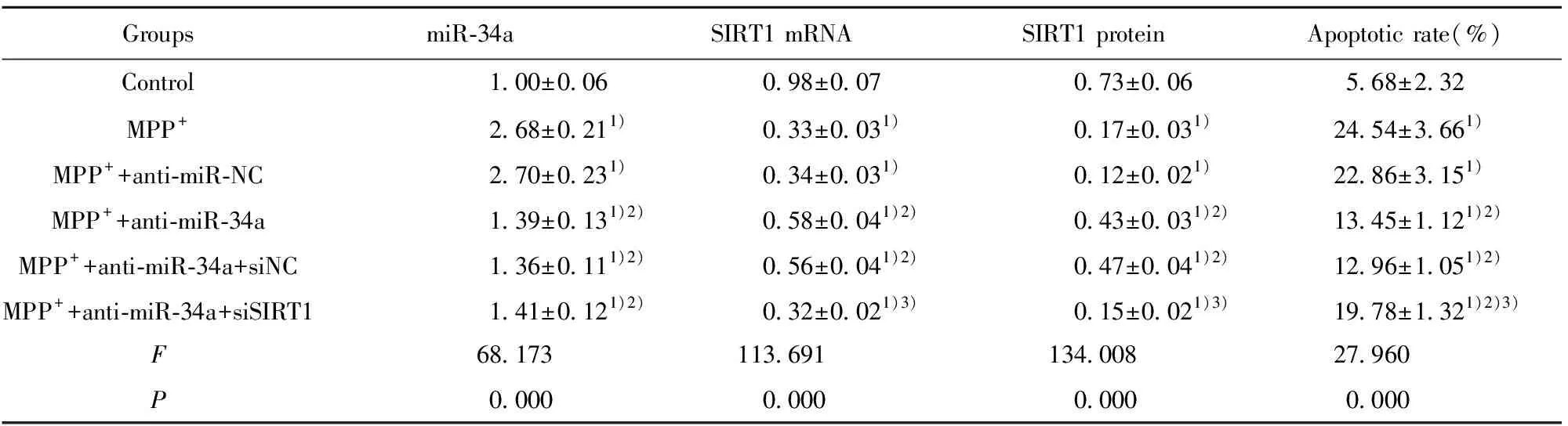
GroupsmiR-34aSIRT1 mRNASIRT1 proteinApoptotic rate(%)Control1.00±0.060.98±0.070.73±0.065.68±2.32MPP+2.68±0.211)0.33±0.031)0.17±0.031)24.54±3.661)MPP++anti-miR-NC2.70±0.231)0.34±0.031)0.12±0.021)22.86±3.151)MPP++anti-miR-34a1.39±0.131)2)0.58±0.041)2)0.43±0.031)2)13.45±1.121)2)MPP++anti-miR-34a+siNC1.36±0.111)2)0.56±0.041)2)0.47±0.041)2)12.96±1.051)2)MPP++anti-miR-34a+siSIRT11.41±0.121)2)0.32±0.021)3)0.15±0.021)3)19.78±1.321)2)3)F68.173113.691134.00827.960P0.0000.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the MPP+group,2)P<0.05;compared with the MPP++anti-miR-34a group,3)P<0.05;n=3.
表6 各组中LDH活性、SOD活性和MDA含量的比较
Tab.6 Comparison of LDH activity,SOD activity and MDA content in each group

GroupsLDH(U/ml)MDA(nmol/ml)SOD(U/mg prot)Control225.76±12.250.39±0.0614.22±0.12MPP+379.48±13.661)1.02±0.091)7.54±0.131)MPP++anti-miR-NC365.55±12.701)0.97±0.081)7.15±0.121)MPP++anti-miR-34a284.12±8.851)2)0.52±0.041)2)12.28±0.251)2)MPP++anti-miR-34a+siNC288.09±10.051)2)0.50±0.031)2)12.32±0.221)2)MPP++anti-miR-34a+siSIRT1329.45±11.321)2)3)0.74±0.051)2)3)10.06±0.181)2)3)F73.80453.735770.338P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the MPP+group,2)P<0.05;compared with the MPP++anti-miR-34a group,3)P<0.05;n=3.
2.5miR-34a低表达通过靶向SIRT1减轻MPP+诱导的SH-SY5Y细胞氧化应激损伤 表6结果显示,与对照组相比,2 000 μmol/L MPP+处理SH-SY5Y细胞后,SH-SY5Y细胞上清液中MDA含量和LDH活性显著升高,而SOD活性显著降低(P<0.05);与MPP+组相比,MPP++anti-miR-34a组中MDA含量和LDH活性显著降低,而SOD活性显著升高(P<0.05);但是,MPP++anti-miR-NC组和MPP+组比较无显著差异(P>0.05)。与MPP++anti-miR-34a组相比,MPP++anti-miR-34a+siSIRT1中MDA含量和LDH活性显著升高,而SOD活性显著降低(P<0.05);然而,MPP++anti-miR-34a+siNC和MPP++anti-miR-34a组比较无显著性差异(P>0.05)。
3 讨论
本研究以500、1 000和2 000 μmol/L的MPP+作用于SH-SY5Y细胞后发现,细胞受到损伤,细胞存活率逐渐降低,同时miR-34a的表达逐渐升高,而SIRT1的表达逐渐降低。这提示miR-34a和SIRT1在MPP+诱导的SH-SY5Y细胞损伤过程中发挥着重要作用。本研究以2 000 μmol/L的MPP+作用后发现,SH-SY5Y细胞凋亡率显著升高,且细胞上清液中氧化应激相关指标抗氧化酶SOD活性降低,而脂质过氧化物MDA含量、活细胞胞浆内酶LDH活性升高。结果表明,MPP+可诱导SH-SY5Y细胞的氧化应激损伤和细胞凋亡,帕金森病细胞模型构建成功。LDH活性大小可较好地反映出细胞膜的损伤程度;MDA含量的高低可间接反映机体遭受自由基攻击的程度;SOD活力的高低可间接反映机体清除自由基的能力大小;三者常被作为反映细胞氧化应激的重要指标[9,10]。另外,本研究采用生物信息学软件预测发现,SIRT 13′UTR存在与miR-34a互补的核苷酸序列,采用荧光素酶实验证实SIRT1是miR-34a的靶基因,同时RT-PCR和Western blot检测发现miR-34a可负向调控SIRT1 mRNA和蛋白的表达。这表明miR-34a可靶向调控SIRT1的表达,该结果与陈蓟等[11]得到的miR-34a与SIRT1存在靶向关系的结果相似。
PD是一种常见的神经退行性疾病,以黑质多巴胺神经元的缺失为主要病理改变,出现运动迟缓、肌肉僵直、姿势反射障碍等其常见的临床表现;目前,关于PD的发病机制尚不明确,但越来越多的研究证实神经元细胞凋亡和氧化应激引起的细胞损伤是PD发病的重要机制[12-14]。因此,寻找有效抑制PD神经细胞凋亡和氧化应激损伤的分子靶点对PD治疗具有重要意义。miR-34a是一种与细胞凋亡和氧化应激反应关系密切的miRNA。Zhong等[15]研究指出,miR-34a的下调可抑制氧化低密度脂蛋白诱导的人脐静脉内皮细胞凋亡和氧化应激。季青山等[16]研究发现,下调miR-34a表达可使氧化应激条件下人晶状体上皮细胞存活率升高,改善过氧化氢诱导氧化损伤。miR-34a是一种在脑组织中广泛表达的miRNA,被证实与阿尔茨海默病、癫痫和PD病等神经性疾病的发生发展关系密切[17-19],且miR-34a低表达在神经细胞损伤过程中发挥着重要保护作用[20,21]。SIRT1是一种在调控细胞周期、能量代谢、抗炎、抗氧化应激和抗凋亡等多种细胞功能中发挥着重要作用的去乙酰化酶,被证实其激活可通过抑制MAPK通路保护MPP+诱导的SH-SY5Y细胞凋亡和氧化应激[22]。
本研究通过转染miR-34a抑制剂成功下调miR-34a的表达后发现,MPP+诱导SH-SY5Y细胞凋亡和氧化应激损伤均明显受到抑制;同时转染SIRT1干扰序列成功下调SIRT1 表达后发现,miR-34a低表达对MPP+诱导SH-SY5Y细胞凋亡和氧化应激的抑制作用明显减弱。这表明miR-34a低表达可通过靶向SIRT1抑制MPP+诱导SH-SY5Y细胞凋亡和氧化应激。该结果与Wang等[23]发现的抑制miR-34a可通过靶向激活SIRT1减轻肠缺血/再灌注诱导的氧化应激和凋亡的分子机制相似。
综上所述,miR-34a表达抑制在MPP+诱导SH-SY5Y细胞凋亡和氧化应激过程中具有保护作用,而miR-34a对SIRT1的靶向激活是该过程的重要机制。这可能是miR-34a低表达发挥PD神经保护作用的新线索,也为miR-34a有望成为PD防治的候选靶基因提供新的参考依据。
