间充质干细胞移植对丙烯酰胺中毒大鼠周围神经病的治疗研究①
2020-04-13杨敏慧刘爱群向光红李金海
杨敏慧 刘爱群 向光红 李金海
(中南大学湘雅医学院附属海口医院神经内科,海口 570208)
周围神经主要是指嗅觉、视觉神经以外的脑神经和脊神经、自主神经及其神经节[1]。而周围神经病变(peripheral neuropathy,PN)主要是指原发于周围神经系统结构或功能损害的疾病,主要表现为运动、感觉和自主神经症状的减弱或者消失[2,3]。丙烯酰胺是一类神经毒性的有机试剂,常用于工业生产和实验研究过程中。持续性接触丙烯酰胺会导致慢性中毒,临床主要表现为周围神经病变[4,5]。间充质干细胞(mesenchymal stem cells,MSC)是一类具有自我复制能力和多向分化潜能的成体干细胞,研究证实间充质干细胞可以发育为成骨细胞、软骨细胞、肌肉细胞、神经元细胞、神经胶质细胞以及内皮细胞等,间充质干细胞具有免疫原性低的特点,容易分离培养和遗传背景稳定等优点[6,7]。本研究分析了间充质干细胞对丙烯酰胺中毒性大鼠周围神经的影响以及作用机理,旨在为丙烯酰胺类试剂引起的周围神经疾病的治疗提供一定的理论依据。
1 材料与方法
1.1材料 65只雌性SD大鼠,SPF级,4月龄,体质量(200.0±10.5)g,购自北京维通利华实验动物有限责任公司,所有大鼠自由摄食饮水,相对温度(26±5)℃,相对湿度(50±10)%,适应性饲养1周后进行试验;丙烯酰胺(美国Sigma公司,批号:18099);α-MEM培养基、胎牛血清和胰酶均购自Thermofisher公司(批号分别为17561、237B1和1834E);鼠抗人FITC-CD45、FITC-CD90、PE-CD105、PE-CD34、PE-CD73、PE-HLA-DR单克隆抗体、FITC-IgG1和PE-IgG1同型对照单克隆抗体均购自美国R&D公司(批号分别为A1231、A172、1717、1721、1745、1862、1854和1834E)。VEGF小鼠单克隆抗体、NGF单克隆抗体和多克隆抗体和GDNF单克隆抗体购自美国Santa Cruz公司(批号分别为C321、3E2W和3907);HRP标记羊抗鼠二抗购自杭州华安生物有限公司(批号:180203);HE染色试剂盒购自武汉博士德生物工程有限公司(批号:1789);超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒均购自南京建成生物工程研究所(批号分别为170801、180021和180322);二氧化碳孵箱购自美国Thermo公司。
1.2方法
1.2.1BMSC细胞的制备 5只SD大鼠断颈处死后,取胫骨和股骨,在无菌条件下将肌肉组织和结缔组织分离,暴露胫骨和股骨。然后将胫骨和股骨中的骨髓细胞采用PBS缓冲液吹出,用红细胞裂解液除去红细胞后将1 500 r/min离心弃上清,沉淀采用低糖的DMEM培养基(10%FBS+1%青链霉素)重悬后,接种于10 cm系细胞培养皿中,在接种后d2更换培养基,洗去未贴壁的细胞,并转移至新的10 cm 细胞培养皿中,继续培养,观察细胞形态,每隔 3 d 更换新鲜培养基,待细胞融合后进行传代,传至第4代时,采用流式细胞术分析间充质干细胞表面标记的表达情况。
1.2.2模型构建分组和治疗 60只SD大鼠随机分为对照组、模型组和BMSC组,每组大鼠20只。模型组和BMSC组大鼠前两周经灌胃给予每只大鼠20 mg/kg的丙烯酰胺,停止给药1周后,再重复灌胃给药一次。以大鼠出现后肢瘫痪视为造模成功。建模成功后,治疗组大鼠经尾静脉注射BMSC 1×107个/只,对照组和模型组注射等体积的生理盐水。所有大鼠饲养在SPF级动物房,并正常饮食。
1.2.3步态分析和评定 治疗后第0、1、2、3、4和5周分别采用步态评分[8]分析3组大鼠的步态。将每只大鼠置于树脂盒中观察5 min并进行评分,1分:大鼠能够站立且行走时步态正常,前后肢活动正常;2分:大鼠站立姿势轻微异常,行走时轻微摇摆、打转,双后肢轻度无力;3分:大鼠能够维持站立,行走时腹部着地,后肢外撇且呈鸭步,双后肢肌力减弱;4分:大鼠无力支撑身体,腹部着地,无法行走。
1.2.4电生理分析 治疗后第5周,全麻大鼠,背位固定,于坐骨神经旁1~2 mm处插入针状刺激电极刺激坐骨神经,于比目鱼肌腹部刺入另一针状电极记录神经肌肉动作电位。采用2.5倍阈电压连续方波刺激坐骨神经近端。用生理记录仪对神经肌肉动作电位进行处理,测定动作电位潜伏期,并计算神经传导速度,扫描速度为4 000 m/s。
1.2.5神经病理检测 治疗后第5周,每组大鼠在接受电生理检测后处死,取患侧胫神经,用4%多聚甲醛固定后,锇酸染色,然后取胫神经踝上端约0.3 cm 的神经进行石蜡包埋,切片。然后采用显微镜观察神经纤维变性程度。
1.2.6Western blot分析 治疗后第5周,取大鼠外周组织50 mg,加入组织裂解液100 μl,碾磨匀浆,在冰上静置裂解1 h,然后15 000 r/min离心15 min,取上清,应用 BCA 蛋白定量试剂盒测定蛋白浓度。加入上样缓冲液,金属浴中煮沸30 min后,进行SDS-PAGE(电压:120 V,电流:300 mA,时间:90 min),结束后将蛋白质转移至PVDF膜上,用5%脱脂奶粉封闭1 h后,采用VEGF(1∶1 000)、NGF(1∶1 000)和GDNF(1∶1 000)单克隆抗体在4℃孵育12 h,次日用PBST洗涤3次,每次5 min,采用HRP标记的羊抗小鼠的二抗在室温孵育2 h,用PBS洗涤3次,每次5 min,在PVDF膜上滴加ECL发光液,在化学发光仪上显色蛋白条带,X胶片进行曝光显影。用Image J图像分析各组胶片扫描所得灰度值与内参(Tubulin)的比值,即得VEGF、NGF和GDNF蛋白相对表达量。
1.2.7氧化应激指标分析 治疗后第5周,取大鼠外周血,离心得血清,分别采用羟胺法、可见分光光度法和比色法检测所有大鼠治疗后SOD、CAT和GSH-px的水平,所有操作严格按照试剂盒操作说明书进行。

2 结果
2.1BMSC的制备 在显微镜下观察显示,细胞在d4开始出现贴壁,d7出现集落分布,d10集落刺激可达到80%,细胞形态呈成纤维细胞样(图1A)。采用流式细胞术分析细胞表面标记物显示,细胞表达CD90和CD105,而不表达造血系标志CD45和白细胞抗原HLA-DR(图1B)。
2.23组大鼠治疗后步态分析 与对照组大鼠比,模型组大鼠建模后1、2、3、4和5周步态显著异常,评分显著增加(P<0.05)。经BMSC治疗,BMSC组大鼠步态显著改善,治疗评分显著下降(P<0.05),见图2。
2.33组大鼠治疗后电生理分析 与对照组比,模型组大鼠神经-肌肉潜伏期明显延长(P<0.05)。与模型组比,BMSC组大鼠神经-肌肉潜伏期明显缩短(P<0.05)。与对照组比,模型组大鼠神经传输速度明显减缓(P<0.05)。与模型组比,BMSC组大鼠神经-肌肉潜伏期明显增加(P<0.05),见表1。
2.43组大鼠治疗后神经纤维变性比较 与对照组比,模型组大鼠神经纤维变性程度(4.28±1.18)显著增加(P<0.05)。与模型组比,BMSC组大鼠神经纤维变性程度(2.35±0.68)显著降低(P<0.05),见图3。

图1 BMSC细胞形态和表面标记物分析Fig.1 Analysis of BMSC cell morphology and surf-ace markers
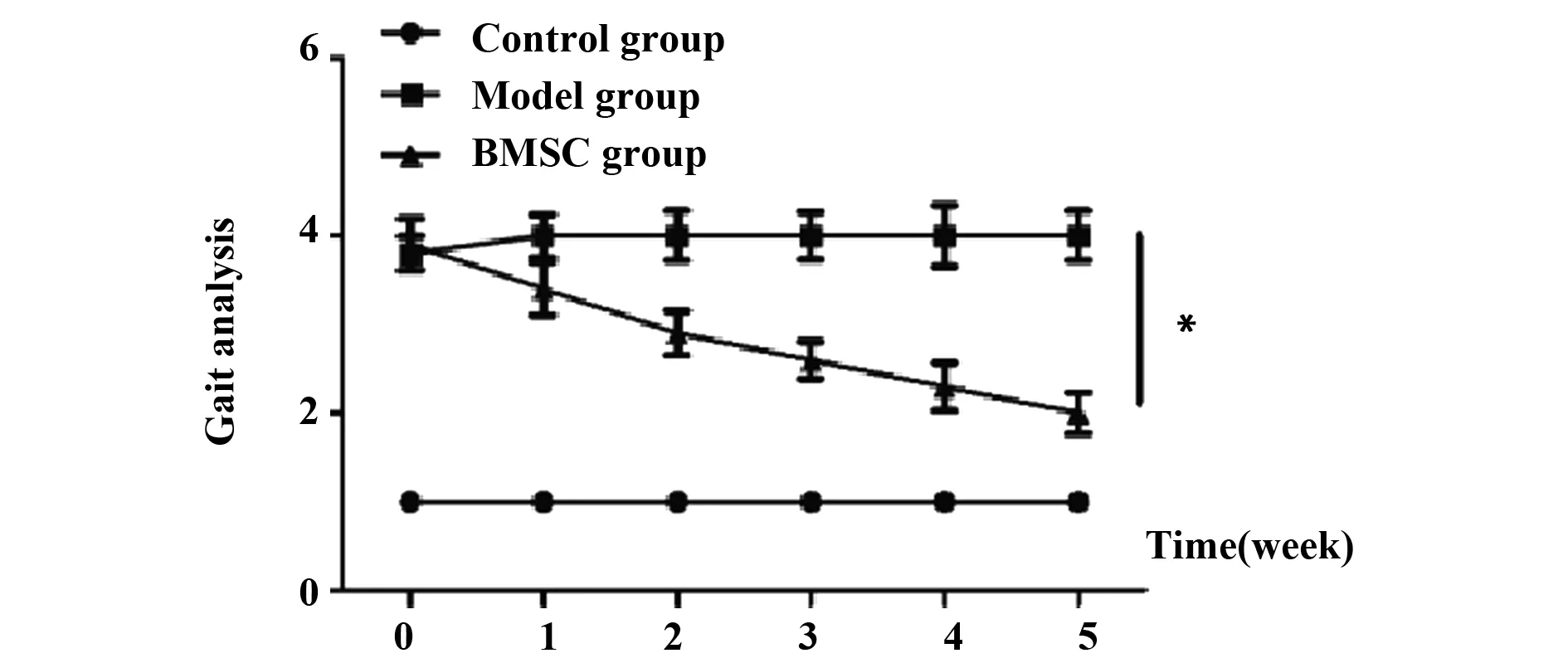
图2 3组大鼠治疗后步态分析Fig.2 Gait analysis of rats in 3 groups after treatmentNote: Compared with the control group,*.P
2.53组大鼠治疗后神经因子水平比较 与对照组比,模型组大鼠神经组织中NGF和GDNF显著降低(P<0.05)。与模型组比,BMSC组大鼠坐骨神经组织NGF和GDNF显著增加(P<0.05)。
2.63组大鼠治疗后氧化应激水平分析 与对照组比,模型组大鼠外周血SOD、CAT和GSH-px水平显著降低(P<0.05)。与模型组比,BMSC组大鼠外周血SOD、CAT和GSH-px水平显著升高(P<0.05),见表2。
表1 3组大鼠神经-肌肉潜伏期和传输速度比较(n=20)
Tab.1 Comparison of neuromuscular latency and transmission velocity in 3 groups (n=20)

GroupsLatency(ms)Transmission speed(μV)Control group0.92±0.1525.71±4.39Model group1.89±0.341)2)5.29±1.321)2)BMSC group1.21±0.2313.49±3.91F77.874174.518P0.0000.000
Note:Compared with the control group,1)P<0.05;compared with the BMSC group,2)P<0.05.
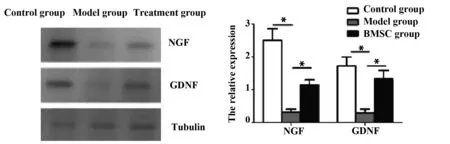
图3 3组大鼠神经组织神经组织中NGF和GDNF表达Fig.3 Expression of NGF and GDNF in nerve tissue of 3 groupsNote: *.P
表2 3组大鼠治疗后氧化应激水平分析(n=20)
Tab.2 Analysis of oxidative stress levels in 3 groups after treatment (n=20)

GroupsSOD(U/ml)CAT(nmol/L)GSH-px[nmol/(min·g)]Control group54.81±1.639.44±1.78145.33±15.39Model group12.01±0.321)2)2.01±0.651)2) 34.91±8.171)2)BMSC group35.12±1.015.79±1.09102.76±19.32F7 285.834 173.291 274.921P0.000 0.000 0.000
Note:Compared with the control group,1)P<0.05;compared with the BMSC group,2)P<0.05.
3 讨论
随着工业化程度的不断推进,因接触一些有毒的化合物如丙烯酰胺、烷类和烯类等导致的外周神经损伤病例越来越多。丙烯酰胺等有毒化合物可损伤外周神经,神经一旦损伤则很难恢复,表现为运动、感觉与自主神经功能减弱或消失,严重者可造成肢体感觉丧失或截肢,影响患者的生活和工作。
骨髓间充质干细胞是一种来源于中胚层的具有多向分化潜能的成体干细胞。目前研究证实,将间充质干细胞移植到脊髓受损的大鼠,可见大量的细胞迁移至神经病变部位,并表达神经元、神经胶质细胞的标记物蛋白,还可促进轴突生长,从而缓解和改善脊髓损伤大鼠的神经功能[9,10]。将间充质干细胞注射纹状体损伤的模型大鼠,间充质干细胞可迁移至纹状体部位并表达和分泌神经生长因子,神经营养因子是一组结构和功能相关的肽类生长因子,广泛调节神经系统神经元的生存和分化,其家族成员如NGF和GDNF被证实可促进神经再生和侧索生芽,增强神经元的存活及生理功能,因此间充质干细胞增强NGF和GDNF表达有助于改善受损的记忆功能[11]。上述实验充分证实间充质干细胞在治疗神经相关疾病中具有潜在的价值。本研究采用间充质干细胞治疗丙烯酰胺中毒所致的外周神经疾病,旨在为有机试剂造成的外周神经疾病治疗提供解决方案。
本研究结果显示,采用丙烯酰胺制备周围神经疾病大鼠,大鼠的步态、外周神经系统以及神经纤维病变显著,提示周围神经病大鼠制备成功。给予周围神经病大鼠BMSC治疗后,可显著改善大鼠的步态,缩短神经肌肉潜伏期和提高患病大鼠神经传导速度,提示BMSC对丙烯酰胺所致的周围神经病具有很好的治疗效果。进一步的研究显示,周围神经病大鼠模型组周围神经组织的神经生长因子NGF和GDNF的水平显著降低,机体的SOD、CAT和GSH-px水平显著降低,提示周围神经病大鼠的神经生长因子活性或功能降低,氧化应激反应明显,组织和机体超氧负离子累积,造成神经元的凋亡和死亡。经BMSC治疗后,神经生长因子NGF和GDNF及机体的SOD、CAT和GSH-px水平均显著增高,提示BMSC改善或缓解周围神经病症状可能与BMSC分泌神经生长因子,进而恢复外周神经功能,提高氧化酶活性,显著减缓神经元的死亡,进而达到保护神经组织的目的,与相关文献报道结果类似[12,13]。但也有学者认为BMSC受到细胞存活及趋化性等方面制约,治疗周围神经病的效果并不显著[14],但该结果是否与BMSC剂量相关仍需要进一步探讨。
综上所述,BMSC可显著提高丙烯酰胺诱导周围神经病大鼠模型的神经组织营养因子和抗氧化应激水平,进而改善周围神经病变。
