吴茱萸次碱对局灶性脑缺血模型大鼠脑组织病理、免疫失衡和氧化应激的调节作用及机制研究①
2020-04-13周海燕周俐红张彩霞韩玉华
周海燕 周俐红 张彩霞 周 立 韩玉华
(新乡市中心医院神经内二科,新乡 453000)
脑中风是一种非常常见的脑血管疾病,是由于颅内脑血管阻塞或破裂引起的急性脑损伤,在中老年群体中具有高发生率、高致死率和高致残率,超过70%的脑中风是由局灶性脑缺血引起的[1,2]。而最终脑梗死面积以及神经功能的结果依赖许多因素,例如局部缺血的持续时间、严重性、侧支血流量、全身血压、梗死病因以及定位,同时也与年龄、性别、并存疾病等背景因素有关[3]。近期研究表明,氧化应激和神经炎症引起的内皮功能紊乱是缺血性脑中风导致脑细胞损伤和死亡的关键因素,通过药物干涉降低局灶性脑缺血的氧化应激和炎症水平能够有效阻止脑缺血造成的细胞损伤[4,5]。吴茱萸次碱(Rutaecarpine,Rut)是我国传统中药吴茱萸的一种主要活性成分,是一种吲哚喹唑啉类生物碱,具有广泛的药理学效应[6]。有研究表明吴茱萸次碱在脑缺血性疾病中具有保护性作用,然而Rut对局灶性脑缺血保护作用的生物学机制尚有很多空缺之处[7,8]。本研究通过建立大鼠局灶性脑缺血模型(CI/R),在Rut对局灶性脑缺血组织损伤、氧化应激以及炎症中发挥作用的机制进行了初步探究。
1 材料与方法
1.1材料
1.1.1主要试剂 Rut,纯度98%,购自南京泽郎科技有限公司;HE染色液、TUNEL细胞凋亡试剂盒、Trizol试剂、RIPA试剂购自上海碧云天生物技术有限公司;反转录试剂盒SsoFast Eva-Green Supermix试剂盒购自美国Bio-Rad公司;白细胞介素6(IL-6)、IL-1β、IL-4、IL-10 ELISA试剂盒、超氧化物歧化酶(SOD)、丙二醛(MDA)、乳酸脱氢酶(LDH)、活性氧(ROS)检测试剂盒购自南京建成生物有限公司;半胱天冬酶3(Caspase-3)、核因子E2相关因子(nuclear factor E2 related factor 2,Nrf2)、血红素氧化酶1(heme oxygenase 1,HO-1)、依赖还原型辅酶Ⅰ/Ⅱ醌氧化还原酶1[NAD(P)H quinone oxidoreductase 1,NQO1]一抗购自美国Santa Cruz公司;二抗购自北京中杉金桥生物技术有限公司;所用引物由上海生工生物工程股份有限公司合成。
1.1.2实验动物 30只清洁级SD大鼠(体质量280~320 g)购自上海斯莱克实验动物有限公司,常温、标准温度和湿度、12 h昼夜交替的封闭环境下喂养1周,期间水和食料正常供给。
1.2方法
1.2.1分组及模型建立方法 大鼠随机分为空对照(Control)组,CI/R组,Rut 5、10、20 mg/kg组,每组6只,Rut 5、10、20 mg/kg组大鼠术前按照对应组别的剂量连续灌胃给药10 d,每天1次。最后1次灌胃治疗24 h后,Control组大鼠仅切开皮肤并分离血管,不做其他处理,其余各组腹腔注射戊巴比妥麻醉,结扎颈外动脉远端,并在颈外动脉切口,将涂抹了少许硅胶的0.25 mm尼龙线插入颈内动脉,深度20 mm,并结扎4 h,缓缓抽出线栓,缝合伤口,建立大鼠CI/R模型。术后24 h参照Bederson评分法对各组大鼠进行神经功能评分,评分标准为:0分,无神经损伤症状;1分,对侧前肢无法完全伸展;2分,前肢抵抗对侧推力能力下降;3分,向对侧转圈。
1.2.2贴纸去除实验 模型建立24 h后,将大鼠置于圆筒中60 s适应新环境,使用黏性贴纸贴在大鼠前肢掌面,记录大鼠撕除前肢纸片的时间。
1.2.3平衡木行走实验 将长度80 cm,宽度2.5 cm 的平衡木放置于高于地面10 cm,让大鼠从平衡木经过,记录大鼠通过平衡木所经过的时间。
1.2.4HE染色检测脑组织病理性改变 神经功能测试结束后,将大鼠断头取脑,摘除嗅球、小脑和低位脑干等部位,4%多聚甲醛固定,清洗后使用70%~100%乙醇梯度脱水,二甲苯透明,石蜡包埋并切成2 μm切片,二甲苯脱蜡,100%~70%乙醇梯度水化,使用HE染色液进行染色后封片,光学显微镜观察脑组织病理性改变。
1.2.5TUNEL染色检测脑组织细胞凋亡 脑组织进行石蜡包埋切片后,二甲苯脱蜡,100%~70%乙醇梯度水化,蛋白酶K去除组织蛋白,清洗后使用2%过氧化氢室温反应,TdT反应液孵育,过氧化物酶标记的抗地高辛抗体反应,0.05%DAB溶液显色,封片后光学显微镜观察细胞凋亡,每张切片选取6个视野,计数凋亡细胞数目在视野总细胞数目中所占的百分比作为凋亡率。
1.2.6RT-PCR检测基因表达 Trizol试剂盒提取脑组织中总RNA,反转录合成cDNA,根据SsoFastTMEva-Green®Supermix试剂盒的操作说明书,进行PCR反应,反应条件为0℃ 2 min,95℃ 15 s,60℃ 1 min,循环次数40次,2-ΔΔCt法处理实验结果。
1.2.7ELISA检测血清细胞因子 血液离心收集血清,向预先包被细胞因子对应抗体的酶标孔中加入样品,再根据试剂盒的操作说明加入试剂盒预先配制的试剂进行反应,检测450 nm吸光度,根据预先制作的标准曲线计算样品细胞因子的浓度。
1.2.8试剂盒检测氧化应激 血液离心收集血清,根据试剂盒的操作说明书依次加入试剂盒中提供的试剂进行反应,并检测与说明对应的吸光度值,其中SOD检测采用的原理是羟胺法,MDA检测采用的原理是TBA法,LDH检测采用的原理是比色法,ROS检测的原理是化学荧光法。
1.2.9Western blot检测蛋白表达 RIPA试剂盒提取脑组织总蛋白,BCA试剂盒进行蛋白定量,根据定量结果,取每孔20 μg的上样量进行点样,10%SDS-PAGE电泳分离总蛋白,转膜至PVDF膜,5%脱脂牛奶封闭,加入适量一抗4℃孵育过夜,TBST清洗后适量二抗室温孵育2 h,ECL显色液显色,凝胶成像仪分析条带的灰度值进行相对定量。

2 结果
2.1Rut减轻大鼠CI/R对神经功能的影响 结果见图1A,与Control组比较,CI/R组、Rut 5、10、20 mg/kg 组大鼠神经功能评分显著升高(P<0.05),差异有统计学意义;与CI/R组比较,Rut 10、20 mg/kg组大鼠神经功能评分显著降低(P<0.05),且呈现量效关系,差异有统计学意义。同时,与Control组比较,CI/R组、Rut 5、10、20 mg/kg组大鼠双侧贴纸去除时间、平衡木过杆时间均显著延长(P<0.05),差异有统计学意义;与CI/R组比较,Rut 10、20 mg/kg组大鼠双侧贴纸去除时间、平衡木过杆时间显著缩短(P<0.05),且呈现量效关系,差异有统计学意义,见图1B、C。
2.2Rut减轻CI/R大鼠脑组织损伤 结果见图2A、B,Control组大鼠大脑皮质结构完整,神经细胞形态正常,结构完整,排列整齐有序,无明显神经变性坏死及炎性细胞浸润等病理改变,CI/R组皮质区域变性,细胞缩小,核固缩,细胞排列紊乱,神经元数目减少,同时相比于Control组出现了明显的细胞凋亡(P<0.05),差异有统计学意义;Rut 5、10、20 mg/kg组相比于Control组尽管也出现了病理性改变,但相比于CI/R组明显减轻,同时细胞凋亡率也明显降低(P<0.05),差异有统计学意义。此外对细胞凋亡标志物Bax、Bcl-2、Caspase-3表达进行检测,见图2C、D,与Control组比较,CI/R组、Rut 5、10 mg/kg组大鼠脑组织中Bax基因表达水平显著升高(P<0.05),Bcl-2基因表达水平显著降低(P<0.05),并且活化型Caspase-3蛋白水平也显著升高(P<0.05),差异有统计学意义;与CI/R组比较,Rut 5、10、20 mg/kg组大鼠脑组织中Bax基因表达水平显著降低(P<0.05),Bcl-2基因表达水平显著升高(P<0.05),活化型Caspase-3蛋白水平也显著降低(P<0.05),且具有量效关系,差异有统计学意义。
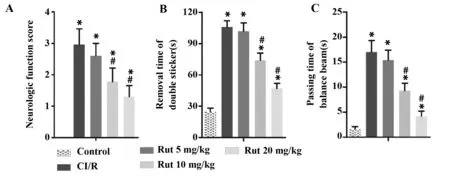
图1 Rut对CI/R大鼠神经功能评分、双侧贴纸去除时间和平衡木过杆时间的影响Fig.1 Effects of Rut on neurologic function score,remo-val time of double sticker and passing time of balance beam of CI/R ratNote:A.Neurologic function score of rat;B.Removal time of double sticker test of rat;C.Passing time of balance beam test of rat,n=6.*.P P
2.3Rut对CI/R大鼠血清细胞因子的调控作用 结果见图3A,与Control组比较,CI/R组、Rut 5、10 mg/kg组大鼠血清促炎细胞因子IL-6、IL-1β浓度显著升高(P<0.05),差异有统计学意义;与CI/R组比较,Rut 5、10、20 mg/kg组大鼠血清IL-6、IL-1β浓度显著降低(P<0.05),且呈量效关系,差异有统计学意义;同时,与Control组比较,CI/R组、Rut 5 mg/kg组大鼠血清抑炎细胞因子IL-4、IL-10浓度显著降低(P<0.05),差异有统计学意义;与CI/R组比较,Rut 5、10、20 mg/kg组大鼠血清IL-4、IL-10浓度显著升高(P<0.05),且呈量效关系,差异有统计学意义,见图3B。
2.4Rut对CI/R大鼠血清氧化应激指标的调控作用 结果见图4A~D所示,与Control组比较,CI/R组、Rut 5、10 mg/kg组大鼠血清SOD浓度显著降低(P<0.05),血清MDA、LDH、ROS浓度显著升高(P<0.05),差异有统计学意义;与CI/R组比较,Rut 5、10、20 mg/kg组大鼠血清SOD浓度显著升高(P<0.05),血清MDA、LDH、ROS浓度显著降低(P<0.05),差异有统计学意义。

图2 Rut对CI/R大鼠脑组织病理性改变及细胞凋亡的影响Fig.2 Effects of apoptotic rate in brain tissue of CI/R ratNote:A.HE staining to detect pathological changes in rat brain tissue and TUNEL staining to detect rat brain tissue cell apoptosis;B.CI/R apoptosis rate of rat brain tissue;C.Bax and Bcl-2 gene expressions in rat brain tissue detected by RT-PCR;D.Caspase-3 protein level in rat brain tissue detected by western blot,n=6.*.P P

图3 Rut对CI/R大鼠血清细胞因子浓度的影响Fig.3 Effect of Rut on concentrations of serum cytokine in CI/R ratNote:A.Concentrations of serum inflammatory cytokine in rat;B:Concentrations of serum anti-inflammatory cytokine in rat,n=6,*.P P

图4 Rut对CI/R大鼠血清氧化应激标志物的影响Fig.4 Effect of Rut on serum oxidative stress marker in CI/R ratNote:A.Concentration of serum SOD in rat;B.Concentration of serum MDA in rat;C.Concentration of serum LDH in rat;D.Concentration of serum ROS in rat,n=6.*.P P
2.5Rut激活CI/R大鼠Nrf2/HO-1/NQO1通路 结果见图5A、B,与Control组比较,CI/R组、Rut 5、10 mg/kg组大鼠脑组织中Nrf2、HO-1、NQO1蛋白水平显著降低(P<0.05),差异有统计学意义;与CI/R组比较,Rut 5、10、20 mg/kg组大鼠脑组织中Nrf2、HO-1、NQO1蛋白水平显著升高(P<0.05),且呈量效关系,差异有统计学意义。

图5 Rut对大鼠Nrf2/HO-1/NQO1通路的调控作用Fig.5 Effect of Rut on concentrations of serum cytokine in CI/R ratNote:A.Concentrations of serum inflammatory cytokine in rat;B.Concentrations of serum anti-inflammatory cytokine in rat,n=6.*.P P
3 讨论
Rut是传统中药吴茱萸的生物活性成分,在诸如心血管、消化系统以及神经系统等方面的疾病中均表现出一定的药理作用[9]。有研究表明抗炎和抗氧化应激作用是Rut发挥其药理作用的重要机制,Li等[10]发现Rut可通过调控内质网应激和核因子κB通路减轻脓毒症诱导的腹膜巨噬细胞凋亡和炎症反应;Wang等[11]发现Rut可通过JNK/p38 MAPK信号通路以及干涉氧化应激反应减轻大鼠肾缺血再灌注损伤。炎症和氧化应激是局灶性脑缺血损伤的关键因素,推测Rut在局灶性脑缺血损伤中发挥的保护性作用与这两个关键因素有关。为了探究其中可能存在的作用机制,本研究通过线栓法复制了大鼠CI/R模型[12],并通过Rut预处理治疗。本研究发现经过Rut灌胃治疗的CI/R大鼠,神经功能方面的指标得到明显好转,同时脑组织病理性改变和细胞凋亡率均显著减轻,并且变化具有量效关系。此外,对细胞凋亡关键因子Bax、Bcl-2、Caspase-3的检测结果显示,Rut显著降低了组织中Bax基因表达水平,提高了Bcl-2基因表达水平,并且活化型Caspase-3蛋白水平显著降低,Bax和Bcl-2是Bcl-2家族中的一对凋亡相关调控因子,其中Bcl-2具有抑制凋亡的作用,Bax具有促进凋亡的作用,而Caspase-3是细胞凋亡关键的执行因子,其表达量改变可反映出细胞凋亡水平[13]。上述结果表明,Rut可减轻局灶性脑缺血造成的组织损伤,减少细胞凋亡,对脑神经功能具有保护性作用。
当局灶性脑缺血发生时,浸润的白细胞以及包括神经元及神经胶质等脑细胞成员会释放出各种炎性介质,包括各种细胞因子,同时产生过量的活性氧自由基,造成组织损伤的发展[14]。通过药物作用降低炎症介质,释放及控制氧化应激是缓解局灶性脑缺血病情的常用手段。Gong等[15]研究发现甘草甜素可通过调控脑缺血再灌注过程中产生的炎症、氧化应激和细胞凋亡,对大鼠脑组织发挥保护性作用。本研究发现经过Rut治疗的CI/R大鼠血清中IL-6和IL-1β浓度显著降低,IL-4和IL-10浓度显著升高,IL-6是体内重要的促炎细胞因子,IL-1β是体内应答感染时产生的细胞因子,广泛参与了脑血栓和粥样动脉硬化等疾病的病理过程[16]。而IL-4是一种具有调控小胶质细胞/巨噬细胞作用的细胞因子,在脑修复过程中起着不可替代的作用,IL-10是一种炎症和免疫抑制因子,在炎症反应中具有保护组织的作用[17,18]。此外,本研究发现经过Rut治疗的CI/R大鼠SOD浓度显著升高,MDA、LDH、ROS浓度均显著下降,SOD是体内清除ROS等成分的主要酶类,当氧化应激发生后,SOD不断消耗,同时ROS大量积累,ROS造成细胞损伤,当脂质过氧化时会生成MDA,可反映出氧化应激的程度,LDH广泛存在于脑细胞中,损伤的细胞会释放出LDH[19]。结合上述结果表明,Rut可降低局灶性脑缺血的炎症和氧化应激,发挥保护性作用。
Nrf2是调控细胞抗氧化应激的最主要的转录因子,Nrf2可进入细胞核与抗氧化反应元件结合,激活Nrf2下游的抗氧化基因表达,HO-1和NQO1是Nrf2下游对抗氧化应激的主要酶类,HO-1催化血红素分解的产物具有抗氧化的功能,NQO1与氢醌相关的耦联反应有关[20]。研究表明Nrf2/HO-1/NQO1通路在脑损伤过程中具有保护性作用,Chen等[21]研究表明Nrf2的激活可诱导抗氧化和解毒性酶表达从而抗氧化应激,对脑组织具有保护作用。有研究表明Rut具有调控Nrf2/HO-1/NQO1通路的作用[22],本研究发现经过Rut治疗的CI/R大鼠,脑组织中Nrf2、HO-1、NQO1的表达均明显恢复,表明Rut对局灶性脑缺血的保护作用与Nrf2/HO-1/NQO1通路激活有关。
综上所述,Rut可减轻局灶性脑缺血引起的炎症和氧化应激,减轻脑组织损伤,减少脑细胞凋亡,对脑功能具有保护性作用,其作用机制与Nrf2/HO-1/NQO1通路激活有关。研究结果为Rut在缺血性脑中风治疗上的应用提供了理论依据。
