分离自血培养肺炎克雷伯菌的毒力基因及患者临床特征分析
2020-04-07
上海交通大学医学院附属新华医院检验科,临床微生物室,上海 200092
肺炎克雷伯菌是引起院内感染常见的条件致病菌,常引起血流、肺及泌尿系统等感染[1]。我国Mohnarin耐药监测数据[2]显示,引起血流感染的革兰阴性病原菌中,肺炎克雷伯菌检出率仅次于大肠埃希菌,位居第二。肺炎克雷伯菌引起的血流感染若得不到及时治疗,易导致感染性休克与弥散性血管内凝血等严重并发症,患者病情凶险,死亡率高。
19世纪80年代中国台湾首次报道引起肝脓肿的高毒力肺炎克雷伯菌(hypervirulentKlebsiella pneumoniae,hvKP),随后日本、韩国、澳大利亚等地区相继出现有关hvKP感染的病例报道[3]。肺炎克雷伯菌的毒力主要与荚膜多糖、脂多糖、铁载体及菌毛等毒力因子密切相关,但各种毒力因子在hvKP的致病机制中发挥的作用仍不明确。不同于经典肺炎克雷伯菌(classicKlebsiella pneumoniae,cKP),hvKP常常具有高黏液表型,又称高黏液性肺炎克雷伯菌(hypermucoviscousKlebsiella pneumoniae,HMKP);而cKP毒力虽较弱,较少引起肝脓肿、眼内炎等转移性感染病灶,但cKP对临床常用抗菌药物的耐药性高,给临床抗感染治疗带来困难。有研究[4]表明,与黏液丝试验相比,检测肺炎克雷伯菌的血清型(如K1型、K2型)及毒力基因(如rmpA、aerobactin基因)更适用于hvKP的筛选。本研究收集上海交通大学医学院附属新华医院2016年10月—2018年3月分离自血培养的肺炎克雷伯菌,检测菌株黏液表型、荚膜血清型及毒力基因,通过多位点序列分型(multilocus sequence typing,MLST)对菌株进行分子流行病学研究,收集并分析患者的临床资料,了解分离自血培养肺炎克雷伯菌的毒力基因携带情况、荚膜血清分型、分子流行病学特点及患者临床特征。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集上海交通大学医学院附属新华医院2016年10月—2018年3月分离自血培养的非重复肺炎克雷伯菌80株,使用VITEK-2 Compact全自动微生物分析系统对菌株进行鉴定。菌株于甘油肉汤中-80 ℃保存。质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853及肺炎克雷伯菌ATCC700603由上海市临床检验中心提供。
1.1.2 主要试剂和仪器 BACTECTM-FX血培养系统及血培养瓶购自美国BD公司,BACT/ALERT 3D全自动血培养仪及血培养瓶、VITEK-2 Compact全自动微生物分析系统、巧克力平板、革兰阴性细菌鉴定卡(GNI)购自法国Bio Mérieux公司,Micro flexTMMALDI-TOF MS全自动微生物分析系统购自德国Bruker Daltonik公司,血平板、麦康凯平板购自上海伊华生物技术有限公司,电热恒温培养箱购自上海一恒科学仪器有限公司,干式恒温器购自海门其林贝尔仪器制造有限公司,台式高速离心机、PCR仪购自德国Eppendorf公司,PCR试剂盒购自大连宝生物工程有限公司,水平电泳仪、紫外凝胶成像仪均购自上海天能科技有限公司。PCR引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 黏液丝试验 将冻存的菌株转种至血平板,35 ℃孵育过夜,用无菌接种环挑取血平板上的单个菌落,重复3次。若黏液丝长度大于或等于5 mm,判为黏液丝试验阳性,即为HMKP;若不能挑起黏液丝或黏液丝长度小于5 mm,判为黏液丝试验阴性。
1.2.2 荚膜血清型及毒力基因检测 使用煮沸法提取细菌DNA模板。通过扩增wzi基因的方法检测荚膜多糖(K抗原)血清型,扩增产物送至上海生工生物工程公司测序,测序结果提交巴斯德研究所网站(https://bigsdb.pasteur.fr/klebsiella/klebsiella.html),获得菌株的wzi分型及荚膜血清分型,引物序列、反应体系及扩增条件参照文献[5]。采用PCR扩增和基因测序方法检测肺炎克雷伯菌常见的毒力基因,包括荚膜多糖相关毒力基因rmpA、rmpA2、magA和wcaG,铁载体相关毒力基因aerobactin、iucA、iroN、entB、iutA、ybtS、ycf和kfu,菌毛编码相关毒力基因mrkA、mrkD、fimA和fimH,毒力质粒pLVPK相关基因pLVPK、silS和terW,脂多糖表达相关基因uge,尿囊素代谢相关基因allS、ureA。引物序列、反应体系及扩增条件参照相关文献(表1)。阳性扩增产物送至上海生工生物工程公司测序,测序结果提交美国国立生物技术信息中心(NCBI)网站进行Blast比对。
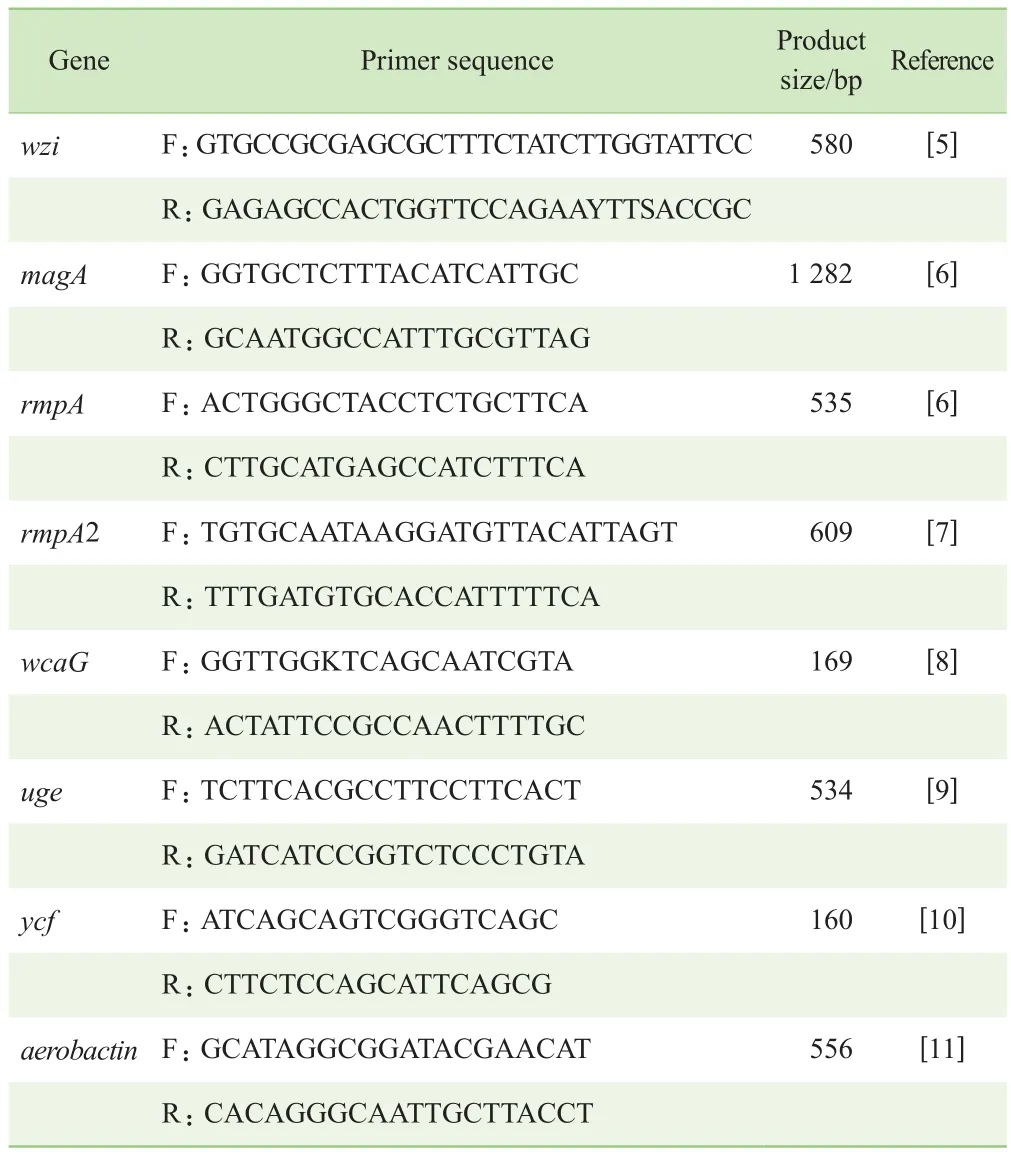
表1 血清型及毒力基因引物序列Tab 1 Primer sequences of serotypes and virulence genes

Continued Tab
1.2.3 hvKP的判定 目前尚无hvKP的统一判断标准。参考相关文献[3],本研究将同时携带rmpA和aerobactin基因的菌株,判为hvKP。
1.2.4 MLST 根据肺炎克雷伯菌官网(http://bigsdb.web.pasteur.fr/klebsiella/klebsiella.html)推荐的7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB),进行 PCR扩增并测序,测序结果提交MLST网站进行比对分析,获得菌株对应的ST型。
1.2.5 临床资料收集 通过临床医师电子病历系统,收集住院患者相关临床资料,包括感染类型、性别、年龄、科室、基础疾病及并发症等。感染类型[16]分为:①社区获得性血流感染,即入院48 h内血培养结果为阳性。②医院获得性血流感染,即入院时不存在血流感染,入院48 h后血培养结果为阳性;或由其他医疗机构转入,入院后48 h内血培养阳性。
1.3 统计学分析
使用SPSS 22.0对数据进行统计分析。定量资料以±s表示,组间比较采用秩和检验;定性资料以频数和百分率表示,采用χ2检验或Fisher精确检验进行组间比较。P<0.05认为差异具有统计学意义。
2 结果
2.1 黏液丝试验
2016年10月—2018年3月共收集80株分离自血培养的肺炎克雷伯菌,黏液丝试验(图1)筛选出9株HMKP,阳性率为11.25%。

图1 高黏液表型的肺炎克雷伯菌(黏液丝试验)Fig 1 HMKP in string test
2.2 荚膜血清型及毒力基因检测结果
分离自血培养的80株肺炎克雷伯菌中,44株检测出荚膜血清分型,以K14.K64型(24株)为主,以下依次为K1型(6株)、K2型(4株)、K16型(3株)、K25型(2株 ),K14、K80、K56、K31和 K15.K17.K50.K51.K52型各1株。荚膜血清分型未确定的肺炎克雷伯菌有36株,以wzi209为主(19株),以下依次为wzi173(5株)和wzi197(2 株 ),wzi73、wzi262、wzi278、wzi331、wzi337、wzi381、wzi535各1株,另有3株菌株未比对出wzi分型。
毒力基因检测结果显示,所有菌株均携带entB、mrkA和ureA基因,ycf、mrkD和fimH基因检出率均为98.75%,uge基因检出率为96.25%,ybtS基因为85.0%,fimA基因为73.75%,pLVPK基因为50.00%,silS基因为38.75%,iutA基因为21.25%,iucA、terW基因均为20.00%,rmpA、rmpA2和iroN基因均为18.75%,kfu、aerobactin、wcaG、magA、allS基因检出率分别为16.25%、12.50%、10.00%、7.50%、5.00%。毒力基因在44株不同血清型肺炎克雷伯菌中的分布见表2。

表2 毒力基因在44株不同血清型肺炎克雷伯菌的分布(n)Tab 2 Distribution of virulence genes in 44 Klebsiella pneumoniae isolates with different serotypes (n)
同时携带rmpA和aerobactin基因的hvKP有10株,包括6株K1型、3株K2型和1株K16型。10株hvKP中有8株为HMKP,以HMKP筛选hvKP的阳性符合率为96.25%。hvKP在HMKP与非HMKP菌株中的检出率分别为88.89%(8/9)和2.82%(2/71),差异具有统计学意义(χ2=46.519,P=0.000)。
cKP血清型以K14.K64型(24株)为主,其次为K16型、K25型 各 2株,K2、K14、K80、K56、K31和K15.K17.K50.K51.K52型各1株,其余36株cKP的荚膜血清分型未确定。
2.3 hvKP与cKP血清型及毒力基因检出情况比较
hvKP与cKP血清型及毒力基因检出情况比较发现,K14.K64型主要检出于cKP,K1型和K2型2种高毒力血清型主要分布于hvKP。magA、allS基因仅分布于K1型hvKP;毒力基因rmpA2、iutA、terW、silS、iucA、iroN、kfu、wcaG和pLVPK在hvKP中检出率明显高于cKP菌株,且差异均具有统计学意义(均P<0.05)。其他毒力基因分布无明显差异(表3)。

表3 hvKP与cKP血清型及毒力基因检出率比较[n(%)]Tab 3 Comparasion of serotypes and virulence gene detection rates between hvKP and cKP [n(%)]
2.4 MLST结果
分离自血培养的80株肺炎克雷伯菌中,76株有MLST分型结果,共检出23种ST型别,包括ST11型43株,ST23、ST14及 ST307型各3株,ST17、ST36、ST147、ST380及ST792型各2株,ST37、ST45、ST111、ST218、ST261、ST323、ST585、ST660、ST661、ST700、ST881、ST950、ST1883及ST2159型各1株。有4株未检出ST分型。
对菌株MLST分型及荚膜血清型分析发现,24株K14.K64型菌株包括23株ST11型和1株ST147型。6株K1型菌株包括3株ST23型、1株ST218型、1株ST2159型、1株ST700型。4株K2型菌株包括2株ST380型、1株ST881型、1株ST14型。
10株hvKP的MLST分型以ST23型(3株)和ST380型(2株)为主,其他为ST660、ST700、ST881、ST218和ST2159型各1株,70株cKP主要为ST11型(43株)。
2.5 hvKP与cKP来源患者的临床特征比较
80例血培养检出肺炎克雷伯菌的患者临床资料显示,hvKP引起的社区获得性血流感染占50.0%,显著高于cKP组(17.1%),差异具有统计学意义(P=0.049)。hvKP组与cKP组患者均以男性为多,年龄分别为(51.00±20.24)岁和(36.96±37.61)岁,2组间性别与年龄分布差异无统计学意义。hvKP组科室分布以急诊重症监护室为主(30.0%),cKP组以儿童重症监护室为主(31.4%),差异具有统计学意义(P=0.001)。hvKP组有40.0%患者患有糖尿病,明显高于cKP组患者(10.0%),差异具有统计学意义(P=0.037)。80例患者中有4例合并肝脓肿患者,均检出于hvKP组(表4)。

表4 hvKP与cKP引起血流感染患者的临床特征比较Tab 4 Comparasion of clinical characteristics between the patients with bloodstream infection caused by hvKP and cKP
3 讨论
具有高黏液表型的肺炎克雷伯菌能更有效地抵抗吞噬细胞及血清补体的溶菌活性,易随血流播散至其他部位,引起多发性脓肿和多器官功能衰竭[3]。本研究黏液丝试验阳性率为11.25%,与其他报道相似[17];以HMKP筛选hvKP的阳性符合率为96.25%,hvKP在HMKP与非HMKP中分布差异具有统计学意义,提示高黏液表型在一定程度上能够反映肺炎克雷伯菌的毒力,可将黏液丝试验作为初步筛选hvKP的指标。
本院分离自血培养的肺炎克雷伯菌的荚膜血清型主要是K14.K64型,荚膜血清分型未确定的菌株以wzi209为主。研究[5]显示,约95.0%的肺炎克雷伯菌可通过检测荚膜基因座保守区wzi基因,得到荚膜血清分型。本研究有3株菌携带wzi基因,但在现有数据库中未获得其对应的荚膜血清分型。目前肺炎克雷伯菌的荚膜血清分型至少有77个[18],K1、K2、K5、K54及K57型是常见的高毒力血清型,以K1和K2型菌株毒力最强,已成为引起肝脓肿的主要病原菌。本研究hvKP血清型以K1型和K2型为主,未检出K5、K54及K57型等高毒力血清型菌株。文献[19]报道,rmpA和magA基因的编码产物能够促进荚膜多糖表达,使菌株呈现高黏液表型,但具有高黏液表型菌株不一定同时携带rmpA和magA基因。本研究中携带rmpA和magA基因的菌株均为高黏液表型菌株,而高黏液表型菌株中携带rmpA和magA基因的菌株占66.67%(6/9),与前述报道相符。
气杆菌素(aerobactin)是肺炎克雷伯菌毒力增强的主要毒力因子,也是最重要的铁载体,能够使肺炎克雷伯菌毒力增强100倍[20]。本研究编码气杆菌素及其受体的iucA、iutA基因,以及编码沙门菌素及其受体的iroN基因在hvKP中的检出率显著高于cKP,推测气杆菌素可能与沙门菌素共同参与肺炎克雷伯菌铁摄取能力的调控,从而增强菌株毒力。
rmpA2基因常与rmpA、iutA、terW和silS基因同时存在于大小为180 000~220 000 bp的毒力质粒pLVPK上。获得该毒力质粒的肺炎克雷伯菌,毒力明显增强[21]。研究[22]发现,前述5种毒力基因不一定同时存在,可能与毒力质粒pLVPK易变区发生同源重组有关,但包含rmpA2、rmpA、iutA、terW和silS基因越多的菌株,存在类似pLVPK毒力质粒的可能性越大。本研究检出rmpA2基因的6株hvKP,均同时检出rmpA、iutA、terW和silS基因及pLVPK,因此推测这6株hvKP的毒力增强,可能与获得毒力质粒pLVPK有关。wcaG基因(编码岩藻糖,保护细菌逃避巨噬细胞的吞噬作用)、allS基因(编码产物参与尿囊素代谢,为细菌生长提供氮源)、kfu基因(编码产物可促进铁离子的吸收)主要检出于K1型hvKP,提示这些毒力基因可能在K1型肺炎克雷伯菌毒力增强过程中发挥了重要作用。
菌毛能够介导肺炎克雷伯菌定植于组织器官表面,与生物膜形成密切相关。研究[23]表明,能够形成生物膜的hvKP,其侵袭能力明显增强。本研究发现编码Ⅰ型和Ⅲ型菌毛的fimA、fimH基因和mrkA、mrkD基因,在cKP与hvKP间分布无明显差异,提示菌毛普遍存在于肺炎克雷伯菌;该结果与既往报道[24]相符。
本研究分离自血培养的肺炎克雷伯菌共检出ST11型、ST14型及ST23型等23种型别。有研究[25]显示,hvKP与ST分型密切相关,ST23型K1菌株是hvKP主要的流行株。本研究K1型菌株以ST23型为主(50.0%),并检出ST218型、ST700型和ST2159型。ST218型与ST23型相比,仅infB基因存在差异,两者有高度的遗传相关性。不同于hvKP的MLST分型结果,ST11型是cKP主要流行株(61.43%),与有关报道[26]相符。本研究有4株菌可能由于tonB基因发生突变,无法获得其MLST分型结果[27]。
hvKP引起的血流感染以社区获得性为主,主要检出于急诊ICU病区,患者住院时间短、预后较好,可能与hvKP对临床常用抗菌药物保持较高的敏感性有关。本研究4例肝脓肿患者血培养均检出具有高黏液表型的hvKP,4株hvKP的血清型是引起肺炎克雷伯菌性肝脓肿常见的K1型(3株)和K2型(1株),因此推测这4例患者的肝脓肿也是由hvKP引起。糖尿病是肺炎克雷伯菌引起肝脓肿的独立危险因素,糖尿病患者合并肝脓肿较非糖尿病患者的风险性增加3.6倍,并且更易发生眼内炎、脑膜炎等转移性感染[28]。本研究hvKP引起的血流感染患者中,糖尿病患者占40.0%,4例并发肝脓肿患者中有3例合并2型糖尿病,可能与糖尿病患者免疫功能下降以及高血糖环境有利于hvKP生长繁殖有关[29]。
此次分离的hvKP比例较低(16.67%),可能与菌株分离自血培养有关。随着侵入性操作的增多,患者医院获得性血流感染发病率升高,并且多由耐碳青霉烯类的cKP引起,而hvKP引起的血流感染易并发肝脓肿等侵袭性感染,因此临床医师应对血培养分离出肺炎克雷伯菌的患者予以重视。
