血浆外泌体来源的miRNA-323a-3p作为结核病潜在生物标志物的评估
2020-04-07李海波周计雪郭晓奎张舒林
林 砺,李海波,夏 凡,周计雪,郭晓奎#,张舒林, #
1. 上海交通大学基础医学院免疫学与微生物学系,上海 200025;2.上海市(复旦大学附属)公共卫生临床中心,上海 201508;3.中国人民解放军第905医院肺科,上海 200235
结核病(tuberculosis)是由结核分枝杆菌复合群(Mycobacterium tuberculosiscomplex,Mtc)感染引起的一类以呼吸系统感染为主的慢性传染性疾病,好发于全身各个部位,如肺、肠和骨等[1]。据世界卫生组织统计, 2018年全球新增约1 000万人感染结核病,死亡人数约120万,其中约25万人死于结核和人类免疫缺陷病毒(human immunodeficiency virus,HIV)的双重感染[2]。MicroRNAs(miRNAs)是一类广泛存在于真核生物中的小的单链非编码RNA,长度为20~22个核苷酸;其经转录及剪切后可直接结合靶基因的mRNA抑制基因的表达,从而参与基因的调控[3-4]。许多研究[5]表明miRNAs在疾病的发生、发展中发挥了重要作用,有望成为预测疾病发生与发展甚至预后的重要生物标志物,因此近年来对该领域的研究获得了极大的关注。外泌体是一类直径为30~150 nm的具有脂质双层膜结构的囊泡[6],各种细胞均可以分泌。由于外泌体复杂的生物形成过程,其内含有多种生物分子,包括四跨膜蛋白(如CD63、CD81、CD82、CD53)、膜蛋白、多囊泡体(multivesicular bodies,MVB)生物发生相关蛋白(如肿瘤易感基因101蛋白)、细胞来源的特定蛋白质标志物、脂质、不同种类RNA(如mRNA、miRNA)以及DNA[7-9]。外泌体携带的丰富的生物分子不仅为其鉴定提供了依据,也有望成为重要的生物标志物,从而为疾病的诊断及进一步研究提供了可能。本研究利用超速离心的方法获取外泌体,基于细胞系转录组测序的结果对差异表达的miRNAs进行临床样本验证,为结核病的临床诊断提供潜在生物标志物,同时也为结核病的机制研究提供参考。
1 对象与方法
1.1 研究对象、主要试剂及仪器
1.1.1 入组对象 10例结核病患者(结核病组)均来自中国人民解放军第905医院肺科,8例志愿者(健康对照组)均为健康体检者。结核病组的纳入标准:①临床诊断为初治结核。②年龄为18~65周岁。③痰涂片或液体培养结果为阳性。④无并发糖尿病、艾滋病等疾病以及自身免疫性疾病。排除标准:①已用药治疗后的初治结核患者。②有传染性疾病或基础性疾病以及肺癌等肺部相关疾病者。
健康对照组的纳入标准:①年龄为18~65周岁。② 体检正常,无肝功能、肾功能异常以及心血管疾病。③ 体检胸片无异常。④无传染性疾病、基础代谢性疾病以及自身免疫性疾病。⑤近3个月无用药史。
本研究已获得临床患者和健康志愿者知情同意并通过了伦理审批。所有入组对象的基本资料见表1。

表1 结核病组和健康对照组的基本资料Tab 1 General information of the tuberculosis group and the healthy control group
1.1.2 菌株与细胞系 卡介苗(Bacille Calmette-Guérin,BCG,即减毒牛分枝结核杆菌)菌株来源于美国组织培养库(American Tissue Culture Collection,ATCC)。人单核细胞白血病细胞(THP-1)购于上海中乔新舟生物科技有限公司。
1.1.3 主要试剂和仪器 胎牛血清(fetal bovine serum,FBS)、RPMI-1640 培养基(ScienCell,美国),β- 巯基乙醇(Amresco,美国),7H9培养基(BD,美国),油酸、白蛋白、右旋糖和过氧化氢酶培养基(oleic acid,albumin,dextrose and catalase medium,OADC)增菌液(Solarbio,美国),佛波醇(phorbol myristate acetate,PMA)(Sigma,美国),TSG-101、CD-9、β- 肌动蛋白(β-actin)单抗(Abcam,美国),羊抗兔二抗和羊抗鼠二抗(上海翊圣生物科技有限公司),BCA蛋白定量试剂盒(Thermo,美国),TRIzol试剂(Invitrogen,美国),氯仿、异丙醇和无水乙醇(上海试一化学试剂有限公司),磷钨酸负染色液(2%)(Solarbio,美国),SuperScriptTMⅢ反转录酶(Invitrogen,美国),qPCR SYBR Green 预混液(上海云序生物科技有限公司)。
1.2 研究方法
1.2.1 临床样本的采集及处理 分别采集结核病组患者和健康对照组志愿者外周血5 mL,向其中加入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝血。于标本采集6 h内进行4 ℃、2 000×g离心15 min获得上清液即为血浆,再用无RNA酶的1.5 mL离心管进行分装,-80 ℃保存待用。
1.2.2 BCG菌株培养 配制7H9液体培养基,加入终浓度为0.2%甘油,于高压灭菌后按1:10加入OADC增菌液。使用前,加入终浓度为0.05%的过滤消毒吐温 -80。将-20 ℃甘油保种的BCG菌株接种到液体培养基中,并置于37 ℃摇床上培养[10]。
1.2.3 THP-1细胞培养及诱导分化 复苏冻存的THP-1细胞。用去除外泌体的FBS、RPMI-1640培养基、β-巯基乙醇(比例为100:900:1)配制培养液,于37 ℃、饱和湿度、5% CO2的培养箱中培养THP-1细胞,每3 d传代1次。调整细胞密度为1×106/mL,于10 cm2的细胞培养皿中进行铺板,每培养皿保证10 mL细胞培养液,并用200 nmol/L 的 PMA处理细胞24 h,使THP-1分化成贴壁的巨噬细胞(mTHP-1)[10-12]。
1.2.4 BCG菌株感染mTHP-1细胞 诱导结束后,用BCG菌株感染mTHP-1细胞(感染复数为1:10)记为感染组,对不做处理的未感染mTHP-1细胞记为对照组。感染4 h后用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗出未进入细胞的细菌,加入完全培养基继续培养,对照组做同样处理,72 h后收集细胞培养上清液[12]。
1.2.5 外泌体获取 按照Théry等[13]的方法对细胞培养上清液中和血浆中的外泌体进行获取。于4 ℃ 2 000×g下超速离心10 min弃去残留细胞、碎片,取上清液于4 ℃12 000×g下离心30 min进一步弃去沉淀中的碎片,再次取上清液于4 ℃ 110 000×g下离心120 min保留含外泌体的沉淀;用无菌PBS重悬后于0.22 μm的滤器除去较大囊泡体,于4 ℃ 110 000×g下离心70 min,保留含外泌体的沉淀;再用无菌PBS重悬后于-80 ℃保存。
1.2.6 外泌体形态鉴定 先将获取的外泌体溶液滴加到碳覆膜铜网中心,待样品吸附后用滤纸吸去多余液体并置于红外灯下烘干。用2%多聚甲醛固定外泌体,用2%磷钨酸负染,于透射电子显微镜(transmission electron microscope,TEM)(80kV)下观察并拍照[13]。
1.2.7 外泌体标志蛋白检测 用新鲜配制的含有苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的 RIPA裂解液对外泌体进行裂解,获取总蛋白。再用BCA蛋白定量试剂盒检测蛋白浓度(按照说明书操作)后,进行蛋白质印迹法(Western blotting)检测。于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行蛋白分离,转至甲醛活化的聚偏二氟乙烯膜上,于4 ℃下用脱脂奶粉封闭1 h,加入一抗(CD9、TSG101,工作浓度分别为1:1 000、1:500),室温下孵育2 h,TBST洗脱3次后加入二抗,室温下孵育1 h,再用TBST洗脱3次,显影并拍照[13]。
1.2.8 总RNA提取 将-80 ℃保存的外泌体溶液冰上溶解,加入TRIzol试剂1 mL,室温静置5 min充分裂解细胞;加入200 μL氯仿,震荡混匀15 s,室温放置5 min,分离蛋白和RNA;于4 ℃下12 000×g离心15 min,小心分离含RNA的无色相;加入0.5 mL异丙醇沉淀RNA,室温静置10 min;于4℃下12 000×g离心10 min弃去上清,用75%乙醇清洗RNA沉淀;于4 ℃下7 500×g离心5 min弃去液体,室温干燥5~10 min;RNase-free水溶解RNA,测定RNA浓度和纯度,-80 ℃保存备用。
1.2.9 miRNA的测序分析 将-80 ℃保存的来源于细胞培养上清外泌体的总RNA送至上海云序生物科技有限公司进行miRNA的测序分析。
1.2.10 临床样本miRNA检测 选择测序结果中几个差异表达的miRNA进行临床样本验证。将-80 ℃保存的临床样本RNA通过特异性引物反转成cDNA,反转录体系为20 μL,引物序列见表2。利用SYBR Green的方法进行实时荧光定量PCR(quantitative real-time PCR,qPCR)。PCR 反应步骤:95 ℃ 10 min;95 ℃ 10 s,60 ℃60 s,40个循环。引物序列见表3。目的miRNA的表达量用U6进行标准化,相对表达水平用2-△△CT的方法进行计算。

表2 反转录引物序列Tab 2 Primer sequences for reverse transcription
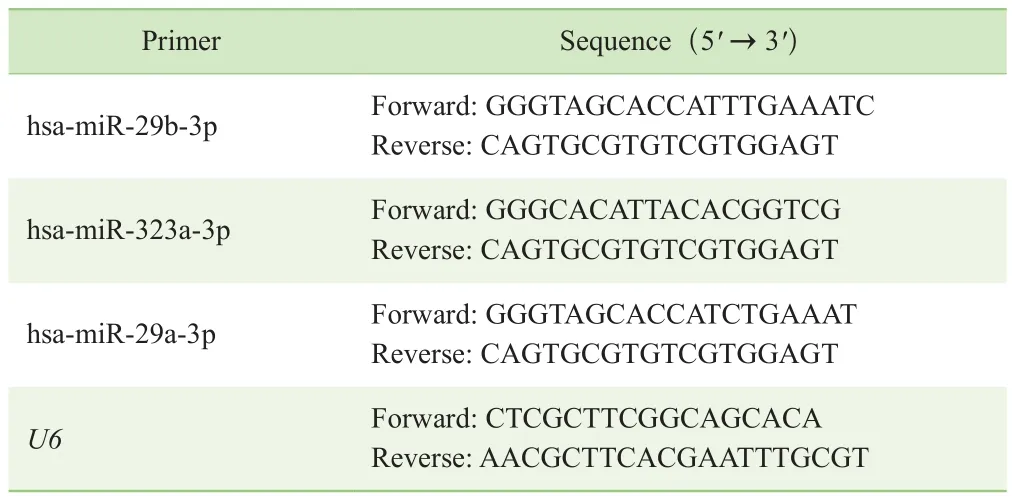
表3 qPCR引物序列Tab 3 Primer sequences for qPCR
1.2.11 miRNA-323a-3p的靶基因预测 利用TargetScan、miRDB和PicTar数据库对miRNA-323a-3p进行靶基因预测,并绘制Venn图。
1.3 统计学方法
采用GraphPad Prism 5软件对qPCR检测结果进行统计学分析。定量数据以±s表示。采用非配对t检验对结核病组与健康对照组进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 THP-1细胞的培养、诱导和感染的形态变化
机体抗结核感染是以T细胞为介导、以巨噬细胞为效应细胞的免疫过程,结核分枝杆菌感染巨噬细胞是最常见的体外研究结核感染的实验模型。小鼠来源的巨噬细胞系RAw264.7因具有易传代培养且生物学行为稳定等优势,常被用作该模型的细胞来源;但由于物种的差异,来自RAw264.7的实验结论并不能真实反映人源巨噬细胞的情况。人急性单核细胞白血病细胞系THP-1可以经体外PMA诱导分化成巨噬细胞,更能准确反映真实结核菌感染人体的情况,故而THP-1成为了用于体外研究炎症相关巨噬细胞功能的经典细胞模型[14-15]。本研究通过光学显微镜对不同阶段的THP-1细胞进行形态学观察,THP-1细胞呈圆形、均匀、透亮悬浮状态(图1A);经PMA诱导成贴壁巨噬细胞后发现,该细胞形态发生了改变,亦出现伪足(图1B);经BCG感染后,细胞因为吞噬细菌而聚集,且具有典型的巨噬细胞形态变化特点(图1C)。
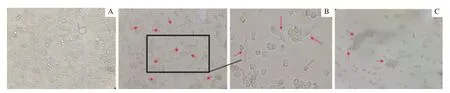
图1 不同因素诱导的THP-1细胞形态(×40)Fig 1 Morphology of THP-1 cell induced by different factors (×40)
2.2 细胞培养上清液及血浆来源的外泌体的形态鉴定
采用TEM对超速离心后的细胞培养上清液以及血浆来源的外泌体(30~150 nm)进行鉴定,结果显示镜下可见大小约100 nm、有明显的膜结构以及圆盘形状的囊泡,且均具有典型的外泌体结构(图2)。

图2 外泌体的TEM观察Fig 2 TEM image of exosomes
2.3 细胞培养上清液及血浆来源的外泌体的表面标志物表达
外泌体内含有多种特异性蛋白,如CD81、CD63、CD9、TSG101等。本研究采用Western blotting对外泌体特异性蛋白CD9及TSG101进行验证,以β-actin作为内参。通过对超速离心法获取的沉淀进行检测发现,外泌体特征性蛋白高表达,同时也进一步说明所提取样本为外泌体(图3)。

图3 Western blotting检测外泌体特异性标志蛋白CD9和TSG101的表达Fig 3 Expression of exosome-specific markers CD9 and TSG101 by Western blotting
2.4 细胞培养上清液外泌体转录组测序分析
对细胞培养上清液外泌体的转录组数据进行标准化处理后,根据reads≥10、fold change值≥2或≤0.5对标准化后的数据做进一步处理,并对BCG组与对照组外泌体来源的miRNA转录组的测序结果进行分析,具体差异表达的miRNA见图4。
2.5 临床血浆样本的qPCR验证
基于上述2.4处理获得的差异表达谱数据以及相关文献报道[16-17],结合测序结果中的reads读数大小,最终挑选出3个差异表达的miRNA即miRNA-29a-3p、miRNA-29b-3p和miR-323a-3p进行qPCR临床验证。结果见图5。与健康对照组相比,仅miR-323a-3p在结核病组的表达出现下调(P=0.004),与测序结果一致(图4);miRNA-29a-3p(P=0.505)和 miRNA-29b-3p(P=0.644)的改变均无显著的统计学差异。

图5 结核病组患者与健康对照组志愿者的血浆样本qPCR验证结果Fig 5 qPCR verification results of plasma samples in the two groups
2.6 miRNA-323a-3p的下游靶基因预测
基于miRNA-323a-3p在细胞培养上清液外泌体转录组测序结果和临床血浆样本qPCR验证结果中出现一致性,故对其进行下游靶基因分析。利用TargetScan、miRDB和PicTar数据库对miRNA-323a-3p进行靶基因预测并绘制Venn图(图6),结果显示共有8个共同靶基因,即为丝氨酸/苏氨酸激酶类 UNC-51-激酶2(unc-51 like autophagy activating kinase 2,ULK2)、SMG P21 刺激GDP/GTP 交换蛋白(Rap1 GTPase-GDP dissociation stimulator 1,RAP1GDS1)、Nik相关激酶(Nik related kinase,NRK)、小泛素相关修饰蛋白1(small ubiquitin like modifier 1,SUMO1)、POU结构域转录因子家族2(POU class 4 homeobox 2,POU4F2)、蛋白基质细胞周期蛋白依赖性激酶抑制剂1B(cyclin dependent kinase inhibitor 1B,CDKN1B)、GTP酶激活蛋白SH3功能结合蛋白2(G3BP stress granule assembly factor 2,G3BP2)和细胞质多腺苷酸化元件结合蛋白4(cytoplasmic polyadenylation element binding protein 4,CPEB4);其中,ULK2属于ULK家族,而ULK家族在自噬途径中扮演着重要作用,同时自噬作用是结核感染中的一个重要表现,因此结核感染相关的外泌体中的miRNA-323a-3p的低表达可能通过调控自噬相关分子ULK2参与感染后的自噬通路。

图6 miRNA-323a-3p靶基因预测Venn图Fig 6 Venn diagram of miRNA-323a-3p target gene prediction
3 讨论
Mtc是一种典型的胞内感染菌且可以逃避溶酶体的降解而造成持续感染,Mtc主要通过进入巨噬细胞发挥作用。THP-1是一种常用的作为结核菌感染体外细胞的模型,可利用一系列毒力因子调节几种宿主因子的表达,使细菌在细胞内存活,并导致抗炎反应,抑制下游促炎信号级联反应[18-19]。自噬是一种溶酶体依赖性降解过程,是巨噬细胞对抗细胞内细菌感染的关键天生宿主防御机制,尤其是Mtc[20-21]。因此,关于结核菌感染以及巨噬细胞自噬作用成为了研究结核发病机制的重要方向。
越来越多的证据表明外泌体包含了多种具有代表性的生物分子,可在细胞间通讯发挥重要作用,其临床应用亦得到了极大的发展[6,22-23]。基于不同囊泡体密度差异、表面电荷差异以及大小和分子量的不同,外泌体的提取有多种方法,包括超速离心法、蔗糖密度梯度离心法、共沉淀法以及凝胶排阻层析法等,但每种方法都有其优势和不足[5]。目前,超速离心法和蔗糖密度梯度离心法能获得较高纯度的外泌体,已成为外泌体提取的金标准,但上述2种方法均存在产量较低的问题[5]。
现阶段,关于外泌体与疾病的研究多集中在肿瘤的发生与发展方面。Allenson等[24]研究发现,早期胰腺癌外泌体来源的DNA中的鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)的高突变率与高发病率相关。关于外泌体在肺癌、前列腺癌等癌症中的作用也均有研究[25-26]。一些关于外泌体与结核病的研究表明,外泌体在结核菌感染的过程中扮演着重要作用。Smith等[27]通过小鼠实验表明,外泌体在结核菌感染期间能够促进T细胞的免疫作用,且是细胞外抗原的重要来源。Diaz等[28]研究表明,结核菌的感染会使巨噬细胞释放的外泌体的膜蛋白发生改变。Bhatnagar等[29]利用结核菌感染巨噬细胞并获取其释放的外泌体进行体内和体外研究发现,来源于结核菌感染的巨噬细胞的外泌体在体内及体外都可以引起炎症反应。因此越来越多的研究表明,外泌体在结核感染过程中发挥了重要作用,为结核的发生、发展及机制研究提供了新的方向。
之前有关miRNA与结核的研究已有部分报道[30],且当前的相关研究多集中在血浆、血清、全血、巨噬细胞或外周血单个核细胞(peripheral blood mononuclear cell,PBMCs)中,其中大部分的研究主要关注游离的miRNA,如 Let-7家 族、miR-146b、miR-29家 族、miR-27a以 及miR-155等都在结核相关的研究中被报道过[30-33],而这些miRNA在我们的研究中也被发现。随着对外泌体研究的不断深入,一些研究开始关注外泌体来源的miRNA与结核之间的联系。外泌体中发现了不同的RNA分子,包括mRNA、核糖体RNA(rRNA)、miRNA和长链非编码RNA(Long non-coding RNA,lncRNA)[34];由于受到外泌体膜结构的保护,降低了RNA酶对RNA的降解作用,使其中的RNA尤其是miRNA的存在更加稳定,为miRNA作为结核潜在标志物的研究提供了良好条件[35]。Singh等[36]通过对结核分枝杆菌感染后的巨噬细胞分泌的外泌体的表征及小鼠的mRNA和miRNA的表达水平分析发现,与未感染的巨噬细胞相比,感染后的巨噬细胞分泌的外泌体中miRNA丰度较低,且出现了100多种转录物在感染组中富集或仅存在于感染组中,其中包括与免疫应答密切相关的转录物。Zhang等[37]通过结核分枝杆菌感染RAW 264.7巨噬细胞并提取外泌体来源的总RNA发现,miR-20b-5p水平的上调抑制了RAW 264.7巨噬细胞中结核分枝杆菌的存活,而miR-20b-5p水平的下调增强了结核分枝杆菌在RAW 264.7巨噬细胞中的存活。
另外有一些研究表明,在不同疾病类型下或同一疾病的不同阶段下,外泌体来源的miRNA也存在显著差异,其将有利于对疾病的诊断与鉴别诊断。Wang等[38]对来自肺腺癌、结核病和其他良性病变的3组患者的胸腔积液中外泌体进行检测,最终发现miR-148a-3p、miR-451a和miR-150-5p在结核病胸腔积液来源的外泌体中与其他良性病变的外泌体中存在差异表达。Mortaz等[39]通过从人体血液中分离单个核细胞,再将其诱导成巨噬细胞,利用BCG感染巨噬细胞,收集细胞分泌的外泌体中的RNA与未感染组比较,BCG感染后巨噬细胞来源的外泌体中以Let-7家族成员、miR-155、miR-146a、miR-145和 miR-21为主,并且与一些免疫相关途径有关。值得注意的是,Let-7家 族、miR-155、miR-146a、miR-150-5p和 miR-21也出现在我们的差异表达的miRNA中。
miRNA-29家族在结核的研究中多次被报道。hsamiR-29a-3p在活动性结核患者中显著上调[40]。Kleinsteuber等[16]的工作显示,来自结核病儿童患者的CD4+T细胞中miR-29a和miR-142-3p表达较低,且与健康的潜伏结核感染儿童相比,全血miRNA候选分析证实结核病儿童中miR-26a、miR-29a和miR-142-3p的表达均较低。Pan等[17]通过招募112名患有结核性脑膜炎的儿童和130名健康儿童,采用qPCR检测miR-29a在PBMC和脑脊液中的表达;结果显示结核性脑膜炎组miR-29a的表达显著上调。Ma等[41]通过BCG感染小鼠后发现miR-29的下调,从而改变IFN-γ的产生,最终影响免疫应答。Yi等[42]利用细胞缺陷型的结核分枝杆菌感染RAW264.7细胞后与野生型结核分枝杆菌组相比较发现miR-29b的表达有明显的下调,从而导致IFN-γmRNA的表达显著升高。对比我们的研究结果,miRNA-29a-3p和miRNA-29b-3p在临床样本的验证中均未显示出显著差异,miRNA-29b-3p出现了与Kleinsteuber等[16]一致性改变的趋势,可能和我们的有限样本量存在较大关系;同时我们研究的是外泌体中miRNA,与游离的miRNA表达可能存在差异;另外,通过超速离心方法获取外泌体并提取总RNA与试剂盒直接提取血浆、血清或细胞来源的总RNA间也存在很大的差异。
将细胞培养上清液外泌体测序结果与临床样本验证结果相结合发现,miRNA-323a-3p在BCG组或结核病组出现了一致性改变即表达均显著下调;然而在目前,关于miRNA-323a-3p在结核病的研究尚未被报道。有关miRNA-323a的研究报道多集中于多囊卵巢综合征、细胞增殖迁移、心血管疾病及异位妊娠等方面[43-46]。Kärner等[47]研究表明,miR-323a-3p通过参与T细胞产生IL-22的过程进一步参与负反馈调节机制,而这一过程可能影响哮喘中的T细胞应答。而关于IL-22与结核的研究也多有报道[48-49],这些证据也为miRNA-323a在结核病中的研究提供了间接证据。
通过靶基因预测工具预测ULK2为miRNA-323a-3p的潜在靶基因,而ULK是自噬信号通路唯一具有丝氨酸/苏氨酸激酶活性的核心蛋白。在自噬溶酶体组装前,自噬信号是通过由ULK1或ULK2、骨架蛋白FIP200和自噬相关基因(autophagy related gene,ATG)产物mATG13组成的ULK复合物的活化介导的。而结核分枝杆菌感染与自噬过程密切相关,一些miRNA和细胞因子在其中发挥了重要作用[50-51]。
综上所述,这些直接或间接证据为我们进一步研究miRNA-323a-3p通过调控ULK2影响自噬并最终在结核分枝杆菌的感染中发挥作用提供了依据。本研究通过超速离心获取外泌体在很大程度上去除了较大细胞内囊泡体的感染,可以更加真实地反映外泌体内miRNA富集的情况,然而仍然存在一些不足。后续我们将扩大临床样本进行验证,为该实验结果提供更加有力的支撑;同时,为了更好地服务于临床诊断,我们还将继续关注miRNA-323a-3p在血浆游离miRNA中的表达情况。
