白念珠菌ERG3基因敲除及其对耐药性的影响
2020-04-07王钰婷刘锦燕赵珺涛项明洁
王钰婷 ,刘锦燕,史 册,赵珺涛 ,项明洁
1. 上海交通大学医学院附属瑞金医院检验科,上海 200025;2. 上海交通大学医学院附属瑞金医院卢湾分院放免检验科,上海 200020
白念珠菌是临床上最常见的条件致病性真菌,可存在于人体的皮肤、口腔、胃肠道、阴道等部位。一般情况下,该菌在正常机体中数量较少,不会引起疾病。当人体免疫力低下时,其可转换成致病菌引起表浅感染,严重时则可引发危及患者生命的念珠菌血症[1-2]。近年来,广谱抗生素的滥用以及免疫功能缺陷患者的不断增多致使临床念珠菌的感染率和死亡率呈上升趋势,其中以白念珠菌感染最常见[3-4]。
临床上用于治疗白念珠菌的常用药物有多烯类、唑类、嘧啶类和棘白菌素类等,其中三唑类药物[如氟康唑(fluconazole,FCZ)、伏立康唑(voriconazole,VRC)、伊曲康唑(itraconazole,ITR)]因其抗菌谱广、疗效显著、生物利用度高和毒副作用低等优点,常作为临床治疗中的一线用药。唑类药物的抑菌机制是其可作用于白念珠菌细胞膜麦角固醇合成中的关键酶,使白念珠菌细胞膜甾醇合成通路受阻、细胞膜完整性破坏及菌体内有毒的甲基化固醇类物质累积而达到抗真菌作用[5]。然而,在临床频繁的预防经验用药中,耐药性的产生给该类药物的应用带来很大困难[5-6]。
甾醇合成通路改变主要是由△5,6- 去饱和酶的失活引起,该酶由ERG3(Ergosterol 3)基因编码[7]。唑类药物通过抑制14α- 去甲基化酶(14α-demethylase,14-DM)发挥抑菌作用,当ERG3发生突变或缺失后就不能编码有活性的△5,6- 去饱和酶,致使中间积聚的产物变成14α- 甲基法尼醇,它可以代替部分麦角固醇的功能,使细胞继续生长继而导致耐药产生。
本研究在Noble等[8]提出的构建白念珠菌基因敲除株策略基础上稍作改进,高效获得白念珠菌ERG3基因敲除株,并就ERG3敲除对白念珠菌唑类药物耐药性及其常见耐药基因的表达进行分析,以期为深入研究白念珠菌的耐药机制奠定基础。
1 对象与方法
1.1 研究对象、引物及试剂
1.1.1 菌株和质粒 药敏标准白念珠菌ATCC90028由本实验室保存,DH5α大肠埃希菌化学感受态细胞购自南京诺唯赞生物科技有限公司。实验中涉及的其他白念珠菌菌株和质粒信息见表1。其中,质粒pSN40含有亮氨酸(leucine 2,LEU2)筛选标记,质粒pSN52含有组氨酸(histidine 1,HIS1)筛选标记。

表1 白念珠菌菌株和质粒Tab 1 Candida albicans strains and plasmids
1.1.2 引物 引物由生工生物工程(上海)有限公司合成,引物序列及合成片段见表2~4。

表2 敲除引物序列Tab 2 Primer sequences for knockout

表3 鉴定敲除组件的引物序列Tab 3 Primer sequences for identification of knockout components

表4 耐药基因的引物序列Tab 4 Primer sequences for drug resistance
1.1.3 试 剂 Ex Taq酶、DL2000 DNA Marker、DL5000 DNA Marker、酵母总RNA提取试剂盒(Yeast RNAiso Kit)、RNA反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)、实时荧光定量检测试剂盒(SYBR Premix Ex Taq Enzyme)等购自日本TaKaRa公司,药物(FCZ、VRC、ITR)及配置YPD培养基和LB培养基所需蛋白胨、酵母浸液、葡萄糖等购自美国Sigma-Aldrich公司,酵母营养缺陷筛选培养基SD-HIS、SD-LEU和醋酸锂转化试剂盒购自北京泛基诺科技有限公司,配置药敏板的RPMI 1640培养基和3-吗啉丙磺酸(3-Morpholinopropanesulfonic acid,MOPS)粉末购自美国Gibco公司,柱式质粒DNA小量抽提试剂盒购自生工生物工程(上海)有限公司,PCR产物胶回收试剂盒购自美国Axygen公司,无水乙醇、氯仿、异丙醇、酚/氯仿/异戊醇(24:24:1)等购自上海试剂一厂。
1.2 实验方法
1.2.1 白念珠菌基因组抽提 参照李文静等[9]和王影等[10]报道的方法对白念珠菌基因组进行抽提。挑取白念珠菌SN152的单克隆于3 mL YPD培养液,于30 ℃ 180×g振荡培养16 h,13 000×g离心2 min收集菌体。加入酵母裂解液(10%十二烷基硫酸钠、0.5 mmol/L pH 8.0 乙二胺四乙酸蛋白酶K)后,水浴65 ℃ 2 h。加入0.5 mL酚/氯仿/异戊醇(24:24:1)混匀,于13 000×g4 ℃离心5 min。吸取上清液转至新的离心管,加入等体积氯仿,混匀后离心。转移上清液至新的离心管,加入0.6倍体积异丙醇,充分混匀后离心。弃去上清液,沉淀用0.5 mL 75% 乙醇洗涤并离心。弃上清,室温下充分干燥,加入50 μL灭菌去离子水溶解。DNA采用超微量分光光度仪(Thermo Nanodrop 2000)进行定量后,-20 ℃保存备用。
1.2.2 质粒转化与抽提 参照李文静等[9]和王影等[10]报道的方法进行质粒的转化与抽提。采用氯化钙法将质粒pSN40和pSN52转化至感受态大肠埃希菌DH5α内,将菌液密涂于含氨苄青霉素的LB培养基上于37 ℃过夜孵育。挑取该平板上的单克隆接种于含氨苄青霉素的LB培养液中,37 ℃ 180×g过夜培养,参照柱式质粒DNA小量抽提试剂盒说明书抽提质粒。
1.2.3 构建同源敲除组件 以SN152 菌株DNA为模板,P1/P1'和P3/P3'为引物扩增ERG3基因编码区上游片段UP-1/UP-2,P4/P4'和P6/P6'扩增下游片段DOWN-1/DOWN-2。以pSN40和pSN52质粒为模板,P2和P5为引物扩增筛选标记LEU和HIS片段(图1A)。PCR 反应条件为:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min(30 个循环);72 ℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳分离,并根据PCR产物胶回收试剂盒说明书进行纯化回收。
以纯化后的上述PCR产物[上游片段UP-1/UP-2(50 ng)+筛选标记LEU或HIS片段(150 ng)+下游片段 DOWN-1/DOWN-2(50 ng)]为模板,P1/P1'和 P6/P6'为引物进行融合PCR反应,分别得到同源敲除组件UP-1-LEU-DOWN-1、UP-2-HIS-DOWN-2,前者用以第1拷贝敲除而后者用以第2拷贝敲除(图1B)。融合PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s,52 ℃ 50 s,68 ℃ 8 min(30个循环);68 ℃ 15 min。融合PCR产物经乙醇沉淀法回收,-20 ℃保存备用。融合片段即同源敲除组件送铂尚生物技术(上海)有限公司测序,并使用DNAMAN软件进行多重序列比对,证实序列的正确性。

图1 构建同源敲除组件Fig 1 Construction of homologous knockout fragments
1.2.4 目的基因ERG3敲除株的构建与鉴定 按照醋酸锂转染法[11]将第1拷贝敲除组件UP-1-LEU-DOWN-1转染到SN152菌株。在SD-LEU选择平板上培养48 h,挑单克隆于YPD培养液中过夜培养,抽提基因组DNA。采用套式PCR鉴定,得到ERG3+/-菌株(图2)。LEU上下游片段分别位于P1、P3的上游和下游,引物LEU上下游片段位于LEU标记的内部,可鉴定第1拷贝敲除组件是否正确插入目的基因的所在位置(图3)。经套式PCR鉴定正确的ERG3+/-菌株,用于转染第2拷贝敲除组件UP-2-HISDOWN-2,菌液密涂于SD-LEU、SD-HIS、SD-LEU-HIS选择性培养基上,其余步骤及套式PCR鉴定原理同上。引物ERG3-F和ERG3-R用于鉴定目的基因是否被完全敲除。

图2 运用同源重组技术敲除ERG3基因Fig 2 ERG3 gene knocked out by homologous recombination
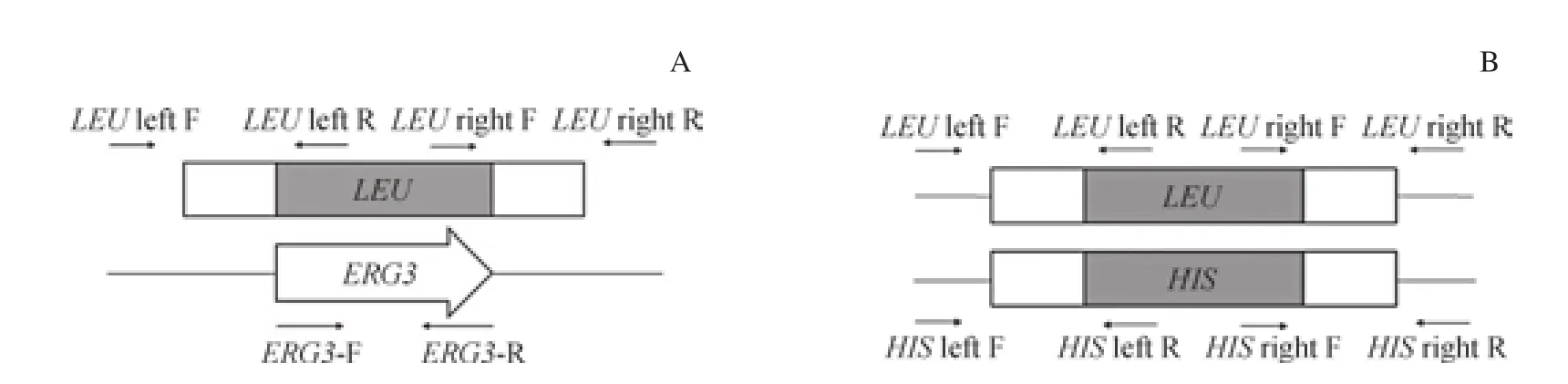
图3 ERG3阳性敲除菌株的鉴定Fig 3 Identification of positive ERG3 gene knockout strains
1.2.5 药敏试验 根据美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standards,NCCLS)M27-A3相关标准,使用微量肉汤稀释法确定白念珠菌对FCZ、VRC、ITR的最低抑菌浓度(minimum inhibitory concentration,MIC)。96孔板中,使得FCZ、VRC、ITR的最高终浓度分别为128、32、16 μg/mL,并依次对倍稀释。结果判读参照NCCLS抗真菌药敏试验标准,判定敏感(susceptible,S)、中介(intermediate,I)、耐药(resistance,R)3种结果。FCZ MIC≤8 μg/mL为敏感,MIC=16~32 μg/mL为中介,MIC≥64 μg/mL为耐药。VRC MIC≤1 μg/mL为敏感,MIC=2 μg/mL为中介,MIC≥4 μg/mL为耐药。ITR MIC≤0.125 μg/mL为敏感,MIC=0.25~0.5 μg/mL为中介,MIC≥1.0 μg/mL为耐药。
1.2.6 耐药相关基因表达水平检测 按照酵母总RNA提取试剂盒说明书提取SN152、ERG3+/-和ERG3-/-菌株的总RNA。根据反转录试剂盒对抽提的总RNA进行去基因组和反转录反应,获得cDNA。使用SYBR Premix Ex Taq酶试剂盒对3株菌株的cDNA行实时荧光定量PCR(realtime quantitative PCR,qPCR)检测,反应条件为:95 ℃30 s;95 ℃ 5 s,60 ℃ 1 min(40个循环)。溶解曲线反应为:95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s。引物序列见表 4。每个菌株均做复孔,重复3次,以18S RNA为内参基因,应用ABI 7300 SDS软件系统进行检测,CT值通过2-△△CT法进行相对基因表达分析。
1.3 统计学方法
采用GraphPad Prism 7软件对研究数据进行统计分析。定量资料以±s表示,采用单因素方差分析进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 ERG3基因缺失菌构建成功
白念珠菌SN152仅能在YPD培养基上生长;第1拷贝敲除株ERG3+/-可在YPD培养基和SD-LEU营养缺陷培养基上生长;双敲除菌株ERG3-/-在YPD、SD-LEU、SD-HIS和SD-LEU-HIS缺陷培养基上均可生长(图4)。继而说明LEU和HIS筛选标记已成功转入SN152菌株并表达。

图4 菌株营养型鉴定Fig 4 Identification of nutritional type in strains
为了进一步验证敲除组件是否正确插入目的基因所在位置,需采用套式PCR进行验证。利用LEU上下游引物扩增出LEU上下游片段,长度分别为1 009 bp和1 155 bp;利用HIS上下游引物扩增出HIS上下游片段,长度分别为1 214 bp和1 906 bp。经1.5% 琼脂糖凝胶电泳结果显示,各筛选标记已转入亲本菌基因组序列的正确位置,目的条带与预期一致。ERG3双敲株的4个鉴定片段(LEU上下游片段、HIS上下游片段)均在预期位置且目的基因ERG3位置无条带出现;而亲本菌SN152只有ERG3片段(454 bp)、无4个鉴定片段(图5)。由此提示,ERG3基因敲除成功。

图5 PCR验证ERG3基因敲除株Fig 5 Identification of ERG3 gene knockout strains by PCR
2.2 ERG3基因敲除对白念珠菌唑类药物耐药性的影响
用标准菌株ATCC90028作为对照,比较野生型菌株SN152、单拷贝缺失株(ERG3+/-)、双拷贝缺失株(ERG3-/-)对唑类药物敏感性的变化。前述菌株对FCZ、VRC、ITR的MIC值显示,ERG3+/-株与野生型SN152菌株均表现出对以上3种唑类药物一致的敏感。ERG3-/-株的MIC值明显高于ERG3+/-株和SN152菌株;且当ERG3基因被敲除后,白念珠菌对唑类药物的耐药性增强,即由敏感转为耐药(表5)。

表5 各菌株对FCZ、VRC、ITR的MIC值Tab 5 MIC values of FCZ, VRC and ITR in different Candida albicans strains
2.3 ERG3+/-株耐药基因水平的变化
在白念珠菌唑类药物耐药机制中,除了由ERG3基因编码的△5,6- 去饱和酶参与的甾醇合成通路改变之外,药物外排增加和唑类药物靶酶的改变也是常见原因。介导白念珠菌药物外排的转运蛋白家族主要有2类:一种是ABC(ATP-binding cassette)转运蛋白超家族,其中最重要的是CDR1p(Candida albicansdrug resistance protein 1)和CDR2p,分别由白念珠菌耐药基因CDR1和CDR2编码,它们通过水解ATP释放能量将药物转运出细胞[12];另一种是易化扩散载体超家族(major facilitator superfamily,MFS), 其 中 MDR1p(multidrug-resistance protein 1)由多药耐药基因MDR1编码,它不依赖于水解ATP的能量,而是通过细胞膜中氢离子的交换达到转运药物的目的[13]。此外,14-DM是由ERG11基因编码产生的唑类药物的靶酶。若ERG11基因发生突变或者过表达时,将会导致白念珠菌产生耐药性[14-15]。当ERG11发生突变,会影响14-DM的空间构象,使得药物与靶酶结合的亲合力降低;当ERG11过表达,药物作用靶酶量增多,导致同等药量下,未被药物结合的靶酶量也相应增高,药物不能达到预期的抗菌效果,从而产生耐药。因此为了探究ERG3基因敲除是否也与白念珠菌其他耐药机制相关,故采用qPCR检测各菌株中前述耐药基因(CDR1、CDR2、MDR1、ERG11)的表达情况,以SN152作为对照(图6)。结果显示,与SN152相比,ERG3+/-株的CDR1(2.05倍)表达上升,但CDR2、MDR1和ERG11无显著变化;而ERG3-/-株的CDR1(2.63倍)、CDR2(18.47倍)、MDR1(3.72倍)、ERG11(51.71倍)表达均显著上升,尤以ERG11的上调最为显著。由此可见,ERG3基因敲除的同时伴随着其他耐药基因的高表达。

图6 各菌株耐药相关基因的表达Fig 6 Expression of drug resistance-related genes in the three strains
3 讨论
基因敲除技术是研究白念珠菌基因功能的重要方法。经典的白念珠菌基因敲除方法为URA-Blaster策略,该方法以基因同源重组为基础,通过连续2次的hisG-URA3-hisG敲除筛选组件替代靶基因的2个等位基因,从而阻断靶基因的功能[16-17]。URA-Blaster策略是最早用到营养筛选的白念珠菌基因敲除的方法,但此法需要构建重组质粒,敲除效率低、周期长;而且有研究[18-19]表明,乳清苷5- 磷酸脱羧酶(URA3基因编码)缺失的白念珠菌生长缓慢,即使在基因敲除过程中可将URA3基因恢复,也同样会影响菌株的毒力、黏附及形态转换等性质。2005年Noble等[8]构建了不依赖URA3的HIS1-LEU2-ARG4基因敲除策略,该方法以SN152为亲本菌,HIS1、LEU2、ARG4是异源的筛选标记,可任意选择2个标记进行基因敲除。本实验所采用的HIS1-LEU2策略回避了URA3对白念珠菌毒力的影响,且具有周期短、转染效率高等特点[20-21]。此外,Noble等[8]构建的2条基因敲除组件上游和下游同源臂(即UP和DOWN)均为350 bp,存在第1条敲除组件被第2条敲除组件所替换的可能性,导致敲除效率降低。本研究在Noble等[8]的方法基础上稍加改进,即UP-1为359 bp、DOWN-1为 470 bp、UP-2为 354 bp、DOWN-2为393 bp,第2条敲除组件的上下游同源臂均短于第1条敲除组件的同源臂,因此可有效避免被替换的情况。
白念珠菌是临床上常见的机会致病性真菌,唑类药物常作为临床治疗中的一线用药;然而,近年来白念珠菌对唑类药物的耐药性日益严重,已成为治疗失败的主要原因之一[22]。白念珠菌对唑类药物存在多种耐药机制,其中甾醇合成通路的变化主要是因为△5,6-脱氢酶失活而引起,从而使唑类药物的作用减弱。Martel等[23]的研究显示,ERG3的错义突变可以引起白念珠菌对唑类药物的高度耐药性,部分突变菌株甚至在FK506(一种多药物外排抑制剂)存在的情况下仍体现出唑类耐药表型。Vale-Silva等[24]在临床上筛到了一株分离株(VSY2),测序显示该菌株ERG3双碱基缺失导致△5,6- 脱氢酶失活,该菌株对唑类药物具有高耐药性,缺乏麦角甾醇但丝状结构正常。由此可见,白念珠菌ERG3的突变或缺失对于其唑类药物耐药性有着重要意义。
在本研究中,我们使用同源重组和LEU-HIS标记筛选的方法获得了白念珠菌ERG3缺失株。ERG3-/-株对3种唑类药物的MIC值明显高于亲本株SN152和ERG3+/-株,说明只有当ERG3被完全敲除时,白念珠菌对唑类药物的耐药性才会升高,ERG3单条基因的缺失不足以引起耐药性的改变,该耐药性结果与Luna-Tapia等[25]采用URA-Blaster策略获得的ERG3缺失株结果一致。此外,我们还发现ERG3基因敲除的同时也伴随着其他耐药基因的改变。qPCR结果显示,ERG3-/-株的CDR1、CDR2、MDR1、ERG11基因表达水平均显著上升;而ERG3+/-株除了CDR1基因表达有上升外,其余3个耐药基因未显示出差异。ERG3-/-和ERG3+/-菌株耐药基因的结果和药敏实验的结果存在一定的一致性。CDR1、CDR2、MDR1是与外排泵编码相关的基因,这些基因的过表达可导致进入菌体内的药物外排,细胞内药物浓度降低从而导致耐药。而在ERG3-/-株中上升最为显著的是ERG11(51.71倍),ERG11所编码的羊毛甾醇14-DM是唑类药物的作用靶酶,若ERG11基因过表达将会导致菌株耐药。本研究证实了ERG3-/-株中的外排泵基因CDR1、CDR2、MDR1和药物靶酶编码基因ERG11的高表达,从基因水平提示ERG3基因的缺失除了导致白念珠菌甾醇合成通路改变,或也伴随着其他耐药机制的发生。后续可深入检测ERG3敲除带来的功能变化,即检测ERG3-/-株罗丹明6G外排情况和14-DM的活性,从而进一步明确ERG3敲除与菌株药物外排的能力和药物靶酶变化的联系。同时,ERG3基因是如何参与介导白念珠菌对其他唑类药物耐药机制也仍待进一步研究。
综上所述,本研究成功利用同源重组的方法构建了白念珠菌ERG3基因缺失菌,并对其唑类药物耐药性之间的关系进行了初步探究,揭示了在白念珠菌中敲除ERG3基因可提高菌株唑类药物的耐药性,为进一步研究ERG3基因与白念珠菌多种耐药机制之间的关系提供了基础。
