乳酸菌和木糖葡萄球菌对产气荚膜梭菌 抑制能力分析
2020-04-02李沛军田兴垒孔保华
张 欢,李沛军,田兴垒,陈 倩,孔保华
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
亚硝酸盐是香肠等腌制肉制品中常用的添加剂,具有抑菌、抗氧化、呈色、赋予产品风味等功能,其中,呈色与抑菌作用是其在肉制品中应用的最重要原因[1-3]。 然而,亚硝酸根与肉类中的仲胺或叔胺反应会生成致癌、致畸和致突变的亚硝基化合物,加之其本身的毒性,因而应用受限[4-5]。为此,科研人员进行了大量研究以期找出能够部分或完全替代肉制品中亚硝酸盐的天然替代物[6-7],但到目前为止,基于各种原因鲜见此类物质在肉制品中广泛应用[8]。
目前,微生物发酵法替代肉制品中的亚硝酸盐是一个全新的研究领域,一些细菌可通过接种或本身存在于发酵肉制品中,除赋予发酵产品特殊风味和口感外,还可有效抑制有害菌的增殖生长[9-12]。还有研究发现一些菌株可以产生NO与肉中的肌红蛋白作用形成亚硝基肌红蛋白,使肉呈现鲜艳的亮红色[13-14]。前期Li Peijun等[15]选用本实验室的5 株乳酸菌和1 株木糖葡萄球菌作为受试菌株,结果发现其中1 株木糖葡萄球菌和1 株发酵乳杆菌在培养基体系中可将肌红蛋白转化为氧合肌红蛋白,在肉糜体系中将高铁肌红蛋白转化为亚硝基肌红蛋白,均具有良好的呈色效果。
肉类腌制中添加亚硝酸盐,其抑菌作用中最主要是抑制肉毒梭状芽孢杆菌生长和产毒素,保障肉制品 安全[16-17]。基于以上Li Peijun等[15]对呈色菌株的获得,本研究拟探究这5 株乳酸菌和1 株木糖葡萄球菌体外抑制肉毒梭菌增殖的能力,获取1 株抑菌能力强的菌株,与之前获得的呈色效果好的菌株复配,制成复合呈色抑菌剂从而替代肉制品中亚硝酸盐的添加。然而,肉毒梭菌毒性大且难以获得,基于前人研究,发现产气荚膜梭菌与其具有相似的生理活性和生长习性,且该菌易得,毒性相对较小,对操作环境要求不高,在实验过程中可以很好替代肉毒梭菌进行相关研究[18-19]。目前,Nieto-Lozano[20]和Enan[21]等分别发现乳酸片球菌和能够产植物乳杆菌素的植物乳杆菌UG1能够有效抑制产气荚膜梭菌;Enan等[22]将这种细菌素应用到鸡肉、火鸡肉和牛肉样品中,发现实验组中的有害菌得到了极好的控制。
本研究以产气荚膜梭菌替代肉毒梭状芽孢杆菌,拟以5 株乳酸菌和1 株木糖葡萄球菌作为受试菌株,通过混合培养以及条件培养,分别研究这些菌株及其发酵上清液对菌体本身生长、芽孢萌发与生长、芽孢形成的抑制作用,评价并筛选抑菌能力最强的目标菌株,同时探究抑菌机理,以期获得具有抑菌作用的发酵剂,为发酵肉制品的安全提供良好的保障。
1 材料与方法
1.1 材料与试剂
产气荚膜梭菌(Clostridiumperfringens)ATCC 13124(type A)、发酵乳杆菌(Lactobacillus fermentum)KLDS1.0709和清酒乳杆菌(L. sake)AS1由中国工业微生物菌种保藏管理中心提供;弯曲乳杆菌(L. curvatus)、植物乳杆菌(L. plantarum)、戊糖片球菌(Pediococcus pentosaceus)和木糖葡萄球菌(Staphylococcus xylosus)从哈尔滨风干肠中分离获得并保存于东北农业大学食品学院畜产品加工研究室。
MRS(de Man, Rogosa and Sharp)液体培养基 广东环凯微生物科技有限公司;mDS(medium D plus sucrose)芽孢形成培养基、mDS-G(medium D plus sucrose-glucose)培养基、脑心浸出液肉汤(brain heart infusion,BHI)培养基、甘露醇盐琼脂(mannitol salt agar,MSA)培养基 北京陆桥生物科技有限公司;琼脂、氯化钠、乳酸均为分析纯。
1.2 仪器与设备
JD500-2电子天平 沈阳龙腾电子称量仪器有限 公司;AL-104精密电子天平、DELTA 320 pH计 上海梅特勒-托利多仪器设备有限公司;高压蒸汽灭菌锅 上海申安医用仪器厂;摇床培养箱 哈尔滨东联电子技术开发有限公司;754PC紫外-可见分光光度计 上海光谱仪器有限公司;ZHJH-1109超净工作台 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 受试菌株的培养
将发酵乳杆菌、清酒乳杆菌、弯曲乳杆菌、植物乳杆菌、戊糖片球菌和木糖葡萄球菌分别在MRS液体培养基,产气荚膜梭菌在BHI培养基中活化2 代至对数生长末期,6 000×g离心10 min,收集各个菌体沉淀,然后取一定量的菌体沉淀分别接种到8 mL mDS-G培养液中,依据前期菌体浓度-OD600nm的标准曲线,将木糖葡萄球菌和其他乳酸菌分别调至所需浓度对应的OD值,使木糖葡萄球菌终浓度为6(lg(CFU/mL)),其他5 株乳酸菌终浓度各为7(lg(CFU/mL)),用于后续研究。
1.3.2 产气荚膜梭菌芽孢的制备
芽孢的制备参照Cevallos-Cevallos等[23]的方法,将1.3.1节活化好的产气荚膜梭菌以2%的量接种到50 mL mDS培养基中,37 ℃厌氧培养12 h,80 ℃加热30 min除去活细胞,制备得到产气荚膜梭菌芽孢。
1.3.3 产气荚膜梭菌生长的抑制
1.3.3.1 混合培养
参照Teo等[24]的方法,略作改动。在1.3.1节含有不同受试菌株的mDS-G培养液中同时添加产气荚膜梭菌菌株,使其终浓度达到7(lg(CFU/mL))。37 ℃厌氧培养24 h后,测定培养液pH值、受试菌数和产气荚膜梭菌菌数。其中,乳酸菌计数采用MRS琼脂培养基,木糖葡萄球菌计数采用MSA琼脂培养基,产气荚膜梭菌计数采用BHI琼脂培养基,37 ℃培养48 h,进行计数。
1.3.3.2 条件培养
参照Wrigley[25]的方法,将1.3.1节接种有各受试菌的mDS-G培养液于37 ℃厌氧培养24 h后,测定各培养液pH值,通过0.22 μm无菌滤膜过滤除去受试菌株,再接种产气荚膜梭菌,使其终浓度达到7(lg(CFU/mL))。37 ℃厌氧培养24 h后,对产气荚膜梭菌进行活菌计数。产气荚膜梭菌计数方法同上。
1.3.4 产气荚膜梭菌芽孢萌发及生长的抑制
1.3.4.1 混合培养
将1.3.2节制备的产气荚膜梭菌芽孢添加到1.3.1节处理好的6 株受试菌株mDS-G培养液中,并使其终浓度达 到3(lg(CFU/mL))。37 ℃厌氧培养24 h后,测定培养液pH值、各受试菌数和产气荚膜梭菌数。
1.3.4.2 条件培养
将1.3.1节接种有各受试菌的mDS-G培养液于37 ℃厌氧培养24 h后,测定各培养液pH值,通过过滤除去受试菌株,再接种产气荚膜梭菌芽孢,使其终浓度达到 3(lg(CFU/mL))。37 ℃厌氧培养24 h后,对产气荚膜梭菌进行活菌计数。
1.3.5 产气荚膜梭菌芽孢形成的抑制
1.3.5.1 混合培养
参照Wrigley[25]的方法,略作改动。考虑到芽孢形成需要较高的pH值,经预实验,将所用mDS产芽孢培养基pH值调节为6.8。将产气荚膜梭菌接种到8 mL mDS芽孢形成培养基中,使其终浓度达到7(lg(CFU/mL));同时接种6 株受试菌体沉淀,使乳酸菌终浓度为 7(l g(C F U/m L)),木糖葡萄球菌浓度为 6(lg(CFU/mL))。37 ℃厌氧培养24 h后,测定培养液pH值及其受试菌株菌落数和产气荚膜梭菌芽孢数。
1.3.5.2 条件培养
参照Wrigley[25]的方法,先将6 株受试菌株菌体分别接种到mDS培养基(pH 6.8)中,调节乳酸菌终浓度为 7(l g(C F U/m L)),木糖葡萄球菌浓度为 6(lg(CFU/mL))。37 ℃厌氧培养24 h后,发现各菌株几乎不生长或生长现象不明显,继续培养至48 h后,测定培养液pH值。通过过滤除去菌体,再接种产气荚膜梭菌菌株,使其终浓度达到7(lg(CFU/mL))。37 ℃厌氧培养24 h后,测定产气荚膜梭菌芽孢数。
1.3.6 抑菌机理分析
1.3.6.1 pH值对产气荚膜梭菌生长及芽孢萌发的影响
为验证乳酸菌发酵引起的培养基pH值降低是否为抑制产气荚膜梭菌生长的因素,分别用乳酸调节mDS-G培养基pH值至一系列值(6.8、6.6、6.4、6.2、6.0、5.8、5.6、5.4、5.2、5.0和4.8),灭菌后分别接种产气荚膜梭菌菌株(终浓度为7(lg(CFU/mL)))或其芽孢(终浓度为3(lg(CFU/mL)))。37 ℃厌氧培养24 h后,测定其中产气荚膜梭菌数。
1.3.6.2 抑菌物质对产气荚膜梭菌生长的影响
在“产气荚膜梭菌生长的抑制”系列实验中,发现植物乳杆菌除可以导致培养基具有较低pH值这一抑制产气荚膜梭菌条件外,还应该代谢产生了某种抑菌物质,而上述pH值梯度实验也从侧面说明了这一点。为进一步验证是否存在该抑菌物质,将植物乳杆菌和弯曲乳杆菌(产酸能力基本一致)接种到mDS-G培养基中进行厌氧培养,发酵后调节二者pH值和对照组一致(pH 6.8),分别用80 ℃加热30 min灭菌和0.2 μm无菌滤膜的方式除去受试菌,再分别接种产气荚膜梭菌(终浓度为 7(lg(CFU/mL))),37 ℃厌氧培养24 h后,测定其中产气荚膜梭菌数。
1.4 统计分析
2 结果与分析
2.1 抑制产气荚膜梭菌生长分析
2.1.1 混合培养
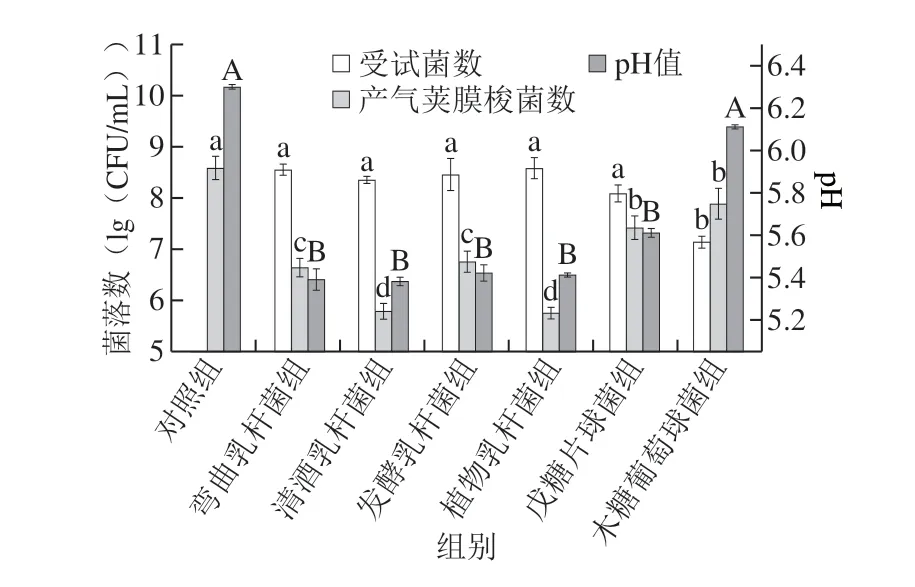
图 1 受试菌与产气荚膜梭菌混合培养对产气荚膜梭菌的抑制作用Fig. 1 Inhibition of C. perfringens by LAB and S. xylosus in mixed culture
由图1可知,各组乳酸菌数均升高至8(lg(CFU/mL)) 以上,且彼此间无显著性差异(P>0.05),木糖葡萄球菌数生长到7.14(lg(CFU/mL))。通过对比可发现,植物乳杆菌组和清酒乳杆菌组中产气荚膜梭菌数最低,经培养后分别降低到5.62(lg(CFU/mL))和 5.96(lg(CFU/mL)),而对照组中产气荚膜梭菌数为8.58(lg(CFU/mL)),表明这两株菌不仅抑制了产气荚膜梭菌的生长,且对其有一定的杀死作用。发酵乳杆菌、戊糖片球菌和弯曲乳杆菌组中产气荚膜梭菌数维持在6~7(lg(CFU/mL)),这表明这3 株乳酸菌对产气荚膜梭菌的生长具有一定的抑制作用,但对其几乎没有杀死能力。另外,木糖葡萄球菌组中产气荚膜梭菌数最高,达到7.88(lg(CFU/mL))。Gioia等[26]将植物乳杆菌和德氏乳杆菌分别与产气荚膜梭菌共培养24 h后,发现这两株菌均具有很好的抑制产气荚膜梭菌增殖能力,且前者抑制能力优于后者,推测这可能与乳酸菌的产酸以及抑菌物质的能力有关。本实验结果亦表明乳酸菌的产酸能力与其抑菌能力密不可分。
2.1.2 条件培养
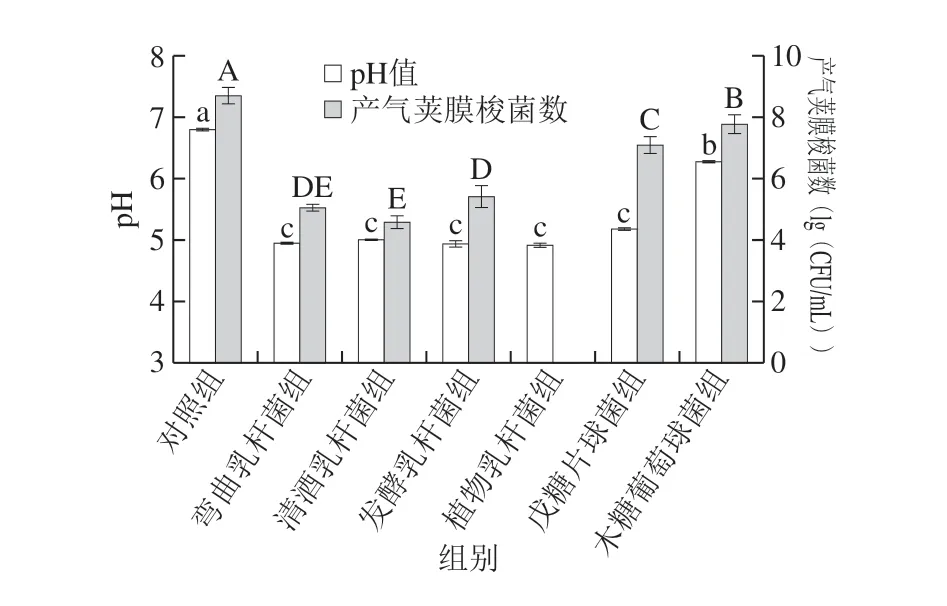
图 2 不同受试菌株条件培养基对产气荚膜梭菌的抑制作用Fig. 2 Inhibition of C. perfringens by LAB and S. xylosus in conditioned culture
由图2可知,经过24 h的厌氧培养,弯曲乳杆菌、清酒乳杆菌、发酵乳杆菌和植物乳杆菌组的发酵上清液pH值降至4.9~5.0之间,对应的产气荚膜梭菌生长受到强烈抑制;戊糖片球菌组和木糖葡萄球菌组pH值分别降为5.18和6.27,两组对应的产气荚膜梭菌细胞未受破坏,这表明乳酸菌代谢产生的有机酸是抑制产气荚膜梭菌增殖的关键因素,Schoster等[27]在17 株商业益生菌对产气荚膜梭菌和艰难梭状芽孢杆菌的抑制研究中也证实了这一结论。另外值得注意的是,植物乳杆菌组中并未发现产气荚膜梭菌的存在,这进一步表明,该组中除较低的pH值这一抑菌条件外,也存在其他的抑菌物质。
2.2 抑制产气荚膜梭菌芽孢萌发及生长分析
2.2.1 混合培养
产气荚膜梭菌存活在营养不良或不适合其生长的外界环境时,可形成芽孢[28]。由图3可知,经过24 h的混合厌氧培养,各组受试菌株均生长良好。与对照组相比,在接种乳酸菌的体系中,产气荚膜梭菌芽孢萌发受到明显抑制,经过24 h的厌氧培养,菌数不超过 5.89(lg(CFU/mL)),这表明仅有少量的芽孢萌发并进行二次生长,而木糖葡萄球菌组中,产气荚膜梭菌的芽孢萌发并未受到抑制,其菌数达到了7.08(lg(CFU/mL))。 这可能是乳酸菌在发酵的过程中产生了的机酸抑制了芽孢的萌发,Lee等[29]以不添加亚硝酸盐的乳化肠为研究模型,结果发现添加2%的白醋(主要成分为乙酸)可使产气荚膜梭菌芽孢不能在2 周内萌发。
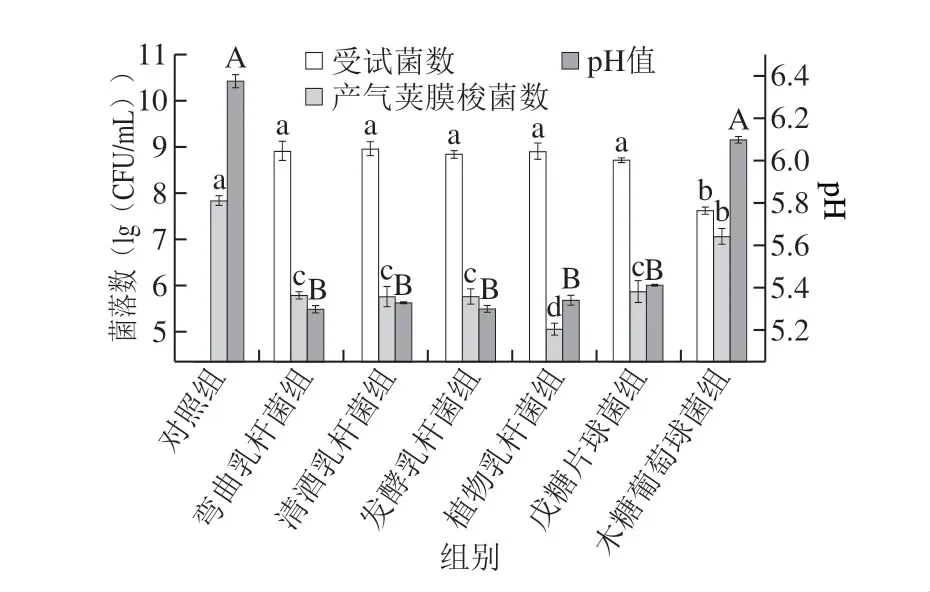
图 3 受试菌与产气荚膜梭菌混合培养对其芽孢萌发及生长的抑制作用Fig. 3 Inhibitory effect of LAB and S. xylosus on spore germination and growth of C. perfringens in mixed culture
2.2.2 条件培养
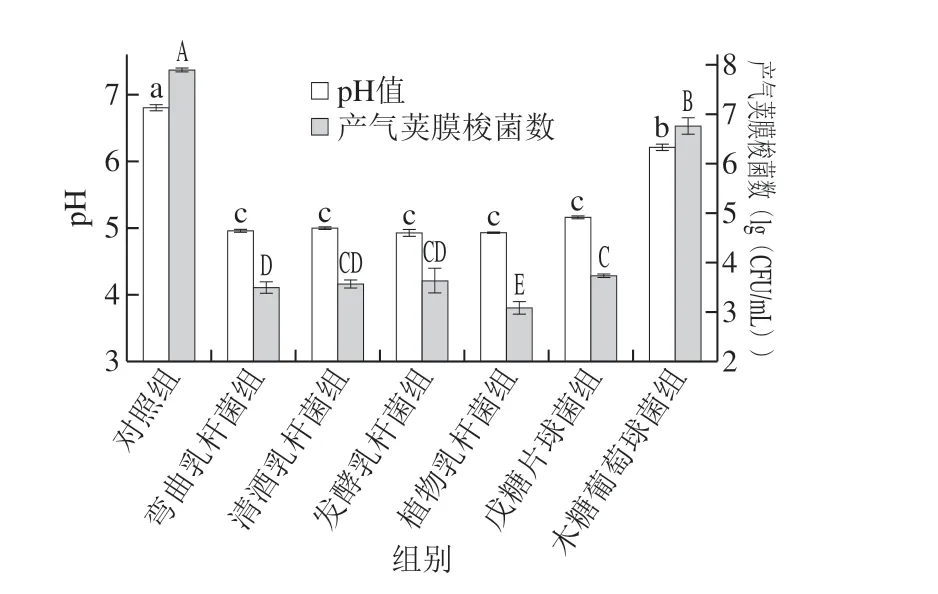
图 4 不同受试菌株条件培养基对产气荚膜梭菌芽孢萌发及 生长的抑制作用Fig. 4 Inhibitory effect of LAB and S. xylosus on spore germination and growth of C. perfringens in conditioned culture
由图4可知,经过24 h的厌氧培养,多数乳酸菌处理组pH值降为4.9~5.0,戊糖片球菌组pH值为5.16,木糖葡萄球菌组最终pH值为6.21。在所有乳酸菌发酵得到的条件培养基中,产气荚膜梭菌芽孢萌发及生长受到了较强的抑制。木糖葡萄球菌处理组中,产气荚膜梭菌数达到了6.75(lg(CFU/mL)),虽略低于对照组,但考虑到菌株间的竞争作用,认为其并未对其芽孢的萌发及生长产生抑制作用。对比各组条件培养基pH值不难发现,产气荚膜梭菌芽孢的萌发和生长,与条件培养基的初始pH值有很大相关性。
2.3 抑制产气荚膜梭菌芽孢形成分析
2.3.1 混合培养
由于产气荚膜梭菌在形成芽孢时,会产生肠毒素,且其一旦形成芽孢,将更难以杀灭[30]。因此,为研究不同菌株对产气荚膜梭菌芽孢形成的抑制作用,首先将6 株受试菌株与产气荚膜梭菌同时接种于mDS产芽孢培养基中混合培养,37 ℃厌氧培养24 h后,分别测定受试菌株数和产气荚膜梭菌芽孢数。由于mDS培养基中以高分子聚合物淀粉为碳源,各株受试乳酸菌对其利用效果很差,因此导致了乳酸菌生长缓慢,而未对产气荚膜梭菌芽孢形成有效的抑制作用[31];木糖葡萄球菌虽然有生长,但亦未观察到其对芽孢形成的抑制作用(数据未列出)。
2.3.2 条件培养
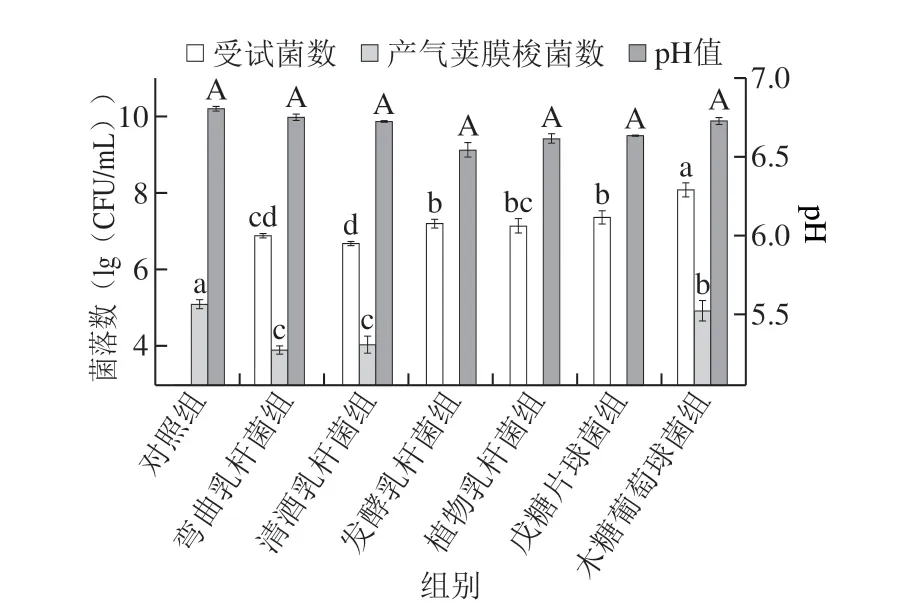
图 5 不同受试菌株条件培养基对产气荚膜梭菌芽孢形成的抑制作用Fig. 5 Inhibitory effect of LAB and S. xylosus on sporulation of C. perfringens in conditioned culture
如图5所示,经过48 h的厌氧培养,菌落计数结果显示,弯曲乳杆菌和清酒乳杆菌基本没有显示出生长迹象,其中活菌数有所下降,这表明二者不能利用淀粉作为其营养物质,因此,亦不能抑制产气荚膜梭菌芽孢的形成。发酵乳杆菌、植物乳杆菌和戊糖片球菌数稍有增长,相应培养基pH值也有所降低,其对应的条件培养基中未发现芽孢的生成。由于产气荚膜梭菌芽孢形成需要较高的pH值和不存在游离单糖两个条件[30],因此,这也就很好地解释了这3 株乳酸菌可以抑制其芽孢形成的现象。同样,尽管木糖葡萄球菌生长,但亦未观察到其对应条件培养基对芽孢形成有抑制作用。
2.4 抑菌机理分析
2.4.1 培养基pH值对产气荚膜梭菌和其芽孢萌发及生长的影响
2.4.1.1 培养基pH值对产气荚膜梭菌生长的影响
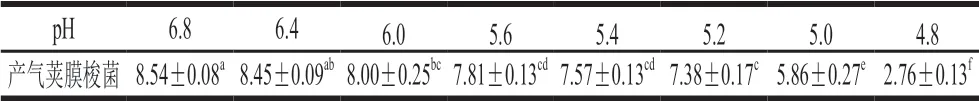
表 1 培养基初始pH值对产气荚膜梭菌生长的影响Table 1 Influence of initial medium pH on C. perfringens growth(lg(CFU/mL))
由表1可知,随着培养基pH值下降,产气荚膜梭菌数亦呈现下降趋势。与2.1.1节混合培养对产气荚膜梭菌生长的抑制能力研究结论一致,即pH值下降是乳酸菌抑制产气荚膜梭菌生长的主要原因,而植物乳杆菌则可能存在其他途径抑制该病原菌的生长。随着pH值下降至5.0以下,产气荚膜梭菌显著降低(P<0.05),这解释了在条件培养中多数乳酸菌抑制产气荚膜梭菌生长而戊糖片球菌对其抑制作用不明显的问题,同时也表明植物乳杆菌具备分泌某种抑菌物质的能力,可以使产气荚膜梭菌数降为0。总之,乳酸菌发酵葡萄糖产酸降低培养基pH值是决定乳酸菌抑制产气荚膜梭菌生长的主要因素,这主要是因为有机酸可穿过细菌细胞膜,在胞内发生解离后释放出无法穿过细胞膜的电荷阴离子和质子,对必需代谢反应的抑制进一步造成了对细菌的生长抑制[32]。另外,植物乳杆菌可能存在其他抑制产气荚膜梭菌生长的途径。
2.4.1.2 培养基pH值对产气荚膜梭菌芽孢萌发及生长的影响
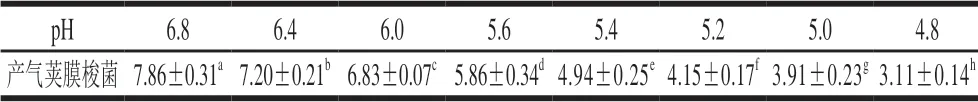
表 2 培养基不同初始pH值对产气荚膜梭菌芽孢萌发及生长的影响Table 2 Influence of initial medium pH on spore germination and growth of C. perfringens (lg(CFU/mL))
由表2可知,随着培养基pH值下降,产气荚膜梭菌菌数下降,表明低pH值是抑制产气荚膜梭菌芽孢萌发及二次生长的关键因素。该结果与抑制产气荚膜梭菌芽孢萌发及生长实验均表明,无论是乳酸菌发酵还是直接调节培养基pH值,都不能杀死或破坏产气荚膜梭菌芽孢,在混合培养中,植物乳杆菌处理组中产气荚膜梭菌数最少(图3)的原因可能是在混合培养初期,部分芽孢萌发得到的活细胞在二次生长的过程中受到来自植物乳杆菌抑菌物质的作用,抑制了其生长。因此,乳酸菌发酵葡萄糖产酸降低培养基pH值是决定乳酸菌抑制产气荚膜梭菌芽孢萌发的最主要因素,而当芽孢一旦萌发,植物乳杆菌分泌的抑菌物质会协同低pH值作用,抑制其二次生长[33]。
2.4.2 抑菌物质对产气荚膜梭菌生长的影响
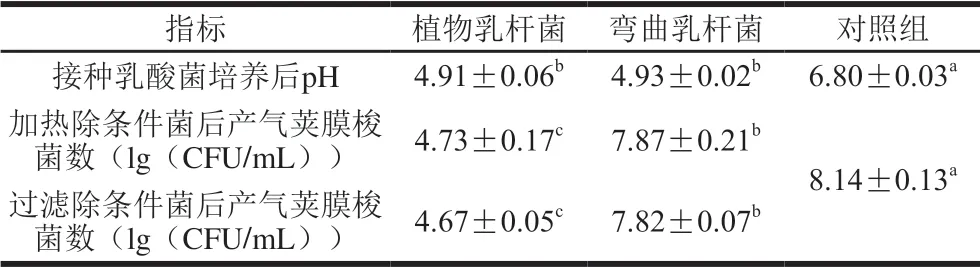
表 3 不同处理方式对产气荚膜梭菌生长的影响Table 3 Influence of different treatments on C. perfringens growth
经过对植物乳杆菌和弯曲乳杆菌进行24 h的厌氧发酵,两组mDS-G培养基pH值分别降低至4.91和4.93 (表3),表明二者发酵葡萄糖产酸水平总体相当。将两组培养基pH值调节至6.80后使用两种方式灭(除)菌,再同时向3 种培养基中接种产气荚膜梭菌。培养后计数结果显示,无论是加热杀死还是过滤除去条件菌,植物乳杆菌组均对产气荚膜梭菌均有更强的抑制作用(P<0.05)。由于其pH值已经调节和对照组一致,因此,抑菌作用只能源自其分泌的抑菌物质,考虑到该抑菌物质的耐热性,推断其为植物乳杆菌分泌的细菌素。而对于两组弯曲乳杆菌组(加热或过滤),产气荚膜梭菌落数均达到7.8(lg(CFU/mL))以上,略低于对照组的 8.14(lg(CFU/mL)),这可能是因为虽然处理组培养基pH值与对照组相同,但由于前期弯曲乳杆菌的生长,消耗了部分培养基营养成分所致。此外,对比条件培养实验结果(图2)可知,条件培养组中并未检测到产气荚膜梭菌活细胞,而本实验中将其pH值调回6.80后,测定其活细胞数为4(lg(CFU/mL))。这说明在条件培养中,较低pH值和细菌素的协同作用,抑制了产气荚膜梭菌生长。
3 结 论
5 株乳酸菌和1 株木糖葡萄球菌对产气荚膜梭菌增殖、芽孢生长及萌发、芽孢形成抑制作用不同,其中,植物乳杆菌对产气荚膜梭菌抑制能力最强,这是因为植物乳杆菌除产酸抑菌外,还可产生耐高温的细菌素,其他4 株乳酸菌效果次之,而木糖葡萄球菌无明显的抑制作用。研究为抑制产气荚膜梭菌增殖提供了解决方法,后续可以将本实验中具有良好抑菌作用的植物乳杆菌与前期研究得到的呈色菌种(发酵乳杆菌或木糖葡萄球菌)进行复配,应用于发酵肉制品中,为微生物发酵法部分替代亚硝酸盐提供一条很好的途径。
