酸解法与酶解法调控右旋糖酐分子质量的比较
2020-04-02黄瑞杰廖安平蓝丽红王雪娇韦丽明甘兰芳
黄瑞杰,李 媚,廖安平,蓝 平,钟 磊,覃 琴,蓝丽红,王雪娇,韦丽明,甘兰芳
(广西民族大学化学化工学院,广西多糖材料及改性重点实验室,广西 南宁 530006)
右旋糖酐酶(E.C. 3.2.1.11)是一种可以特异性水解右旋糖酐中α-1,6糖苷键的酶[1-2]。临床级别特定分子质量的右旋糖酐在医药领域有重要应用,中低分子质量的右旋糖酐(重均分子质量(mw)20~70 kDa)可以用作血浆替代品[3],用于治疗休克;右旋糖酐T10(mw≈10 kDa)具有渗透性利尿作用[4];微分子质量的右旋糖酐(mw=6~8 kDa)可以络合铁用于治疗缺铁性贫血[5];mw不足5 kDa的右旋糖酐可以进行硫酸化修饰,得到具有抗凝血特性的产物,用于抗血栓治疗,其衍生物还具有抗病毒特性[4]。右旋糖酐在食品和轻工业方面也有重要的应用[6-7],高分子质量的右旋糖酐(mw>1 000 kDa)可用作色谱柱填充剂[8];右旋糖酐 (100 kDa<mw<1 000 kDa)可以作为饮料和糕点制作中的乳化剂、稳定剂、保湿剂和增稠剂[9]。中低分子质量右旋糖酐衍生物可以用作药物载体[10],特小分子质量的右旋糖酐可用于制备具有益生元功能的右旋糖酐 衍生物[11]。天然发酵的右旋糖酐因分子质量和黏度太大不能直接进行使用,所以要将其降解到特定分子质量以满足使用。右旋糖酐的降解方法有物理法、化学法和生物法,其中物理法主要是超声法[12-13],该法操作简单,有机溶剂使用较少,但耗能量大,不适合大规模生产[14];化学法主要是酸解法,主要采用盐酸进行降解,这种方法反应速率快,但得到的产物有大量氯化物残留,而且能耗高、污染大、设备易受腐蚀[15-16];生物降解法为右旋糖酐酶法,此反应条件温和、反应速率快、能耗低、污染小[17],可调控得到各种特定分子质量右旋糖酐以及功能性低聚糖[18],这为低能耗、高品质右旋糖酐产品的生产奠定基础。
对于右旋糖酐mw的测定,大多采用凝胶色谱法,通过示差检测器分析[5,19],这种方法依赖于流速控制和标准曲线,而标准曲线反映的是保留时间和峰位分子质量(mp)之间的关系,mw测定只能依赖于对测得的mp推算;再者右旋糖酐在降解过程中分布不均一,得到mp不能反映mw,这就造成了mw测量过程中极大的误差。近年来,多角度激光光散射仪与凝胶色谱联用成为大分子聚合物分子质量测定的热点。王涛[20]和Pawcenis[21]等采用多角度激光光散射仪与凝胶色谱联用分别测定聚硅氧烷和纤维素的mw,测定方法简单准确。多角度激光光散射仪可从多个角度对散射光进行检测,收集散射光的强度,并直接得到绝对mw和其他分子质量的数据。将凝胶色谱与光散射方法联用,不依赖于泵速、标准曲线就可得到高分子聚合物的mw、mp、数均分子质量(mn)、质均分子质量(mz)和分子质量分布(mw/mn)[22]。
本实验以右旋糖酐mw和mw/mn为指标,采用十八角度激光光散射仪与凝胶色谱法联用进行右旋糖酐的mw和mw/mn测定,比较不同条件下酸解法和酶解法调控降解右旋糖酐分子质量的情况,对得到的右旋糖酐产物进行比较,分析两种方法的优劣,为酶解法生产特定分子质量的右旋糖酐产品提供理论支持。
1 材料与方法
1.1 材料与试剂
右旋糖酐T5、T20、T50、T80、T500、T2000(mw≈5.52、19.2、48.6、80.9、472.6、1 901 kDa;mw/mn≈1.57、1.499、1.24、1.27、1.52、3.21) 美国Sigma试剂公司;盐酸 国药集团化学试剂有限公司;圆弧青霉(Penicillium cyclopium,CICC-4022) 中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
DAWN HELEOS II型十八角度激光光散射仪(配有ASTRA 7.1.3软件) 美国Wyatt公司;凝胶液相色谱仪(配有2414型示差折光检测器、1525型泵) 美国Waters公司;高效液相色谱仪(配有RID-10A折射率检测器、LC-20AD泵) 日本岛津公司;傅里叶变换红外光谱仪 美国Thermo公司;场发射扫描电子显微镜(配有OXFORD X-MaxN51-XMX1004能谱仪) 德国卡尔蔡司公司。
1.3 方法
1.3.1 纯化酶液的制备
配制圆弧青霉产酶培养基[23],装液量6 0 m L(250 mL锥形瓶)、接种量3%、发酵温度30 ℃、摇床转速160 r/min培养72 h得到发酵液;于4 ℃、10 000 r/min离心20 min得到的上清液为粗酶液;粗酶液经硫酸铵分级沉淀和凝胶过滤层析得到纯化酶液[24],稀释数倍备用。
1.3.2 右旋糖酐酶活力测定
右旋糖酐酶活力通过测定右旋糖酐酶降解右旋糖酐T70生成的还原糖量表示,还原糖含量通过3,5-二硝基水杨酸法进行测定[25]。右旋糖酐酶活力(1 U)被定义为在50 ℃、pH 5条件下每小时水解右旋糖酐T70产生1 mg还原糖(葡萄糖当量)所需要的酶量[26]。
1.3.3 右旋糖酐分子质量的测定
1.3.3.1 色谱条件
凝胶色谱柱:UltraOhydroGelTM2000(7.8 m m×300 mm)、UltraOhydroGelTM250(7.8 mm×300 mm)、UltraOhydroGelTMDP120A(7.8 mm×300 mm);流动相:0.1 mol/L硝酸钠和0.03%叠氮钠;流速:1 mL/min;进样量:0.2 mL;柱温:35 ℃;示差检测器温度:35 ℃;十八角度激光光散射仪折光指数增量(dn/dt):0.138。
1.3.3.2 样品处理
酸解样品为反应结束用氢氧化钠中和至pH 6.0~7.0,流动相稀释10 倍,用0.22 μm的水系针头过滤备用;酶解样品为反应结束后,沸水浴3~5 min灭活酶液,流动相稀释10 倍,用0.22 μm的水系针头过滤备用。
1.3.3.3 图像处理
样品出峰后,采用美国Wyatt公司的十八角度激光光散射仪配有的ASTRA 7.1.3软件进行图像处理,出峰时以示差信号为准,收峰时以激光信号为准,得到右旋糖酐的mw和mw/mn。
1.3.4 酸解右旋糖酐mw和mw/mn的调控
1.3.4.1 温度对右旋糖酐降解的影响
用1 mol/L的盐酸水解底物质量浓度为30 mg/mL的右旋糖酐T80,底物与酸按体积比1∶1加入,摇匀后分别于70、80、90、100 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.4.2 底物分子质量对右旋糖酐降解的影响
用1 mol/L的盐酸分别水解底物质量浓度为30 mg/mL的右旋糖酐T20、T80、T500、T2000,底物与酸按体积比1∶1加入,于90 ℃反应。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.4.3 盐酸浓度对右旋糖酐降解的影响
分别用浓度为0.5、1、2、4 mol/L的盐酸水解底物质量浓度为30 mg/mL的右旋糖酐T2000,底物与酸按体积比1∶1加入,于90 ℃水解反应。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.4.4 底物质量浓度对右旋糖酐降解的影响
用1 mol/L的盐酸水解底物质量浓度分别为10、30、50、70 mg/mL的右旋糖酐T2000,底物与酸按体积比1∶1加入,于90 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.5 酶解右旋糖酐mw和mw/mn的调控
1.3.5.1 酶活力对右旋糖酐降解的影响
将纯化过的右旋糖酐酶用pH 5的醋酸盐缓冲液稀释到酶活力分别为2、4、6、8 U/mL,分别水解底物质量浓度为30 mg/mL的右旋糖酐T2000(pH 5的醋酸盐缓冲液配制)。底物预热10 min,酶液与底物按体积比1∶1加入,于50 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.5.2 温度对右旋糖酐降解的影响
用6 U/mL的右旋糖酐酶水解底物质量浓度为30 mg/mL 的右旋糖酐T2000,右旋糖酐酶与右旋糖酐底物均用pH 5的醋酸盐缓冲液配制。底物预热10 min,酶液与底物按体积比1∶1加入,分别于40、45、50、55 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.5.3 pH值对右旋糖酐降解的影响
用6 U/mL的右旋糖酐酶水解底物质量浓度为30 mg/mL 的右旋糖酐T2000,右旋糖酐酶与右旋糖酐底物分别用pH值为4、5、6、7的醋酸盐缓冲液配制。底物预热10 min,酶液与底物按体积比1∶1加入,于50 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.5.4 底物质量浓度对右旋糖酐降解的影响
用6 U/mL的右旋糖酐酶分别水解底物质量浓度为10、30、50、70 mg/mL的右旋糖酐T2000,右旋糖酐酶与右旋糖酐底物均用pH 5的醋酸盐缓冲液配制。底物预热10 min,酶液与底物按体积比1∶1加入,于50 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.5.5 底物分子质量对右旋糖酐降解的影响
用6 U/mL的右旋糖酐酶分别水解底物质量浓度为30 mg/mL的右旋糖酐T20、T80、T500、T2000,右旋糖酐酶与右旋糖酐底物均用pH 5的醋酸盐缓冲液配制。底物预热10 min,酶液与底物按体积比1∶1加入,于50 ℃水解。间隔数分钟取样,进行右旋糖酐mw和mw/mn的测定。
1.3.6 右旋糖酐水解产物分析
1.3.6.1 产物处理
采用酸解法和酶解法分别降解右旋糖酐T2000,都调控到mw为40 kDa左右。将得到的右旋糖酐溶液加入到数倍体积的无水乙醇中,得到乳白色的悬浮液,静置24 h使其自然沉淀,将沉淀冷冻干燥得到右旋糖酐固体,将其于研钵中研成粉末以供进行红外光谱和氯离子残留的分析。
1.3.6.2 最终水解产物分析
右旋糖酐最终水解产物用高效液相色谱进行分析,80%乙腈作为流动相。葡萄糖、异麦芽糖和异麦芽三糖被用作标准品。水解数小时至反应不再进行,水解产物用流动相稀释10 倍,11 000×g离心20 min。上清液用0.22 μm的针头过滤器过滤,并通过高效液相色谱分析。其中使用Polaris NH2柱(4.6 mm×250 nm),柱温35 ℃、流速1.0 mL/min,用RID-10A折射率检测器进行检测。
1.3.6.3 红外光谱分析
采用傅里叶红外光谱仪对1.3.6.1节得到的右旋糖酐产品主要官能团进行分析,确定降解之后右旋糖酐结构是否发生改变,标准品采用右旋糖酐T40(mw≈40 kDa)。将溴化钾研磨成粉末,将右旋糖酐与溴化钾按照质量比1∶200进行混合压片,以溴化钾空白作为背景进行校准,仪器条件为:扫描波长范围400~4 000 cm-1,分辨率4 cm-1。进行右旋糖酐标准品与样品的检测。
1.3.6.4 氯化物残留分析
采用能谱进行右旋糖酐氯离子浓度检测,样品为1.3.6.1节制得,标准品为右旋糖酐T40。制样方法52:将导电胶固定在铝片上,取少量右旋糖酐于导电胶上,用洗耳球吹去未黏附的样品,进行喷铂处理。采用扫描电镜和能谱进行氯离子残留的测定。
1.4 数据处理
右旋糖酐的mw、mw/mn等数据都是通过十八角度激光光散射仪配有ASTRA 7.1.3软件进行图像处理得到;除样品色谱图是仪器的峰图外,其余图像皆采用Origin 8.5制作。
2 结果与分析
2.1 右旋糖酐谱图与误差分析

图 1 样品色谱图Fig. 1 Chromatograms of samples
由图1可知,样品示差、激光谱图都呈现对称的正态分布峰,出峰状态良好。采用十八角度激光光散射仪配有的ASTRA 7.1.3软件进行图像处理,出峰时以示差信号为准,收峰时以激光信号为准,得到右旋糖酐的mw与mw/mn。

表 1 右旋糖酐的mw与mw/mn的误差分析Table 1 Error analysis of mw and mw/mn of dextran
由表1可知,十八角度激光光散射仪与凝胶色谱联用测出的右旋糖酐mw与mw/mn误差较小,mw相对误差低于3.281%,mw/mn相对误差小于4.611%。由此可见,此法相对误差较小,测量准确,可以用于右旋糖酐mw与mw/mn的检测。
2.2 酸解右旋糖酐mw和mw/mn的调控
2.2.1 温度对右旋糖酐降解的影响

表 2 温度对右旋糖酐T80降解的影响Table 2 Effect of acid hydrolysis temperature on degradation of dextran T80
右旋糖酐的降解速率可以用mw减小的程度表示,mw减小的越快,右旋糖酐的降解速率越大。由表2可知,温度对盐酸降解右旋糖酐的影响较大,温度越高,降解速率越快。根据表2,将mw为80 kDa的右旋糖酐降解到10 kDa,100 ℃时需要5 min,90 ℃时需要12 min,80 ℃时需要45 min,70 ℃时降解到30 kDa需要60 min;温度越高右旋糖酐降解越快,得到设定mw的时间越短,对反应越有利,但是温度太高,反应过快,mw难以调控。为较快并且较好的调控得到设定mw的右旋糖酐,选择90 ℃作为酸解反应温度较为合理。随着右旋糖酐mw的降低,mw/mn逐渐减小,mw低于10 kDa时,mw/mn基本小于2。
2.2.2 底物分子质量对右旋糖酐降解的影响
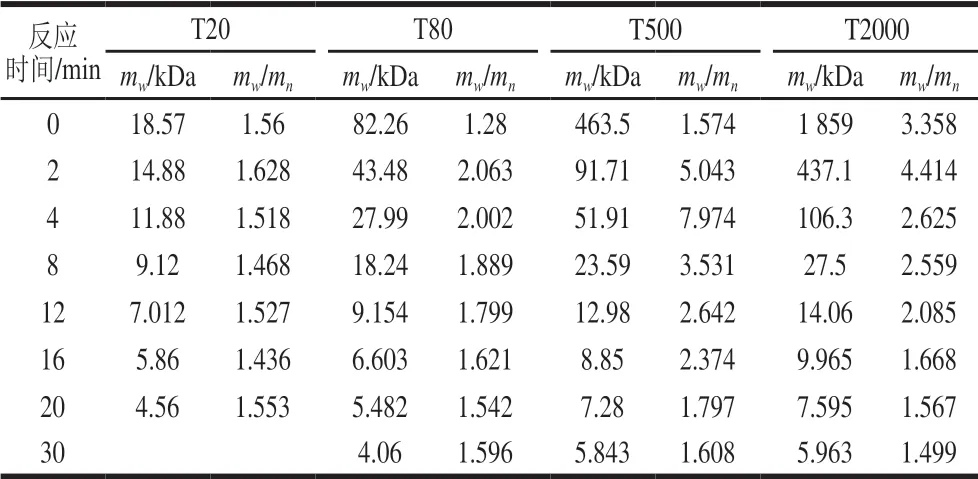
表 3 不同mw右旋糖酐的降解情况Table 3 Degradation efficiencies of dextran with different molecular masses
底物mw越大,盐酸降解速率越快。根据表3可知,相同的时间间隔降解速率为:T2000>T500>T80>T20。当右旋糖酐的mw为100~1 000 kDa时,右旋糖酐的mw/mn值比较大,因为降解初期溶液中含有各种分子质量的右旋糖酐,此时右旋糖酐均一性较差;随着反应的进行,右旋糖酐的均一性逐渐良好,mw/mn变小。如表3所示,酸解右旋糖酐T2000,mw为437.1 kDa时,mw/mn为4.414;当mw降低为9.965 kDa时,mw/mn减小为1.668。
2.2.3 盐酸浓度对右旋糖酐降解的影响

表 4 盐酸浓度对右旋糖酐T2000降解的影响Table 4 Effect of hydrochloric acid concentration on degradation of dextran T2000
由表4可知,盐酸浓度越大,降解速率越快。采用2 mol/L和4 mol/L的盐酸降解右旋糖酐T2000,经过8 min和2 min就可右旋糖酐mw降解到10 kDa以下;而采用盐酸浓度为1 mol/L和0.5 mol/L的盐酸,将右旋糖酐T2000降解到10 kDa需要16 min和30 min以上。盐酸浓度越大,得到设定mw的右旋糖酐时间越短,但反应速率太快,mw难以进行调控。为较快并且较好调控得到设定mw的右旋糖酐,选择1 mol/L的盐酸较为合理。
2.2.4 底物质量浓度对右旋糖酐降解的影响

表 5 底物质量浓度对右旋糖酐T2000降解的影响Table 5 Effect of substrate concentration on degradation of dextran T2000
由表5可知,1 mol/L的盐酸降解右旋糖酐T2000时,降解速率随着底物质量浓度的增大先增高后降低,底物质量浓度为30 mg/mL时,降解速率最快。反应温度为90 ℃,温度较高,在一定的底物质量浓度范围之内,黏度并不影响底物与酸之间的接触和反应,当底物质量浓度为10 mg/mL时,对于酸来说底物处于不饱和状态,反应速率较慢,因此降解速率低于底物质量浓度为30 mg/mL 的降解速率。底物质量浓度达到30 mg/mL之后,随着底物继续提高,溶液的黏度增大,黏度开始影响底物与酸之间的接触,底物与酸的接触和作用不充分,反应速率变慢;所以底物质量浓度越大,溶液黏度越高,越不利于反应的进行,不同底物质量浓度的右旋糖酐T2000反应速率为30 mg/mL>50 mg/mL>70 mg/mL。
2.3 酶解右旋糖酐mw和mw/mn的调控
2.3.1 右旋糖酐酶活力对右旋糖酐降解的影响
由表6可知,随着右旋糖酐酶活力的增加,右旋糖酐降解速率增大[27]。根据表6,当酶活力分别为2、4、6、8 U/mL时,水解8 min得到的右旋糖酐的mw分别为720.6 、242.3,、83.69、24.38 kDa。当酶活力为2、4 U/mL时,水解速率较慢,而酶活力为8 U/mL时,降解速率较快,mw难以调控,因此选择6 U/mL的酶液进行酶解反应。当右旋糖酐mw为100~1 000 kDa时,右旋糖酐的mw/mn值比较大,因为降解初期含有各种mw的右旋糖酐,随着反应的进行,右旋糖酐的mw逐渐均一,mw/mn变小。如表6所示,当酶活力2 U/mL、右旋糖酐mw为720.6 kDa时,mw/mn为4.524,mw降低为51.16 kDa时,mw/mn减小为1.966。酶解过程中mw/mn随mw的变化与酸解过程相似。

表 6 酶活力对右旋糖酐T2000降解的影响Table 6 Effect of dextranase activity on degradation of dextran T2000
2.3.2 温度对右旋糖酐降解的影响

表 7 温度对右旋糖酐T2000降解的影响Table 7 Effect of enzymatic hydrolyisis temperature on degradation of dextran T2000
由表7可知,在右旋糖酐酶可以耐受的温度下,温度越高,右旋糖酐的降解速率越快,可能是由于较高的反应温度降低了右旋糖酐的黏度,有利于底物与酶分子的有效接触[28]。右旋糖酐酶具有温度敏感性,温度过高,酶易失活。根据表7,当温度为55 ℃时,50~60 min mw由6.816 kDa减小为6.32 kDa;而50 ℃时,50~60 min mw由7.156 kDa减小为6.262 kDa,由此可见高温虽有利于反应但却易使酶失活。综合考虑,50 ℃作为酶解较适反应温度。
2.3.3 pH值对右旋糖酐降解的影响
由表8可知,右旋糖酐的降解速率随着pH值的升高先增大后减小,pH 5是反应较适pH值。pH 4~6比较有利于降解反应的进行,pH 7不利于反应进行,将右旋糖酐T2000降解到20 kDa,pH 7时需要50 min以上,而pH 4~6时仅需要20 min左右。

表 8 pH值对右旋糖酐T2000降解的影响Table 8 Effect of pH on degradation of dextran T2000
2.3.4 底物质量浓度对右旋糖酐降解的影响
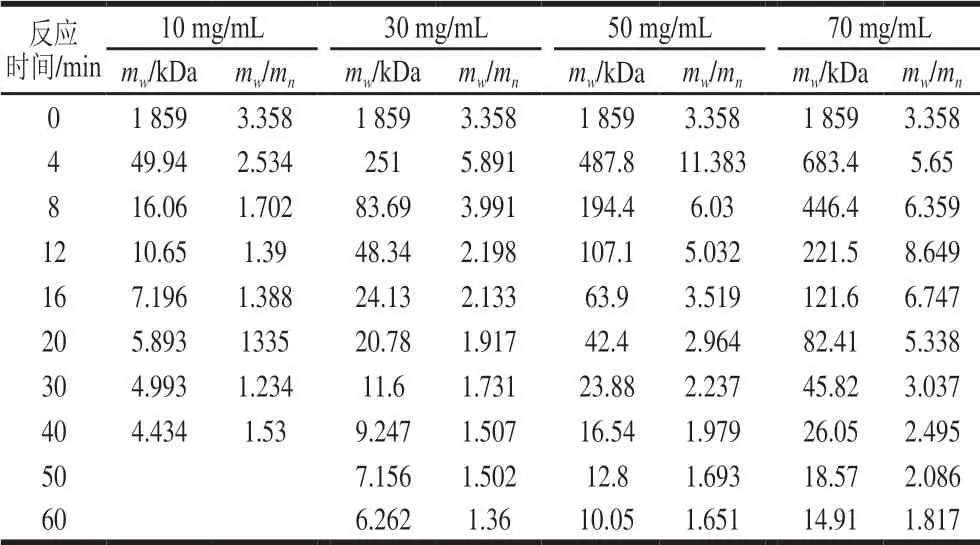
表 9 底物质量浓度对右旋糖酐T2000降解的影响Table 9 Effect of substrate concentration on degradation of dextran T2000
右旋糖酐的降解速率随着右旋糖酐质量浓度的增加而降低。底物质量浓度越小,溶液黏度越小,越有利于反应液之间的充分接触,反应越快。如表9所示,当右旋糖酐质量浓度分别为10、30、50、70 mg/mL 时,水解16 min后得到的右旋糖酐mw分别为7.196、24.13 、63.9、121.6 kDa。由表6~9可知,右旋糖酐酶降解右旋糖酐是有效的,通过控制右旋糖酐酶活力、温度、pH值、底物质量浓度以及反应时间,可以获得特定mw的右旋糖酐[29-30]。
2.3.5 底物mw对右旋糖酐降解的影响
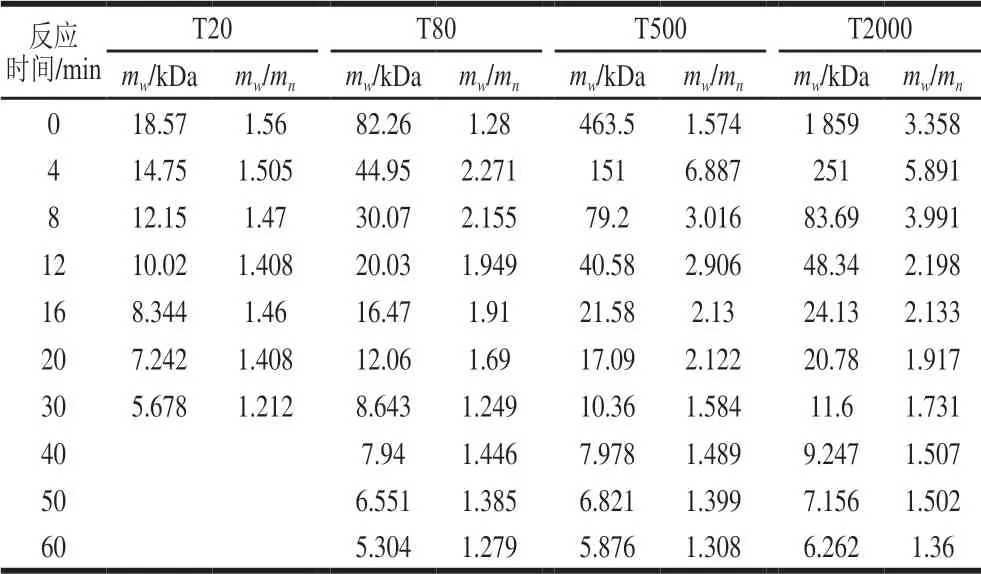
表 10 不同mw右旋糖酐的降解情况Table 10 Degradation efficiencies of dextran with different molecular masses
由表10可知,右旋糖酐酶对不同mw右旋糖酐的降解速率不同,底物mw越大,反应速率越快,说明右旋糖酐酶对mw大的右旋糖酐亲和力更强,这与盐酸相同。右旋糖酐酶对右旋糖酐的降解,最初4 min的mw下降速率比其后相同间隔更快,这也表明圆弧青霉右旋糖酐酶对更高mw的右旋糖酐具有更好的亲和力[29]。
2.4 酸解与酶解产物的比较
2.4.1 最终水解产物分析

图 2 标准品、酸解最终产物和酶解最终产物峰图Fig. 2 Chromatographic peaks of standards and final products of acid hydrolysis and enzymatic hydrolysis
由图2可知,葡萄糖、异麦芽糖和异麦芽三糖标准品的出峰时间分别为6.6、10.4 min和17.4 min。酸解最终产物只有葡萄糖;酶解最终产物为异麦芽糖、异麦芽三糖和少量葡萄糖,这与其他真菌来源的大多数内切型的右旋糖酐酶水解的最终产物相同[3,31]。由此可知,盐酸催化右旋糖酐中α-1,6糖苷键的任意位点,最终产物可降至单糖。圆弧青霉右旋糖酐酶为内切型的右旋糖酐酶,可从非还原端的任意位点催化右旋糖酐的α-1,6糖苷键,所以最终产物主要为异麦芽糖和异麦芽三糖,不可能完全降至单糖。从最终产物也可以看出,酶解反应是有选择性的水解右旋糖酐[31],而酸解反应是完全随机的。
2.4.2 红外光谱分析
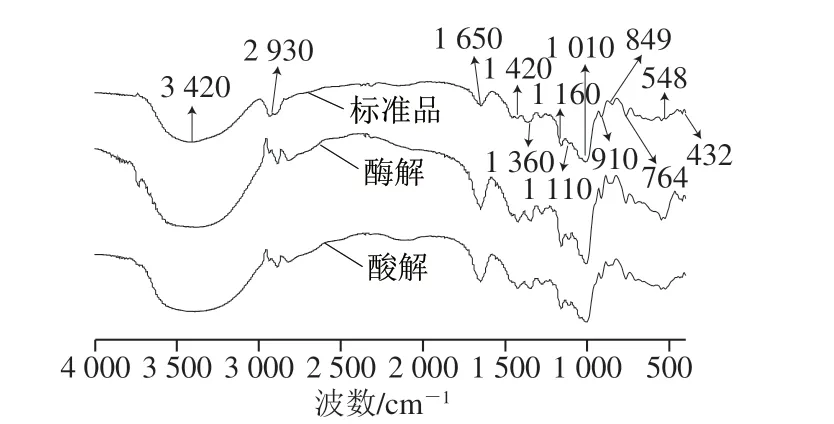
图 3 酸解和酶解产物与右旋糖酐标准品的红外光谱图Fig. 3 Infrared spectra of acid hydrolysis and enzymatic hydrolysis products and dextran standard
对图3标准品进行分析,在3 420 cm-1处有较宽且强烈的峰是O—H伸缩振动引起的;在2 930 cm-1和1 420 cm-1的弱峰是C—H伸缩振动引起的;在1 650 cm-1处的峰可能与水分子有关;1 200~1 000 cm-1范围的吸收峰是多糖的特征峰,可以根据该范围具有的专一性的谱峰位置和强度判断为某一特定多糖;在1 160 cm-1处的吸收峰是糖环的C—O—C的伸缩振动;在912 cm-1处的吸收峰是因为吡喃环的非对称伸缩振动,在849 cm-1的吸收峰是α-异头碳伸缩振动的结果[32];在1 010 cm-1处的强烈吸收峰说明含有大量的α-1,6糖苷键。综上所述,该多糖的构型是含有α-吡喃糖苷键和α-1,6糖苷键,此糖为右旋糖酐。如图3所示,酸解产物和酶解产物红外光谱谱图与标准品谱图基本一致,说明降解过程中只是分子质量变化,结构没有发生变化。
2.4.3 氯化物残留物分析

表 11 右旋糖酐中的各种元素含量的测定Table 11 Percentage contents of various elements in dextran
由表11可知,与标准品相比,酸解产物含有高达5.89%氯元素和3.90%钠元素,《中国药典》[33]对氯化物含量要求不超过0.25%,酸解产物氯离子含量远高于药典要求,氯离子的残留在临床应用中极易起过敏反应,如果要进行应用需要再进行复杂的复溶透析等处理;酶解产物与标准品相比只含有0.55%的钠元素和0.82%硫元素,不含氯离子,无需再进行进一步除氯离子的处理。
3 结 论
酶解法和酸解法都可调控右旋糖酐的分子质量,mw/mn都在合理的范围,产物均一性均较好。酸解反应最适温度为90 ℃左右,酶解反应最适温度为50 ℃左右,酸解反应比酶解反应消耗更多的能量;酸解反应最适盐酸浓度为1 mol/L左右,酶解反应最适pH值为5左右,酸解法与酶解法相比需要消耗大量的酸与碱;酸解反应最适底物质量浓度为30 mg/mL左右,而酶解反应底物质量浓度越低,降解速率越快,在降解过程中可根据具体情况选择合适的底物质量浓度;酸解反应和酶解反应都是对高mw的右旋糖酐亲和力更强;酶解反应右旋糖酐酶液酶活力越高,降解速率越快。酸解法最终产物为葡萄糖,酸解反应是完全随机的;酶解法最终产物为异麦芽糖、异麦芽三糖和少量葡萄糖,酶解反应遵从一定的内在规律。相比于酸解法,酶解法反应条件温和,无需耗费酸碱,能耗低,污染小,无氯离子残留,是一种低能耗、高品质的中低mw右旋糖酐的生产方法。
