鸡蛋中卵白蛋白和溶菌酶相互作用对其 结构和致敏性的影响
2020-04-02汪吴晶陈红兵高金燕
汪吴晶,佟 平,陈红兵,高金燕
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
鸡蛋含有丰富的蛋白质,是人体摄入蛋白质的重要来源之一,在我国的产量位居世界第一。但我国鸡蛋的主要销售形式是未经过消毒、分级、保鲜处理就直接进入市场的鲜蛋[1],我国蛋制品深加工产业起步晚,规模小,但是市场潜力巨大,前景广阔[2]。
目前,液态蛋产品主要包括液态蛋清、蛋黄和全蛋液3 种。在食品生产加工中具有使用方便、产品均一等优点,并且可以有效解决运输过程中蛋壳易破碎等问题[3]。但是液态蛋产品也存在易被污染等风险,因此需要对其进行充分杀菌。常采用巴氏杀菌法对液态蛋进行杀菌处理[4],巴氏杀菌的温度一般在60 ℃左右,该温度可能会对鸡蛋中的热敏性组分产生较大的影响[5],从而影响鸡蛋的起泡性、乳化性等功能性质[6]。蛋白质的结构在热处理过程中会发生变化,而结构变化往往会影响蛋白质的功能性质[7];蛋白质相互作用也会对蛋白质的结构产生影响。为了解蛋清蛋白在热处理中结构的变化,有必要阐明蛋白质分子间的相互作用,然而蛋清含有数百种蛋白质,成分复杂,多种蛋白质的相互作用无法明确进行分析,所以本实验选择了蛋清中卵白蛋白和溶菌酶2 种重要蛋白进行研究,期待为进一步探索提供工作基础。
卵白蛋白(ovalbumin,OVA)是蛋清中的主要蛋白质,占蛋清蛋白的54%,等电点为4.5,由385 个氨基酸组成,是一种磷糖球蛋白,分子质量为44.5 kDa,包含约3%的糖基组分[8],被作为一种模式蛋白广泛用于蛋白质的结构、性质及食物过敏模型的研究[9]。溶菌酶(lysozyme,Lys)占蛋清蛋白的3.4%,是由129 个氨基酸组成的单链多肽,分子质量为14.3 kDa[10],等电点为10.7,易与其他酸性蛋白发生静电作用。卵白蛋白和溶菌酶作为鸡蛋蛋白常见过敏原,加热能够改变过敏原蛋白的结构,暴露或隐藏过敏原表位,从而使其致敏性发生变化[11],所以在加热以及蛋白质相互作用后是否会对致敏性产生影响也值得探究。
本研究采用离子交换层析方法分离纯化出OVA和Lys,在不同的加热条件下对OVA、Lys及OVA-Lys混合物进行处理,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对蛋白质分子质量进行表征,用浊度、溶解度对蛋白质物理性质进行分析,通过圆二色光谱、紫外光谱、荧光光谱表征热加工对蛋白质结构的影响,并通过酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)研究相互作用后的蛋白质致敏性的变化。旨在确定不同温度处理下(25、60、65、70 ℃)OVA和Lys相互作用对其结构和致敏性的影响,为开展后续工作提供依据。
1 材料与方法
1.1 材料与试剂
白壳鸡蛋 市购;牛血清蛋白标准品 生工生物工程(上海)股份有限公司;HRP标记羊抗兔IgG、亲和素标记的羊抗人IgE二抗 美国Sigma公司;HRP标记的链霉亲和素 欣博盛生物科技有限公司;抗鸡蛋过敏原Lys兔多克隆抗体 美国奥维亚系统生物公司;抗鸡蛋过敏原OVA兔多克隆抗体为实验室自制;其他常规试剂均为分析纯。
1.2 仪器与设备
蛋白垂直电泳仪、Model680酶标仪、凝胶成像系统 美国Bio-Rad公司;恒温水浴锅 德国Kottermann公司;J-810型圆二色光谱仪 日本分光公司;TU-1901紫外-可见分光光度计 北京普析通用仪器有限公司;F-4500型荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 鸡蛋主要过敏原的分离纯化及热加工处理
将鸡蛋洗净后分离蛋清蛋黄并去除系带,取100 mL蛋清用2 倍Tris-HCl稀释后,在4 ℃缓慢搅拌3 h,离心除去沉淀后经DEAE-Sepharose Fast Flow阴离子交换柱分离卵白蛋白和溶菌酶,具体方法见参考文献[12]。利用SDS-PAGE对分离所得的OVA和Lys进行分析,如图1所示。经quantity one软件对电泳图进行分析,OVA和Lys的纯度均达到98%以上。
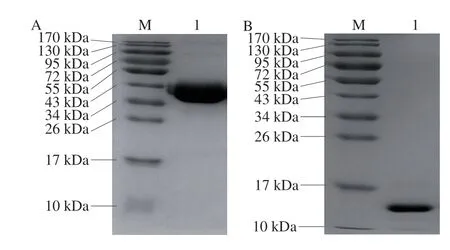
图 1 纯化的鸡蛋蛋白SDS-PAGE图Fig. 1 SDS-PAGE pattern of purified egg white proteins
将纯化的卵白蛋白和溶菌酶用0.01 mol/L的磷酸缓冲盐溶液(phosphate buffer saline,PBS)稀释,使卵白蛋白的质量浓度为1.588 mg/mL,溶菌酶的质量浓度为0.1 mg/mL(蛋清中卵白蛋白-溶菌酶质量比为54∶3.4),使终体积为1 mL,以单个蛋白(卵白蛋白质量浓度1.588 mg/mL,溶菌酶0.1 mg/mL)作为对照。混匀后在60、65、70 ℃水浴加热10 min后用冰水浴终止反应,以25 ℃加热的蛋白作为对照。
1.3.2 SDS-PAGE
参考常雪娇等[13]的方法采用SDS-PAGE对分离所得蛋白以及热处理后的蛋白进行分析检测,样品与上样缓冲液1∶1(V/V)混合后,取10 μL加入聚丙烯酰胺凝胶胶孔内(采用分离胶12%,浓缩胶5%),电流参数为12 mA、30 min和24 mA、90 min。电泳结束后,经考马斯亮蓝显色、脱色后进行凝胶成像。
1.3.3 溶解度和浊度的测定
采用BCA试剂盒测定可溶性蛋白质含量,将不同温度条件处理下的OVA、Lys、OVA-Lys在4 ℃、10 000×g离心20 min后取上清液进行测定[14]。以牛血清蛋白作为标准蛋白,用于绘制标准曲线,从而计算出蛋白质含量,见式(1):

式中:S为溶解度/%;P1为离心后各温度条件下上清液中蛋白质含量;P0为上清液中蛋白质的总量。
浊度测定参照Wu Li等[15]方法,将不同温度条件处理下的OVA、Lys、OVA-Lys于600 nm波长处测定蛋白溶液的透过率T(%),并采用超纯水作为空白对照。浊度计算见式(2):

1.3.4 蛋白质的结构分析
1.3.4.1 紫外-可见分光光谱分析
将不同温度条件处理下的OVA、Lys、OVA-Lys样品用0.01 mol/L的PBS稀释至0.1 mg/mL。采用TU-1901双束紫外-可见分光光度计分析热处理前后蛋白质复合物与单体的三级结构的变化。波长扫描范围为250~350 nm,波长间隔为1.0 nm,光谱带宽为2.0 nm,光径为1 cm,响应时间为0.2 s。
1.3.4.2 圆二色光谱分析
采用MOS-450圆二色光谱分析热处理前后蛋白质复合物与单体的二级结构变化,样品质量浓度为 0.1 mg/mL。远紫外波长扫描范围为190~240 nm,扫描速率为100 nm/min,光径为0.1 cm,带宽0.1 nm。并通过网站对数据进行分析处理,结果以平均摩尔椭圆 率(deg·cm2/dmol)表示[16]。线上分析网址为http://dichroweb.cryst.bbk.ac.uk/html/process.shtml。
1.3.4.3 外源性荧光光谱分析
采用ANS荧光探针法,检测不同温度条件处理下的OVA、Lys、OVA-Lys表面疏水性差异,样品质量浓度为0.1 mg/mL。在4 mL样品中加入40 μL ANS溶液避光反应1 h后检测荧光强度,激发波长为390 nm,扫描范围为400~650 nm,扫描速率为1 200 nm/min,狭缝宽度为5.0 nm,光径为1 cm,响应时间为0.5 s。
1.3.5 竞争ELISA检测蛋白质潜在致敏性
参考Meng Xuanyi等[17]的方法采用竞争抑制ELISA方法监测OVA、Lys、OVA-Lys对兔多克隆抗体IgG的结合能力,并做如下改动:检测Lys对OVA的免疫原性的影响时,采用1 μg/mL的未处理的OVA进行包被,用不同温度处理后的OVA、OVA-Lys作为竞争蛋白,一抗使用卵白蛋白致敏的兔血清(1∶20 000,V/V),二抗使用HRP标记羊抗兔IgG(1∶5 000,V/V);检测OVA对Lys的免疫原性的影响时,Lys的包被质量浓度为20 μg/mL,用不同温度处理后的Lys、OVA-Lys作为竞争蛋白,一抗使用溶菌酶致敏的兔血清(1∶5 000,V/V),二抗使用HRP标记羊抗兔IgG(1∶5 000,V/V),并通过式(3)进行计算:
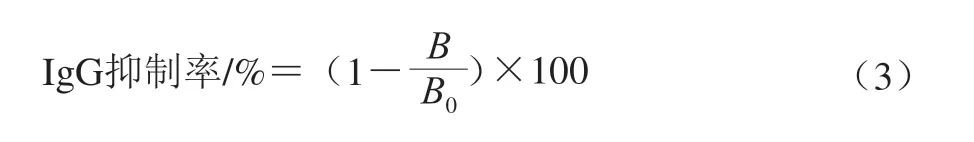
式中:B为有竞争蛋白对应的OD值;B0为无竞争蛋白对应的OD值。
采用竞争抑制ELISA方法对不同温度处理后的OVA、Lys、OVA-Lys的致敏原性进行评估。检测Lys对OVA致敏原性的影响时,采用3.2 μg/mL的OVA进行包被,用不同温度处理后的OVA、Lys、OVA-Lys作为竞争蛋白,过敏患者血清池(一抗)的稀释倍数为 1∶2 0(V/V),二抗使用生物素标记的羊抗人I g E(1∶5 000);检测OVA对Lys的致敏原性的影响时,采用1 μg/mL的Lys进行包被,用不同温度处理后的OVA、Lys、OVA-Lys作为竞争蛋白。并通过式(4)进行计算:

式中:B为有竞争蛋白对应的OD值;B0为无竞争蛋白对应的OD值。
当包被蛋白相同时,测得的OD值越大表明竞争蛋白残余的IgE结合量越多,即竞争蛋白的抗原性越弱,所以B0-B数值越大,表明竞争蛋白的结合能力越强。以此评估OVA、Lys、OVA-Lys三者的致敏原性。
1.4 数据分析
采用Origin Pro 9.0软件对数据进行作图;并采用IBM SPSS Statistics 22.0对数据进行显著性分析,P<0.05,差显著异。
2 结果与分析
2.1 OVA、Lys、OVA-Lys的溶解度和浊度变化
利用BCA试剂盒对不同温度处理下的OVA、Lys、OVA-Lys的溶解度进行分析,如图2A所示。OVA在70 ℃加热后溶解度有显著性降低,但仍在90%以上,可能形成了极少量不溶性聚合物,在60、65 ℃加热下溶解度无显著性变化。Lys单体在60、65 ℃与常温相比溶解度无显著性变化,说明较低温度加热没有使溶菌酶产生不溶性聚合物,而70 ℃加热后溶解度显著性降低,热处理可以引起蛋白分子结构的展开同时也会导致分子表面带电氨基酸重新排布,使蛋白表面电荷发生改变,对亲水性/疏水性平衡产生影响,从而导致溶解性降低[18]。 OVA-Lys在60、65 ℃混合加热后溶解度有下降的趋势,但与单体加热相比溶解度未呈现显著性变化,说明OVA和Lys混合物加热溶解度下降的主要原因是受温度影响,但在70 ℃溶解度与单体相比显著降低,降为84%,说明在70 ℃条件下OVA和Lys会形成部分不溶性聚合物。
对不同温度处理下的OVA、Lys、OVA-Lys的浑浊程度进行分析,如图2B所示。OVA和Lys单体随着温度的升高浊度呈上升趋势,且在70 ℃加热与常温相比均有显著性变化,说明70 ℃加热能使其形成了少量聚合物。OVA-Lys在60、65 ℃条件下混合加热后浊度有上升的趋势,但与单体加热相比浊度未呈现显著性变化,说明OVA和Lys混合物加热浊度上升主要是受温度影响,而两者并未发生明显的作用使浑浊程度增大。但在70 ℃条件下浊度与单体相比显著升高,说明在此温度下OVA和Lys能相互作用形成了大分子聚合物。浊度和溶解度的变化可以初步判断OVA和Lys能在70 ℃条件下发生较明显的相互作用导致物理性质的改变。且对比浊度变化结果,随着浊度的上升,可溶性蛋白含量下降,说明在热处理过程中蛋白质溶液中由于不溶性沉淀的形成可以造成蛋白溶液浊度的上升[19]。
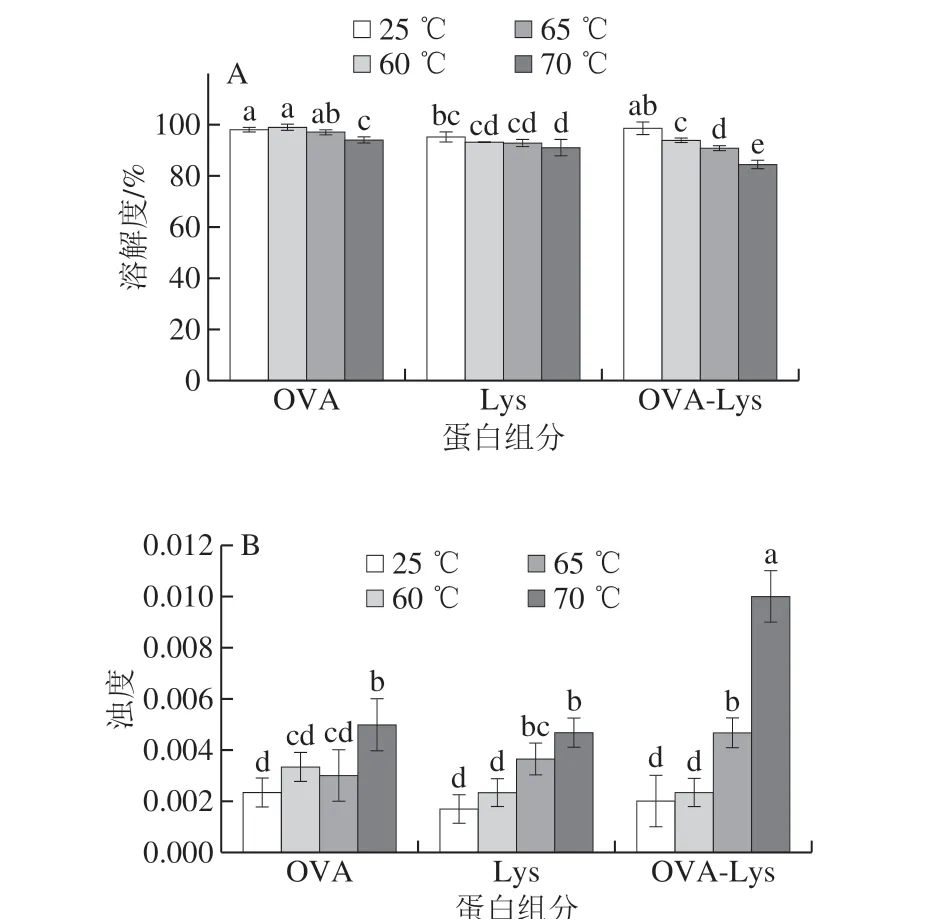
图 2 不同温度下蛋白质的溶解度(A)和浊度(B)变化Fig. 2 Soluble protein concentration (A) and turbidity (B) of protein solutions heated at different temperatures
2.2 OVA、Lys、OVA-Lys的还原型和非还原型SDS-PAGE
利用还原型和非还原型SDS-PAGE对不同温度处理下的蛋白质样品进行分析如图3所示。对于OVA单体而言,非还原状态下有较多的OVA的二聚体,在还原状态下二聚体基本消失,说明OVA可以通过二硫键结合形成二聚体,而温度对卵白蛋白单体的影响不大。对于Lys单体而言,在各温度下还原和非还原条带类似,说明温度对其分子质量影响不大。对于OVA-Lys的混合物而言,25、60、65 ℃条件下的蛋白样品条带基本一致,且是单体OVA和单体Lys条带的叠加,但在70 ℃条件下,非还原型SDS-PAGE中的Lys条带消失,且泳道口有少量聚集物,而在还原型电泳中Lys条带仍然清晰可见,说明在70 ℃时Lys会与OVA结合,并且是通过二硫键结合。
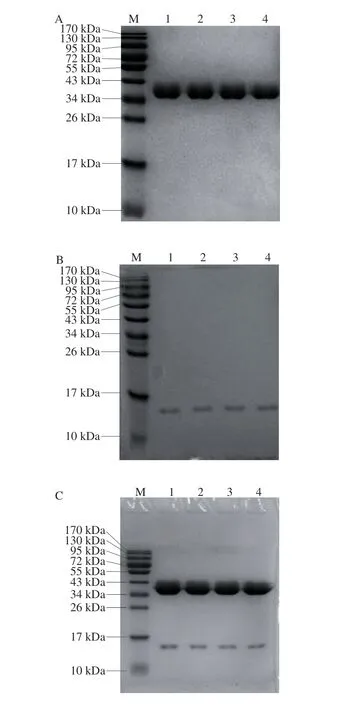
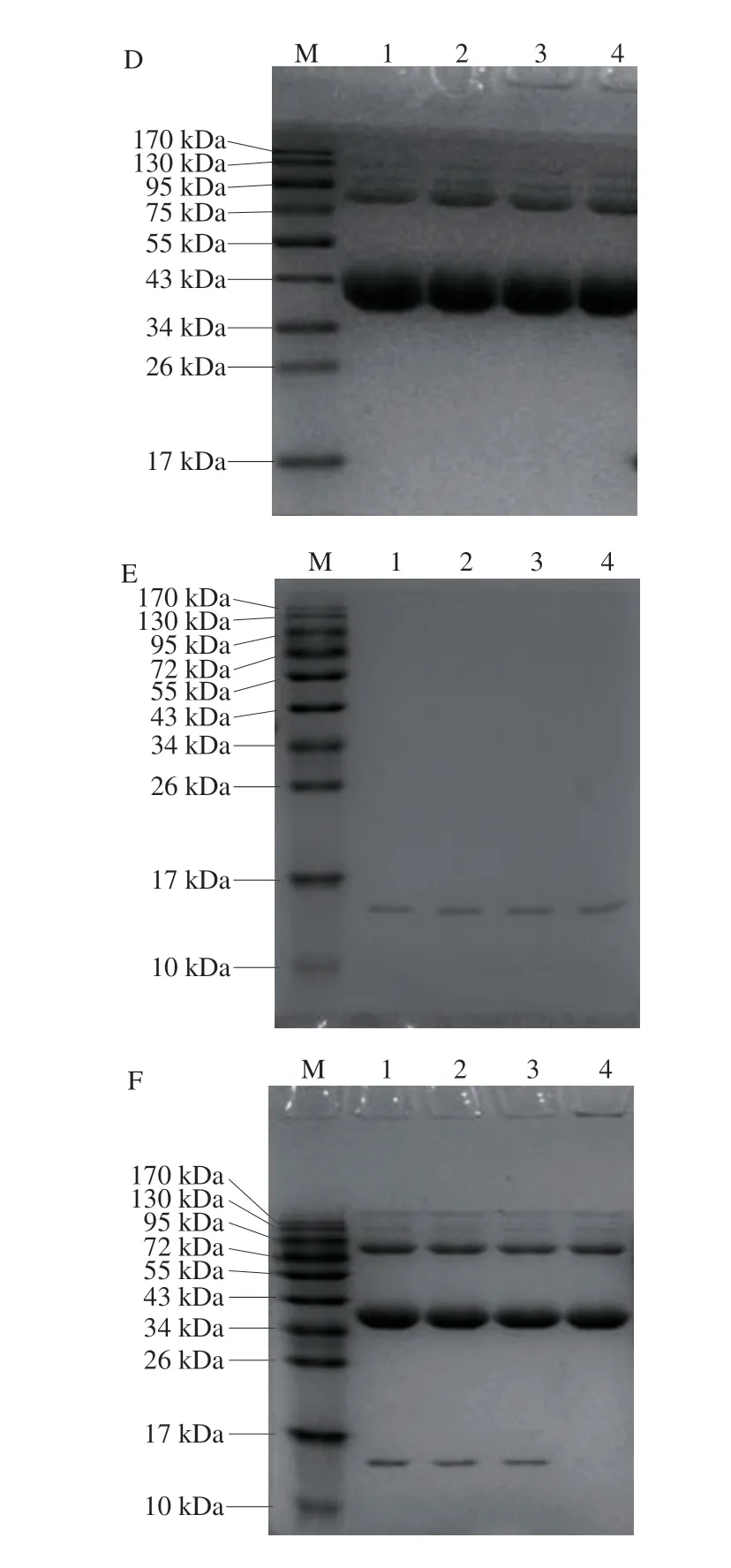
图 3 蛋白质的还原型和非还原型SDS-PAGEFig. 3 SDS-PAGE analysis of reduced and non-reduced proteins
2.3 OVA、Lys、OVA-Lys的结构分析
蛋白质产生紫外吸收光谱主要是由于色氨酸和酪氨酸残基侧链对紫外光的吸收,其次是苯丙氨酸、组氨酸和半胱氨酸残基侧链基团对紫外光的吸收[20],通过对紫 外-可见光谱的测定可以反映蛋白质的芳香族氨基酸极性是否发生改变。对不同温度处理下的OVA、Lys、OVA-Lys 的三级结构进行分析如图4所示。OVA在25、60、65 ℃条件下图谱基本相同,说明在此温度下卵白蛋白单独加热三级结构未发生明显变化,而在70 ℃条件下最大吸收光谱明显增大,说明在70 ℃条件下蛋白质展开程度变大。Lys在25、60、65、70 ℃条件下图谱基本相同,说明在此温度下Lys单独加热三级结构未发生明显变化。OVA-Lys混合物在25、60、65 ℃条件下的图谱基本一致,说明OVA-Lys混合物在此温度下结构发生明显变化,但在70 ℃条件下加热10 min后图谱有轻微的蓝移,说明OVA-Lys的芳香族氨基酸残基的微环境极性发生改变,蓝移说明残基移向亲水的环境[21];另一方面OVA-Lys 的最大吸收峰较单体而言明显增强,可能是由于OVA和Lys在70 ℃相互作用后蛋白的展开程度进一步变大,从而导致色氨酸和酪氨酸残基暴露在蛋白质分子表面[22]。
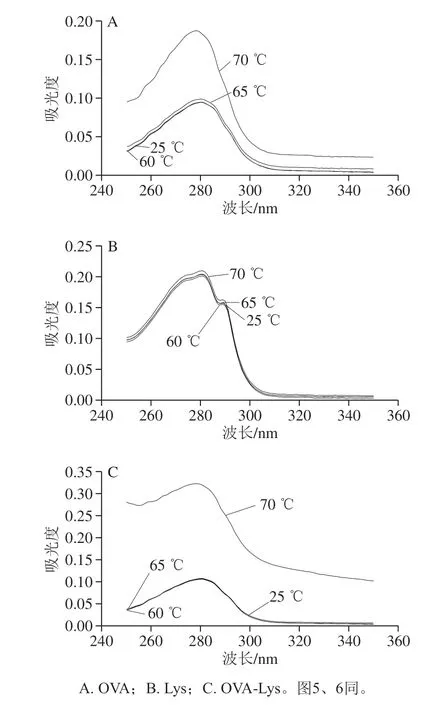
图 4 不同温度处理下蛋白质的紫外-可见光谱Fig. 4 UV absorption spectra of protein solutions heated at different temperatures
在190 nm波长附近有一个正峰,222、208 nm波长处呈负峰,是典型的α-螺旋结构;在185~200 nm波长处有一强的正峰,216 nm波长处有一个负峰,是β-折叠的结构[22]。由图5可知,OVA和Lys都具有典型的α-螺旋和β-折叠结构。对蛋白的二级结构进行分析,与未加热OVA 相比,60、65、70 ℃加热后的OVA β-转角均有显著性提高,但只有在70 ℃加热的OVA无规卷曲含量显著增大,说明70 ℃条件下OVA分子逐渐由有序变得无序。与未加热Lys 相比,70 ℃加热后的Lys无规卷曲含量显著增大,说明Lys分子在70 ℃条件下由有序变得无序,而其他温度下无明显变化。OVA-Lys在加热后α-螺旋、β-折叠、β-转角含量无显著性变化,但在70 ℃无规卷曲程度变大,说明在70 ℃条件下分子向无序方向发展。
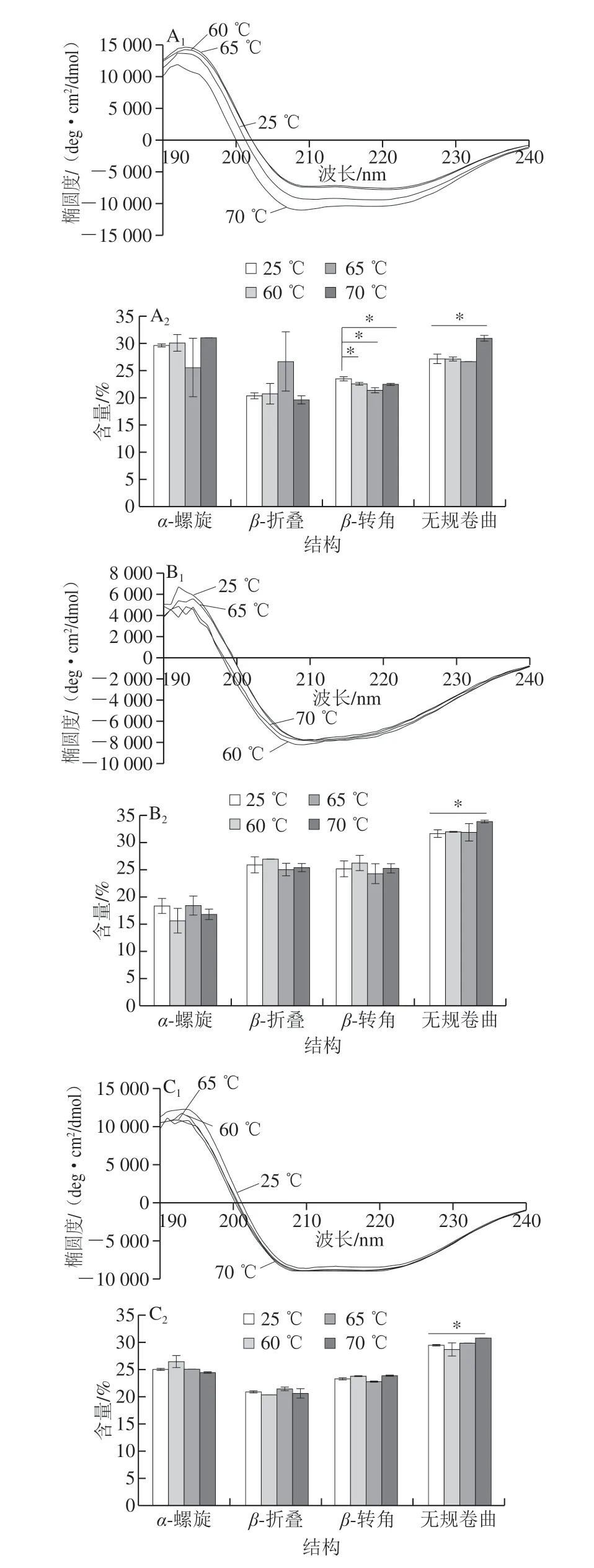
图 5 不同温度处理下蛋白质的圆二色光谱图Fig. 5 CD spectra of protein solutions heated at different temperatures
疏水基团的相互作用是维持蛋白质三级结构最重要的作用力之一,ANS与蛋白质结合的荧光强度与蛋白质的表面疏水性呈正相关[7],利用外源性荧光光谱对不同温度处理下的OVA、Lys、OVA-Lys的疏水性进行分析如图6所示。OVA单体随着温度的变化其荧光强度变化不大只有轻微上升。Lys单体随着温度的升高,荧光强度少量增加,且在70 ℃条件下荧光强度最大,说明其随着温度升高疏水性变大,且70 ℃条件下疏水性最大。OVA-Lys混合物在60 ℃条件下荧光强度无明显变化,65 ℃加热后荧光强度有少量增加,70 ℃条件下荧光强度增加幅度较大,说明OVA-Lys在65、70 ℃加热后疏水性增大。但OVA-Lys在65 ℃条件下与单体的形状类似,而70 ℃条件下OVA-Lys荧光强度较单体有较明显的上升,说明OVALys在65 ℃条件下荧光强度变大可能只是因为温度的影响,而70 ℃条件下OVA-Lys荧光强度上升不仅受到温度的影响,同时两者能相互作用促使疏水基团暴露。
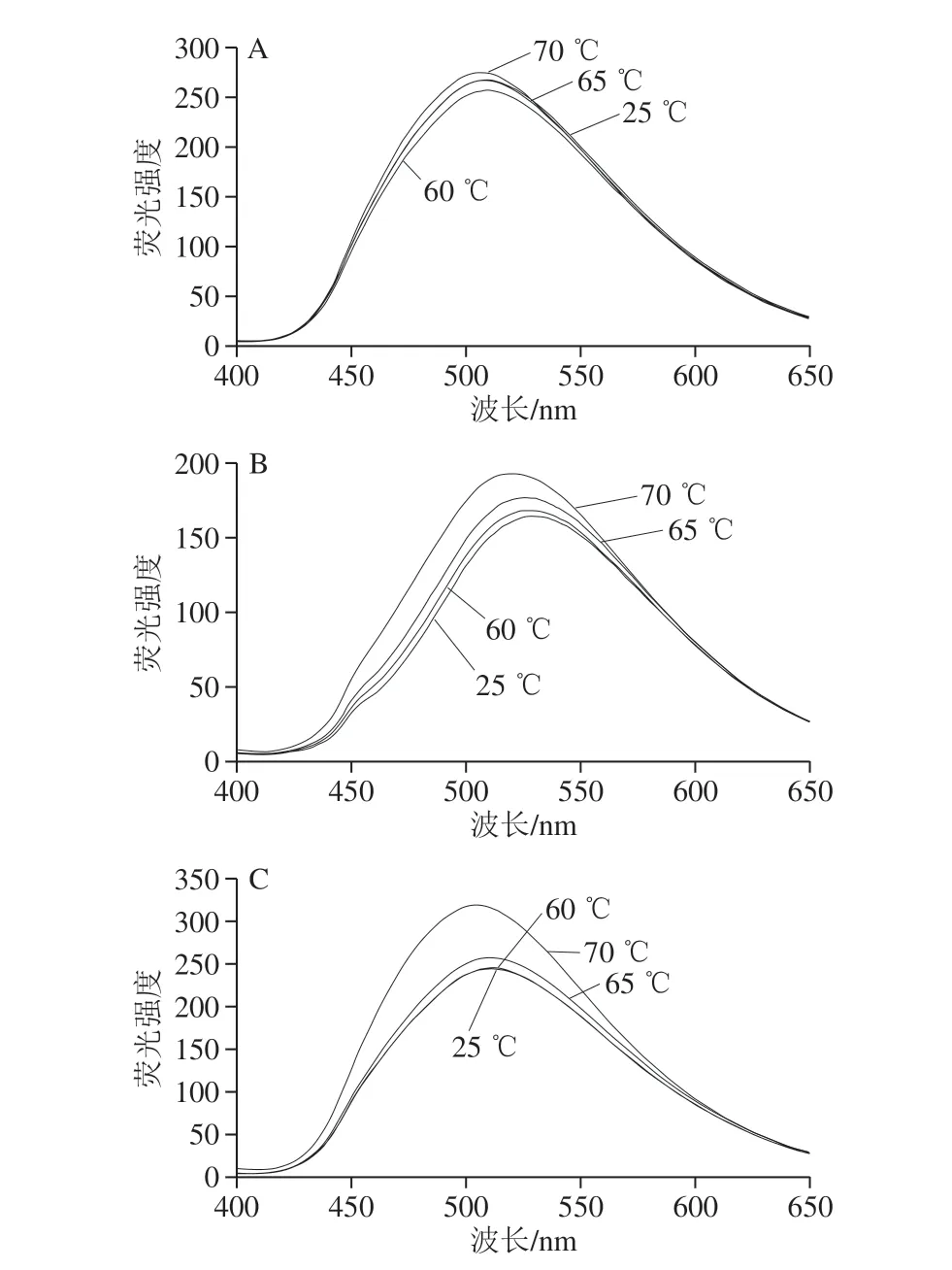
图 6 不同温度处理下蛋白质的外源性荧光光谱Fig. 6 ANS Fluorescence spectra of protein solutions heated at different temperatures
2.4 OVA、Lys、OVA-Lys的免疫原性
利用竞争ELISA对不同温度处理下的OVA、Lys对OVA、Lys、OVA对Lys的免疫原性进行分析如图7所示。OVA、Lys单体随着温度的升高免疫原性显著降低,说明加热能破坏OVA、Lys的IgG结合位点。对于复合物而言,随着温度的升高OVA-Lys的免疫原性有显著性降低,且温度越高复合物的免疫原性越低,但由图7A可知,60、65 ℃条件下OVA-Lys复合物与OVA单体相比,其免疫原性并没有显著降低(P>0.05),说明在60、65 ℃条件下OVA与Lys相互作用后并没有降低OVA的免疫原性。在70 ℃条件下OVA-Lys复合物较OVA单体而言,其免疫原性显著降低(P>0.05),说明OVA与Lys在70 ℃条件下相互作用可以降低OVA的免疫原性。类似地,由图7B可知,60、65 ℃条件下OVA与Lys相互作用后也没有降低Lys的免疫原性,70 ℃条件下OVA与Lys相互作用可以降低Lys的免疫原性,说明OVA和Lys在70 ℃相互作用后能相互影响蛋白的免疫原性,说明其相互作用的位点可能在IgG结合位点上。

图 7 不同温度处理下蛋白质的免疫原性Fig. 7 IgG Binding ability of protein solutions heated at different temperatures
2.5 OVA、Lys、OVA-Lys的致敏原性
利用竞争ELISA对不同温度处理下的OVA单体、Lys单体、OVA-Lys的致敏原性进行分析,结果如图8所示。图8A显示,OVA单体在70 ℃加热10 min后致敏原性显著降低(P<0.05),说明70 ℃加热能破坏OVA的IgE结合位点,而60、65 ℃对OVA的致敏原性没有显著影响 (P>0.05)。图8B显示,Lys单体在加热的情况下致敏原性无明显变化,说明加热并没有显著影响Lys的致敏原性(P>0.05)。与25 ℃相比较,由图8C、D可知,65、70 ℃条件下OVA-Lys复合物的致敏原性呈下降趋势,说明较高温度热处理能降低OVA-Lys的致敏原性;60、65 ℃条件下OVA-Lys复合物与单体相比,其致敏原性并没有显著降低,说明在此温度下OVA与Lys相互作用后并没有降低OVA或Lys的致敏原性。但在70 ℃条件下,与单体相比,OVA-Lys复合物的致敏原性显著降低,说明OVA与Lys在70 ℃条件下相互作用可以影响对方的潜在致敏性。

图 8 不同温度处理下蛋白质的致敏原性Fig. 8 IgE binding ability of protein solutions heated at different temperatures
3 讨 论
溶菌酶等电点为10.7,含有4 个二硫键。因此,它易与其他酸性蛋白质发生静电作用,如卵白蛋白[23]、卵转铁蛋白[24]等。卵白蛋白是蛋清中的主要蛋白质,等电点为4.5,含有1 个二硫键和4 个自由巯基,二硫键位于Cys 73和Cys 120之间,自由巯基均位于蛋白质分子的内部疏水核心中[25],Iwashita等[26]表明加热后的OVA能使自由巯基暴露,从而与Lys通过可逆的非共价键以及不可逆的二硫键进行结合,但未从结构方面进行深入的解释。本研究从蛋白质结构方面对OVA和Lys相互作用进行了分析,结果表明70 ℃热处理可以导致OVA三级结构展开,无规卷曲程度变大,分子由有序结构向无序方向发展,从而导致OVA和Lys之间的巯基相互反应产生二硫键,形成不溶性聚合物,导致溶液变浑浊,而且还原型和非还原型电泳图也证明了该结果。因此,OVA和Lys在70 ℃条件下能通过二硫键相互作用。在60、65 ℃条件处理下,OVA和Lys的三级结构并没有展开,只有轻微的二级结构变化。因此,无法通过二硫键进行结合。另一方面,由于在生理pH值下,Lys带正电荷,而OVA带负电荷,所以两者可以自发地通过静电相互作用进行反应[27],且温度越高,反应程度越大。所以OVA和Lys能在70 ℃发生显著的相互作用主要是因为OVA在70 ℃条件下结构展开,疏水基团暴露,从而会与Lys通过静电相互作用以及二硫键相互作用进行结合。
Golias等[28]已证实70 ℃条件下加热可以引起OVA的二级结构变化,能够改变其消化性和抗原表位的构象,最终导致其致敏性的降低。Jiménez-Saiz等[29]模拟巴氏灭菌条件,在65 ℃对OVA加热30 min,结果表明,热处理可以降低OVA与过敏患者血清致敏原性以及和兔血清免疫原性。本研究在25、60、65、70 ℃对蛋白质水浴加热10 min,选取10 min进行处理主要是因为各国对蛋清巴氏杀菌的时间并没有统一的标准,而10 min完全满足巴氏杀菌的要求。研究发现OVA在60 ℃和65 ℃加热条件下致敏原性并没有明显变化,可能是因为在较低的温度以及较短时间内OVA结构并没有展开,抗原性没有明显变化;而70 ℃条件下分子结构展开,疏水基团暴露,可能使部分过敏原表位被掩埋或破坏,所以致敏性有所降低。吴庆栎等[30]研究发现,加热温度超过110 ℃时,Lys的IgE的结合能力显著降低,蛋白的免疫原性降低,在100 ℃以下加热对Lys的致敏原性影响不大,该结果与本研究结果类似。而Lys在热加工处理后免疫原性有所降低,说明随着Lys疏水基团的暴露,其IgG结合位点可能被掩埋或被破坏。而致敏原性并没有显著变化,说明其在疏水基团暴露的情况下IgE结合位点可能并没有暴露、掩埋或破坏。
OVA单独加热时,70 ℃条件下无规卷曲程度变大,三级结构展开,疏水基团暴露,免疫原性降低,潜在致敏性降低,而在60、65 ℃条件下变化不大。Lys单独加热时,随着温度的升高无规卷曲程度变大,且疏水基团有所暴露,免疫原性随着温度升高而降低,但潜在致敏性无明显变化。OVA在70 ℃条件下结构展开,疏水基团暴露,从而会与Lys通过静电相互作用以及二硫键相互作用进行结合,使其浊度显著增加,溶解度显著降低。而且在70 ℃条件下由于OVA和Lys相互作用可以使OVA的免疫原性和致敏原性显著降低,同时也能使Lys的免疫原性和致敏原性显著降低,说明两者在70 ℃条件下能相互作用的位点可能在致敏表位上,从而使蛋白质的潜在致敏性得到有效的降低。而60、65 ℃条件下两者相互作用不明显。
4 结 论
OVA-Lys在60、65 ℃条件下加热10 min后不会显著影响彼此的结构以及潜在致敏性,而在70 ℃条件下,由于OVA的三级结构的展开,Lys疏水基团的暴露,两者会通过二硫键相互作用从而显著降低彼此的潜在致敏性。蛋清蛋白质的相互作用会影响蛋白质的结构,从而对蛋白质的致敏性产生影响,而结构的变化也会影响到蛋白质的其他功能性质,所以通过了解蛋清中主要蛋白质的相互作用可以为蛋清蛋白在热处理过程中功能性质的变化提供一定的理论基础。未来也将进一步关注蛋清蛋白的其他组合,从而更详细地了解在巴氏杀菌过程以及其他热加工过程中蛋白质系统的品质变化。
