平贝母多糖铁配合物的合成、结构特征及 抗氧化活性
2020-04-02徐少博王宇亮赵芷萌孟繁玲
张 曼,张 宇,,徐少博,赵 宏,王宇亮,赵芷萌,孟繁玲
(1.黑龙江省新药创制与药效毒理评价重点实验室,佳木斯大学药学院,黑龙江 佳木斯 154007;2.黑龙江省第二医院,黑龙江 哈尔滨 150010)
平贝母(Fritillaria ussuriensisMaxim.)又名坪贝、北贝、东北贝母、灯笼花,为百合科平贝母的干燥鳞茎[1-2]。 我国野生平贝母主要分布于东北地区长白山脉和小兴安岭南部山区,海拔1 000 m以下的湿润山脚坡地阔叶林带及河谷两岸[3]。研究表明,平贝母中含有多糖类、生物碱类、核苷类、皂苷类等多种有效成分[4-7]。多糖是药用植物最重要的活性成分之一,具有抗氧化、抗衰老、降血糖等生物活性[8-10]。
在人体生命活动中,氧化反应是参与体内代谢过程的重要环节,氧作为最终电子受体,与未成对电子结合时就产生了自由基,自由基对人体的损伤主要有3 个方面:破坏细胞膜、血清抗蛋白酶失活、受损基因导致细胞突变率增加[11]。研究表明,人体内多种疾病的发生都与氧化损伤存在很大关系,随着年龄的增长,机体对自由基的清除能力逐渐下降,从而导致机体 衰老[12]。近年来国内外学者研究发现,多糖作为安全性高、无毒副作用新型的天然抗氧化剂的同时,亦可作为重要的大分子载体,与Fe3+络合后形成稳定的铁配合物,这类配合物具有显著增强的抗氧化活性[13]。王明等[14]研究发现,枸杞多糖铁的抗氧化能力显著高于枸杞多糖。万真真等[15]研究表明,大豆多糖铁配合物不仅溶解性增强,还可以提高清除亚硝酸盐自由基和抑制脂质过氧化的能力。迄今为止,对平贝母多糖(F. ussuriensis polysaccharide,FUP)的研究主要集中于提取分离[16]等方面,关于其多糖铁配合物的研究鲜见报道。
因此,本实验以FUP为原料,与三氯化铁络合形成FUP铁配合物(FUP-Fe),采用紫外-可见光谱、红外光谱、X-射线粉末衍射、扫描电镜、热重-差热分析等对FUP及FUP-Fe的结构进行表征和分析,并对FUP及其铁配合物清除1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)自由基、超氧阴离子自由基、羟自由基的能力进行研究,为FUP抗氧化剂开发利用提供参考。
1 材料与方法
1.1 材料与试剂
平贝母于2018年9月购自哈药集团世一堂中药饮片有限责任公司,产品批号:1705005s。
透析袋(截留分子质量3 500 Da) 上海源叶生物科技有限公司;柠檬酸三钠、三氯化铁、氢氧化钠、邻苯三酚、水杨酸(均为分析纯) 阿拉丁生化科技股份有限公司;无水乙醇、石油醚、三氯甲烷、正丁醇、硫酸亚铁、过氧化氢均为国产分析纯。
1.2 仪器与设备
DL-5-B低速多管离心机 上海安亭科学仪器厂;FA2004N型电子天平 上海舜宇恒平科学仪器有限公司; HH-2数显恒温水浴锅 苏州威尔实验用品有限公司;FDU-1200型冷冻干燥机 日本东京理化株式会社; RE-2000A旋转蒸发器 上海亚荣生化仪器厂;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;GBC10紫外-可见分光光度计 澳大利亚GBC科学仪器公司;AVATAR380傅里叶变换红外光谱仪 美国热电尼高力仪器公司;Rigaku MiniFlex600粉末衍射仪 日本理学 公司;Phenom ProX扫描电镜 荷兰飞纳公司;TGS-1B热重分析仪 瑞士梅特勒-托利多仪器公司。
1.3 方法
1.3.1 FUP的提取与脱蛋白
取平贝母药材,经机械粉碎后,过80 目筛得粗粉,经石油醚回流脱脂5 h,在25 ℃抽滤并在挥干溶剂后,得到脱脂后的平贝母粉。称取脱脂后的平贝母粉50.0 g,加入500 mL双蒸水80 ℃浸提3 h,在此条件下加热提取2 次,过8 层纱布合并2 次水提取液,减压浓缩,加入5 倍体积的无水乙醇,使乙醇溶液体积分数达到85%,静置24 h,离心(25 ℃、4 000 r/min、15 min)收集沉淀,45 ℃真空干燥,即得FUP。配制10%的FUP溶液,加入1/4体积的Sevag试剂(三氯甲烷-正丁醇,4∶1,V/V)充分振荡20 min,离心(25 ℃、4 000 r/min、15 min),保留上清液,透析48 h,重复上述操作5 次[17]。
1.3.2 FUP-Fe的制备
称取1.0 g脱蛋白后的FUP,溶于100 mL双蒸水中,不断搅拌使多糖充分溶解,加入柠檬酸三钠0.5 g,80 ℃油浴下,缓慢滴加2 mol/L FeCl3溶液,并用20% NaOH溶液调节溶液pH值为8.5,当反应溶液中生成棕红色沉淀时,立即停止滴加NaOH和FeCl3溶液,80 ℃条件下维持搅拌1.5 h(pH 8.5),待反应完成后离心(25 ℃、4 000 r/min、15 min),取上层溶液,加入5 倍体积的无水乙醇,得到红棕色沉淀,45 ℃真空干燥后,即得FUP-Fe[18]。
1.3.3 FUP及FUP-Fe理化性质测定
1.3.3.1 定性鉴别
参照文献[19]中Fe3+的鉴别方法,进行定性鉴别实验。
1.3.3.2 紫外-可见光谱分析
分别配制0.1 mg/mL的FUP和FUP-Fe的多糖溶液,以双蒸水作为空白,用紫外-可见分光光度计进行扫描检测,波长范围为200~800 nm。
1.3.3.3 红外光谱分析
取脱蛋白FUP与FUP-Fe各2 mg,按1∶1比例与KBr混合压片,使用红外光谱仪在4 000~400 cm-1范围内进行光谱扫描[20]。
1.3.3.4 X-射线粉末衍射分析
将样品铺在样品板上,用载玻片压实后,置于X-射线粉末衍射仪中,采用石墨单色化Cu-Kα辐射(λ=0.154 nm),2θ测试范围为5°~50°,扫描速 率为6°/min[21]。
1.3.3.5 扫描电镜和能谱分析
将样品粉末铺到导电胶上,并用洗耳球将没有黏在导电胶上的样品吹掉,将导电胶置于样品台中,在加速电压为15 kV的扫描电子显微镜中进行测试,分析其形貌特征和相应的能谱[22]。
1.3.3.6 热重-差热分析
分别称取10.0 mg的FUP和FUP-Fe,以N2为保护气,流量50 mL/min,温度由室温升至700 ℃,升温速率为10 ℃/min,进行热重和差热分析。以温度为X轴,以质量损失率为Y轴,绘制热重分析曲线;以温度为X轴,以温度差为Y轴,绘制差热分析曲线[23]。
1.3.4 体外抗氧化测定
1.3.4.1 DPPH自由基清除能力的测定
参照文献[24]的方法。精密称取0.8 mg DPPH溶于20 mL无水乙醇中,即配制质量浓度为0.04 mg/mL DPPH-乙醇溶液。分别移取6 组不同质量浓度(0.1、0.5、1.0、2.0、4.0、8.0 mg/mL)的FUP溶液和FUP-Fe溶液70 μL,再加入180 μL DPPH溶液,于27 ℃避光反应5 min,在517 nm波长处测定吸光度。以不含多糖样品的DPPH溶液为空白对照组,以同质量浓度VC溶液作为阳性对照组。按式(1)计算DPPH自由基清除率:

式中:Ao为空白对照溶液的吸光度;Ai为加入样品后吸光度。
1.3.4.2 超氧阴离子自由基的清除活性测定
在文献[25]的方法基础上,略作修改。配制6 组不同质量浓度的多糖溶液(0.1、0.5、1.0、2.0、4.0、8.0 mg/mL), 取0.2 mL FUP溶液和FUP-Fe溶液,向其加入3 mL 0.05 mL/L Tris-HCl缓冲液(pH 8.2)于试管中,涡旋混匀15 s,25 ℃反应10 min,在此温度下,加入12 μL 30 mmol/L邻苯三酚溶液反应4 min,在320 nm波长处测定吸光度。用双蒸水调零,以同质量浓度VC溶液作为阳性对照组。按式(2)计算超氧阴离子自由基清除率:

式中:Ao为空白对照溶液的吸光度;Ai为加入样品后的吸光度;Ab为Tris-HCl缓冲液的吸光度。
1.3.4.3 羟自由基清除能力的测定
参照文献[26]的方法进行测定。在试管中分别加入不同质量浓度的(0.1、0.2、0.4、0.8、1.6、 3.2 mg/mL)FUP溶液和FUP-Fe溶液1 mL,依次加入7.5 mol/L硫酸亚铁溶液1.5 mL,8 mmol/L水杨酸-乙醇溶液3 mL,7.5 mmol/L过氧化氢溶液3 mL,涡旋混合1 min,37 ℃反应45 min,在510 nm波长处测定吸光度。用双蒸水调零,以同质量浓度VC溶液作为阳性对照组。清除率计算同式(1)。
1.4 数据处理
以上实验所得数据经Origin 9.1软件处理绘图。
2 结果与分析
2.1 FUP提取结果
平贝母经水提醇沉后得到FUP,提取率为4.66%。
2.2 定性鉴别结果
FUP在碱性条件下与Fe3+络合形成FUP-Fe,在此条件下可能生成Fe(OH)3,需要将Fe(OH)3与FUP-Fe溶液进行定性鉴别比较。结果显示,FUP-Fe溶液中并未检测到游离的Fe3+,表明FUP与Fe3+成功络合,定性鉴别结 果见表1。

表 1 FUP-Fe定性鉴别结果Table 1 Qualitative identification of FUP-Fe complex
2.3 紫外-可见光谱分析结果

图 1 FUP和FUP-Fe紫外扫描图谱Fig. 1 UV-Vis absorption spectra of FUP and FUP-Fe complex
由图1可知,通过紫外分光光度计200~800 nm进行全谱扫描,在波长260 nm和280 nm处未观察到任何吸收峰,说明FUP和FUP-Fe不含有核酸、蛋白质等物质,Sevag法将此类物质基本除净[27]。图1显示,FUP-Fe吸收峰明显高于FUP,推测多糖结构中的羟基参与了络合反应。
2.4 红外光谱分析结果
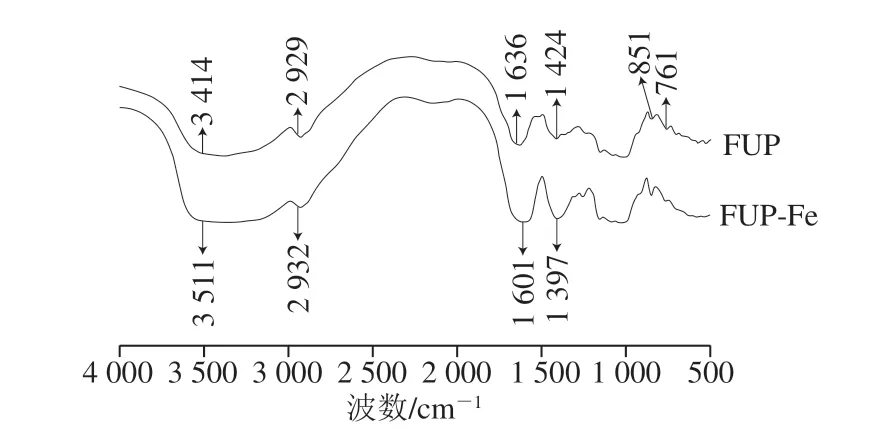
图 2 FUP和FUP-Fe红外图谱Fig. 2 IR spectra of FUP and FUP-Fe complex
由图2可知,FUP中在3 414 cm-1处出现的宽峰是—OH伸缩振动的特征吸收峰。由于多糖分子具有许多羟基,分子内和分子间氢键的形成使其峰值特别宽。在FUP-Fe中此峰向高波数移至3 511 cm-1。FUP中2 929 cm-1为C—H伸缩振动吸收峰,在FUP-Fe中此峰移至2 932 cm-1;FUP中1 636、1 424 cm-1分别为C=O伸缩振动吸收峰和—OH弯曲振动吸收峰;而多糖结构修饰后吸收峰分别向低波数移至1 601、1 397 cm-1, FUP-Fe发生了明显的红移,说明多糖结构中—OH和C=O参与络合反应。FUP结构修饰前后,红外图谱中特殊吸收峰未发生明显变化,说明形成配合物后,多糖基本骨架结构未被破坏。吡喃环结构的C—O吸收峰为1 015 cm-1;α-吡喃环中C—H的变角振动吸收峰为851 cm-1;761 cm-1为D-葡萄糖环的C—O—C振动引起的吸收峰[28]。因此,说明FUP糖链由吡喃糖组成。
2.5 X-射线粉末衍射分析结果

图 3 FUP和FUP-Fe的X-射线粉末衍射图谱Fig. 3 XRD patterns of FUP and FUP-Fe complex
由图3可知,多糖结构修饰前后图谱基本一致,只是峰的强度略有差别,说明形成配合物后,未破坏多糖结构的基本骨架,X-射线粉末衍射分析结果与红外图谱分析结果基本一致。此外,FUP和FUP-Fe没有呈晶体的趋势,属于无定型结构。
2.6 扫描电镜和能谱分析结果

图 4 FUP和FUP-Fe扫描电镜图谱Fig. 4 SEM images of FUP and FUP-Fe complex
图4 显示,从表面形貌看,FUP表面粗糙,裂纹明显,颗粒排列松散,有很多细小空隙,与铁离子配位后,FUP-Fe呈片状,表面光滑,颗粒排列紧密,空隙较少,说明FUP与Fe3+形成了配合物。从均匀程度看,FUP结构修饰前,多糖颗粒大小不均,与Fe3+络合后,配合物多糖颗粒大小比较均一。由图5及表2可知,多糖经修饰后,C、O含量均有降低,Fe相对原子含量约为6.45%。且各元素分布均一,进一步证实了多糖铁配合物的成功制备,形成稳定的FUP-Fe。
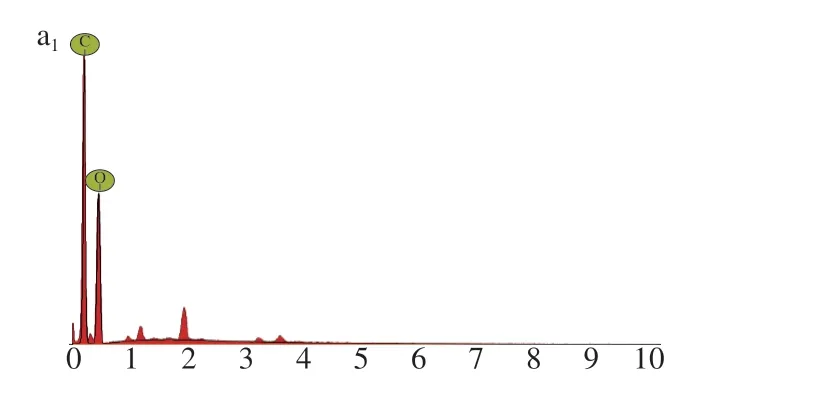

图 5 FUP(a)和FUP-Fe(b)能谱及元素衍射图谱Fig. 5 Energy dispersion spectra and corresponding elemental mappings of FUP (a) and FUP-Fe complex (b)

表 2 FUP和FUP-Fe元素含量Table 2 Element contents of FUP and FUP-Fe complex
2.7 热重-差热分析结果
从图6 A 可以看出,F U P 热分解的第1 阶段为30~170 ℃(质量损失率3.339%),此阶段损失的主要是水,热分解的第2阶段为170~700 ℃(质量损失率48.15%),在170~500 ℃质量损失速度增快,说明此时多糖的化学键被破坏,多糖已被分解。从图6B可以看出,FUP-Fe热分解的第1阶段为30~160 ℃(质量损失率1.192%),此阶段损失的主要是水,热分解的第2阶段为160~700 ℃(质量损失率61.81%),在160~570 ℃质量损失速度增快,说明此时多糖配合物的化学键被破坏,多糖配合物已被分解。比较可知,温度分别为500、570 ℃,质量损失速度减慢,说明FUP-Fe比FUP结构更稳定。从图6可知,在200~600 ℃之间,属于2 种多糖分子结构中的分解反应,消除多糖中的羟基分子降解。FUP经393.6 ℃和441.8 ℃ 2 个吸热反应,683.0 ℃一个放热反应而分解;FUP-Fe经345.7 ℃和552.9 ℃ 2 个吸热反应,583.1 ℃一个放热反应分解[29]。这说明二者多糖结构存在差异,根据吸热分解温度看,多糖稳定性顺序为 FUP-Fe大于FUP。

图 6 FUP(A)和FUP-Fe(B)热重-差热曲线图Fig. 6 TGA-DTA curves of FUP (A) and FUP-Fe complex (B)
2.8 体外抗氧化分析结果


图 7 FUP和FUP-Fe抗氧化能力Fig. 7 Antioxidant capacities of FUP and FUP-Fe complex
由图7A可知,FUP的DPPH自由基清除活性明显低于FUP-Fe的清除活性。随着多糖质量浓度的增加,FUP-Fe对DPPH自由基清除率逐渐增强,当质量浓度为 8 mg/mL时,清除率高达68.96%。质量浓度范围在0~4 mg/mL时,随着FUP质量浓度的增加,清除率也随之增强,在4~8 mg/mL范围内,清除率基本维持在48.46%。这表明FUP-Fe能显著提高对DPPH自由基的清除能力。
由图7B可知,质量浓度在1~8 mg/mL范围内,VC对超氧阴离子自由基的清除效果仍然是最佳,FUP的清除效果最差。在0.5~8 mg/mL范围FUP和FUP-Fe 的清除率随着质量浓度的增加而增强,质量浓度为 8 mg/mL时,达到最大清除率分别为30.58%和57.28%。这表明,Fe3+的引入对超氧阴离子自由基有显著的清除作用。
由图7C可知,不同质量浓度的FUP和FUP-Fe对羟自由基具有的清除作用。总的来说,随着多糖质量浓度的增加,羟自由基的清除率随之增加,有明显的上升趋势。此外,FUP-Fe清除羟自由基的能力远强于FUP,FUP-Fe对羟自由基清除率可高达46.88%。
实验表明,在体外中许多多糖自身具有一定的抗氧化活性,经与Fe3+络合后的多糖,抗氧化能力显著增加,但均低于阳性对照VC对DPPH自由基、超氧阴离子自由基、羟自由基的清除率。景永帅等[30]合成北沙参多糖铁配合物,并对抗氧化活性进行研究,结果表明多糖经铁修饰后,抗氧化活性显著增加,这与本实验结果一致。这可能由于多糖分子结构中有游离的—OH,引入Fe3+后,多糖羟基暴露增加,有利于捕捉自由基,从而增加其抗氧化活性[31]。
3 结 论
多糖中的醇羟基可以与金属离子(如Fe3+)络合,形成稳定的多糖铁配合物,配糖基为Fe3+,不是以游离的铁离子形式存在,可以有效地避免对生物机体的胃肠道功能刺激作用,在机体内代谢还原成Fe2+,提高生物利用度,促进在胃肠道内的消化吸收,毒副作用小。此外,还可以有效地预防治疗缺铁性贫血症。
因此,本研究以FUP为原料,与三氯化铁络合形成FUP-Fe,对FUP结构进行修饰。通过定性实验、紫外-可见光谱、红外光谱、X-射线粉末衍射、扫描电镜、能谱和热重-差热分析等表征手段对FUP及FUP-Fe的理化性质和结构特征进行研究。结果显示,FUP与Fe3+成功络合,形成了稳定的配合物,且其稳定性显著高于FUP的稳定性。进一步对FUP及FUP-Fe的抗氧化能力测定,结果表明,FUP-Fe对DPPH自由基、超氧阴离子自由基和羟自由基有清除作用且均强于FUP。综上所述,FUP经结构修饰后,由于铁离子的引入,可显著提高结构稳定性和抗氧化能力。为FUP-Fe的进一步研究提供了有效的基础,为体内抗氧化活性提供了有效的理论依据。此外,有望开发FUP-Fe为新型保健功能的补铁剂。
