不同形貌的纳米Mg(OH)2催化臭氧化降解甲硝唑
2020-04-01孙琪朱光灿武君吕剑
孙琪,朱光灿,武君,吕剑
(1东南大学能源与环境学院,江苏南京210096;2鲁东大学资源与环境工程学院,山东烟台264025;3中国科学院烟台海岸带研究所,山东烟台264003;4中国科学院青海盐湖研究所,青海西宁810008)
抗生素广泛用于治疗细菌感染和促进人、动物的生长[1],导致抗生素在地表水、地下水、污水处理厂以及饮用水等水环境中被频繁地检测到[2-3]。水体中残留的抗生素由于仍然具有生物活性,会对人体健康以及生物体造成严重的危害。另外,水体中残留的抗生素即使在较低的浓度下也能够诱导细菌产生抗性基因,这些抗性基因通常是持久稳定并且可以迁移至下一代[4]。在广泛使用的抗生素中,甲硝唑是一种常用的硝基咪唑类抗生素,有研究表明,其在水环境中的检出浓度为0.1~90.2μg/L[5]。由于甲硝唑在水中溶解性较高且难降解,通过传统的水处理方法很难去除[6]。目前,水溶液中去除甲硝唑的方法有光降解[3]、芬顿氧化[6]、吸附[7]、纳米零价铁的应用[5]和臭氧化技术[8]等。当使用吸附技术去除甲硝唑时,甲硝唑仅是从一相转移到另一相,并不会实现真正意义上的降解[7]。芬顿氧化需要在酸性环境中进行[6]且光降解受光照的限制[3],这些都限制了它们的实际应用;臭氧化技术虽然具有较高的氧化效率和较短的反应时间,但是受臭氧的溶解度低和选择性高的限制[8]。为了避免单独臭氧化技术的缺点,催化臭氧化技术在水处理过程中已经引起了广泛的关注[9]。在催化臭氧化过程中,通过加入催化剂来提高臭氧自分解的速率和效率,从而将臭氧分子快速分解为选择性低、氧化能力强的羟基自由基[9-10],进而引发自由基链反应使难降解的有毒化合物快速降解。
目前,被用于催化臭氧化过程的各种材料包括碳材料[7]、二氧化硅材料[9]、多孔材料[10]、金属氧化物及氢氧化物[8,11-12]等。在这些材料中,纳米氢氧化镁作为一种环境友好的无机纳米材料,具有无毒、无重金属、热稳定性好、原材料丰富等独特的特点而受到关注。然而,以纳米氢氧化镁为催化剂催化臭氧化降解抗生素的研究很少。我国镁资源丰富,其中察尔汗盐湖是我国的第二大盐湖,长期以来受技术经济条件限制,盐湖开采过程中产生的大量天然水氯镁石因无法得到有效利用而被丢弃,导致宝贵的镁资源浪费。基于此,本文以实验室所用的分析纯六水合氯化镁以及从察尔汗盐湖所取得的废弃水氯镁石为原料制备了不同形貌的纳米Mg(OH)2催化剂,并将其应用于催化臭氧化技术中,研究了该技术对甲硝唑的去除效能并评估了这两种形貌的催化剂的稳定性。该研究将为污水中抗生素的去除提供可靠的氧化方法以及有前景的催化剂,为污水的安全利用提供科学基础和技术保障,具有十分重要的理论意义和实用价值。
1 实验材料和方法
1.1 材料
天然水氯镁石,采自中国青海省察尔汗盐湖;甲硝唑(纯度≥99.0%),上海麦克林生化科技有限公司;六水合氯化镁(MgCl2·6H2O),AR级,国药集团化学试剂有限公司;聚乙二醇400(PEG400),AR 级,国药集团化学试剂有限公司;氨水(NH3·H2O),AR级,国药集团化学试剂有限公司;硫代硫酸钠(Na2S2O3),AR级,国药集团化学试剂有限公司;碘化钾(KI),AR级,国药集团化学试剂有限公司;乙腈(CH3CN),HPLC 级,德国默克;实验用水为去离子水,电阻为18.2MΩ。
1.2 纳米Mg(OH)2催化剂的制备
纳米Mg(OH)2催化剂的制备采用化学沉淀法[13]:将六水合氯化镁溶于去离子水中形成0.5mol/L的氯化镁水溶液。取100mL 的氯化镁水溶液加入10mL表面活性剂PEG400混合,然后将其置于50℃的恒温水浴中,在恒定的磁力搅拌下(1200r/min)将8mL 氨水通过恒压滴液漏斗逐滴加入上述溶液中,形成白色的悬浮液。将悬浮液在50℃下剧烈搅拌1.5h后,冷却到室温,在室温下陈化1.5h后将溶液在4000r/min下离心10min,上清液去掉,将沉淀物用去离子水和乙醇洗涤数次。洗涤后的白色产物在60℃下干燥12h,即可获得纳米Mg(OH)2材料。以氯化镁为原料制得的纳米Mg(OH)2,记为Mg(OH)2-1。用上述同样的方法以察尔汗盐湖的天然水氯镁石为原料制备的纳米Mg(OH)2,记为Mg(OH)2-2。
1.3 纳米Mg(OH)2催化臭氧化降解甲硝唑
催化臭氧化实验采用批实验模式进行。高纯氧气通过臭氧发生器产生臭氧。在整个实验过程中,臭氧流速保持在0.1L/min,产生的臭氧通过玻璃分散器进入反应容器中,从反应容器出来的臭氧用20%的KI 溶液进行吸收。所有的实验都在室温(25±2)℃下进行。在每个臭氧化实验中,在反应器中加入0.15g/L的纳米Mg(OH)2催化剂和初始浓度为50mg/L 的甲硝唑溶液。在反应过程中,每隔1min从反应器中取出5mL 的样品,立即加入200μL 0.025mol/L的硫代硫酸钠溶液以阻止溶液中残余的臭氧进一步反应。所取出的每个样品经0.22μm 的滤膜过滤,滤液用于目标参数的分析。考虑到催化剂吸附作用的影响,在同样的实验条件下进行了吸附实验,在实验过程中将臭氧发生器关闭让干净的氧气进入反应器进行反应。另外,为了达到比较的目的,在同样的实验条件下进行了甲硝唑的单独臭氧化实验。上述实验,每个实验设置三个平行实验。为了探究所合成的两种催化剂的稳定性,将催化臭氧化完成后的催化剂通过离心分离进行收集,收集的催化剂直接用于下一次的催化臭氧化实验,重复使用四次,以评价催化剂的稳定性。
1.4 分析方法
采用日本理学Rigaku D/Max-2400 X 射线衍射仪对所合成的两种样品及天然水氯镁石进行X射线衍 射(XRD) 分 析,CuKα射 线,入 射 波 长 为0.154056nm,扫描步长0.02°,2θ角的扫描范围5°~80°,测试所合成的两种不同的催化剂时扫描速率为6°/min,而在测试天然水氯镁石时扫描速率为1.5°/min。采用美国PerkinElmer 公司Quanta-400F场发射扫描电子显微镜观察样品的表面形貌。采用美国Nicolet IS10 型傅里叶变换红外光谱仪在室温下用KBr压片记录样品的傅里叶红外光谱,测试范围为400~4000cm-1。采用美国Quantachrome公司的Autosorb iQ Station2 物理吸/脱附仪在77K 下测定样品的BET表面积。采用日本岛津公司的TOC-VCPH型总有机碳分析仪测定样品的有机碳。采用梅特勒-托利多国际贸易(上海)有限公司的F2-Standard型pH计测试反应溶液的pH。
在降解过程中反应溶液的甲硝唑浓度使用上海伍丰科学仪器有限公司的EX1600 高效液相色谱仪进行测定。该仪器配备有EX1600 紫外检测器和Waters SunFire C18色谱柱(2.1mm×150mm,3.5μm),使用15%的乙腈和85%的水作为流动相,在30℃下流速为0.2mL/min,进样量为5μL,检测波长为315nm。
2 实验结果与讨论
2.1 天然水氯镁石的表征
为了确定天然水氯镁石的主要成分,对所取得的天然水氯镁石进行了XRD 测试。所获得的XRD图谱首先使用Jade-6 软件进行定性分析,然后使用TOPAS 4.2软件进行精修,对样品的相结构进行定量分析,其定性分析以及定量分析的结果如图1所示。从图中可以看出,天然水氯镁石的主要成分为MgCl2·6H2O,与标准JCPDS 卡片(No.76-0798)对照分析结果一致,空间群为C2/m,各衍射峰比较尖锐,说明结晶度好。
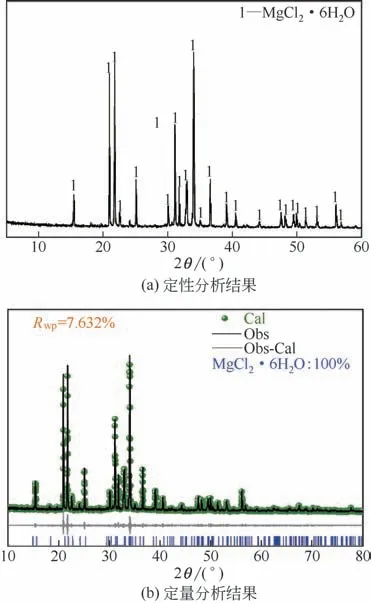
图1 天然水氯镁石的定性及定量分析结果
2.2 纳米Mg(OH)2催化剂的表征
2.2.1 SEM表征
图2 为以不同原料所合成的两种纳米Mg(OH)2催化剂[Mg(OH)2-1 和Mg(OH)2-2] 的扫描电镜(SEM)图。由图2(a)和(b)可以看出,以六水合氯化镁为原料所制得的Mg(OH)2-1催化剂具有大规模的片状形貌,尺寸为50~200nm。另外,此产物的形貌具有良好的均匀性,产率也较高,在图中没有观察到明显的团聚现象,表明所合成的Mg(OH)2-1催化剂具有很好的分散性。由图2(c)和(d)可以看出,以天然水氯镁石为原料所制得的Mg(OH)2-2催化剂为纳米花状,而这些纳米花是由尺寸50~300 nm的纳米片组装而成的。

图2 Mg(OH)2-1和Mg(OH)2-2的SEM图片
2.2.2 XRD表征
通过XRD来表征所合成的两种纳米Mg(OH)2催化剂[Mg(OH)2-1 和Mg(OH)2-2]的组成形态和晶型。图3 为两种纳米Mg(OH)2催化剂[Mg(OH)2-1 和Mg(OH)2-2]的XRD图谱。从图3中可以看出,这两种纳米Mg(OH)2催化剂的组成形态几乎一样。这两种催化剂的衍射面均分别为(001)、(100)、(101)、(102)、(110)、(111)、(103)、(201),与 标 准JCPDS卡片(No.7-239)对照分析结果一致,表明所制备的催化剂为具有六方晶系结构的氢氧化镁。从图3中还可以看出这两种产物的谱图基线平滑,各衍射峰清晰尖锐且强度较高,说明这两种产物的结晶性良好。此外,这两种产物的XRD 谱图中都未检测出其他物相的衍射峰,表明通过上述方法合成的这两种产物纯度高且不含杂质。
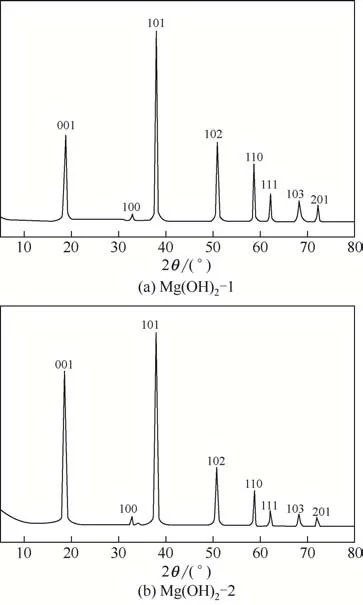
图3 Mg(OH)2-1和Mg(OH)2-2的XRD表征结果
2.2.3 FTIR表征
图4 为两种纳米Mg(OH)2催化剂[Mg(OH)2-1 和Mg(OH)2-2]的傅里叶红外光谱(FTIR)图。从图4中可以看出,这两种纳米Mg(OH)2催化剂在3684cm-1、3701cm-1处有尖锐且强度较高的吸收峰,这是由氢氧化镁晶体结构中O H的伸缩振动形成的[14-15];在3401cm-1、3428cm-1处出现的宽且强度较弱的吸收峰是由物理吸附的水分子表面O H的伸缩振动形成的[11,15];在1627cm-1、1634cm-1附近处出现的弱峰是由 OH 的弯曲振动形成的[11,16];此外,在437cm-1、438cm-1附近处存在的弱吸收峰是由Mg O的伸缩振动形成的[17-18]。结合以上讨论可知,本文成功制得了较纯的两种形貌的纳米Mg(OH)2催化剂,且这两种形貌的纳米Mg(OH)2催化剂表面存在大量的羟基。
2.3 催化臭氧化降解甲硝唑
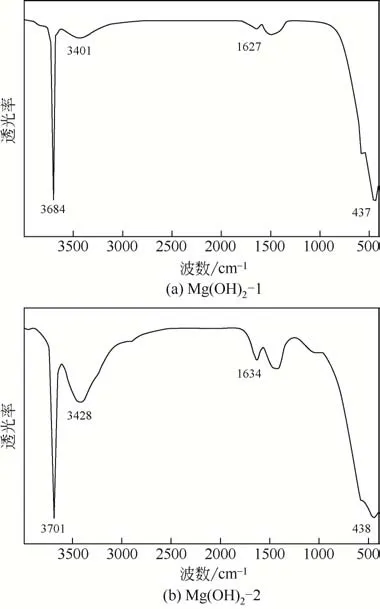
图4 Mg(OH)2-1和Mg(OH)2-2的傅里叶红外光谱图
为了考察不同形貌的纳米Mg(OH)2对有机污染物的降解和矿化能力,选用甲硝唑作为降解的目标污染物,考察了Mg(OH)2-1 和Mg(OH)2-2 的吸附作用、单独臭氧化、Mg(OH)2-1 催化臭氧化以及Mg(OH)2-2催化臭氧化过程对甲硝唑的降解和矿化效率,甲硝唑在不同氧化过程中的降解和矿化趋势如图5所示。从图5中可以看出,不同的过程对甲硝唑的降解和矿化有着不同的去除效率。在单独臭氧化过程中,在10min 内甲硝唑的去除效率仅为51.9%。这表明甲硝唑本身就可以被臭氧分子所氧化,这与先前的报道一致[19]。然而,从图5(b)中可以看出,单独臭氧化对甲硝唑的矿化效果不是很理想,在30min 内,TOC 仅降低了17.4%,这表明甲硝唑被氧化而形成的中间产物很难被进一步地氧化。当两种不同形貌的纳米Mg(OH)2[Mg(OH)2-1 和Mg(OH)2-2]加入到臭氧化系统中,甲硝唑的去除效率和矿化效果均明显提高。当Mg(OH)2-1 和Mg(OH)2-2 加入到臭氧化系统中,在10min 内相应的甲硝唑的去除效率增加为87.8%和92.5%。经过30min的反应,在Mg(OH)2-1的催化臭氧化系统中,TOC 降低了35.9%,这个矿化度是单独臭氧化的2.1倍。当反应时间为30min时,在Mg(OH)2-2的催化臭氧化系统中,TOC降低了40.0%,这个矿化度是单独臭氧化的2.3 倍。这说明这两种不同形貌的纳米Mg(OH)2催化剂与臭氧发生了协同作用,产生了更多的羟基自由基从而提高了氧化效率和矿化度[9]。
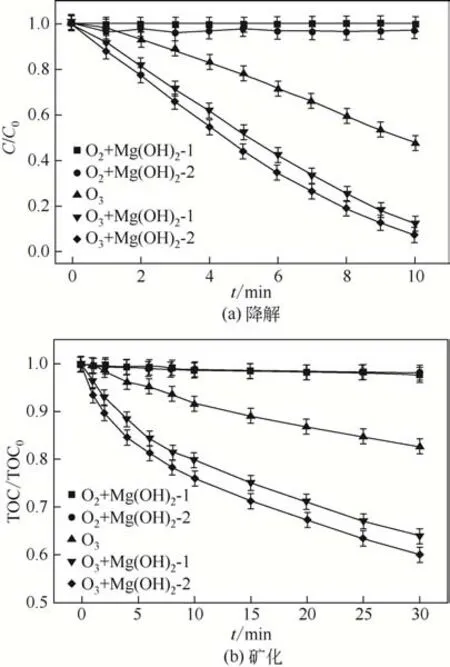
图5 甲硝唑在不同氧化过程中的降解和矿化
为了说明甲硝唑的去除效率在两种不同形貌的纳米Mg(OH)2催化臭氧化过程中提高的原因,研究了甲硝唑在两种不同形貌的纳米Mg(OH)2催化剂上的吸附作用。当反应体系中不通臭氧,只有纳米Mg(OH)2存在时,10min 后甲硝唑在两种不同形貌的纳米Mg(OH)2催化剂上的吸附仅为2%左右,这就表明甲硝唑去除效率的提高主要是由于降解而不是催化剂的吸附。综上所述,这两种纳米Mg(OH)2催化剂有利于甲硝唑的降解,且Mg(OH)2-2的催化臭氧化效果要好于Mg(OH)2-1。
为了更好地阐述这两种纳米Mg(OH)2催化臭氧化去除甲硝唑的性能,使用伪一级动力学模型[式(1)]对甲硝唑的去除动力学进行研究。

式中,C0为甲硝唑在反应溶液中的初始浓度,mg/L;Ct为在反应时间t时甲硝唑在反应溶液中的残留浓度,mg/L;t为反应时间,min;k为伪一级反应速率常数,min-1,通过所拟合的此线性方程的斜率获得。
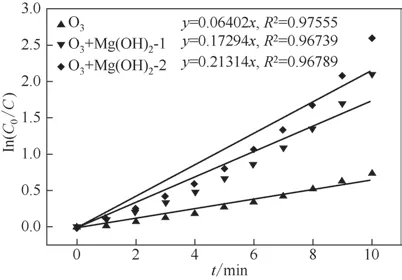
图6 甲硝唑在不同氧化过程中的动力学拟合
甲硝唑在不同氧化过程中的动力学拟合如图6所示。从图6中可以看出,甲硝唑在不同氧化过程中的降解很好地符合伪一级动力学模型(R2>0.97)。甲硝唑在单独臭氧化过程中的去除速率常数为0.064min-1。当Mg(OH)2-1 和Mg(OH)2-2 加入到臭氧化系统中,相应的甲硝唑的去除速率常数从0.064min-1增加到0.173min-1和0.213min-1。这些结果进一步确认了这两种形貌的纳米Mg(OH)2对甲硝唑臭氧化过程强大的催化作用。
为了探究加入这两种形貌的纳米Mg(OH)2后甲硝唑去除效率提高的原因,对加入催化剂前后反应溶液的pH 进行了测试。反应溶液中不加催化剂时初始pH 为6.0 左右。当反应溶液中加入0.15g/L 的催化剂时初始pH增加至9.0左右。随着在臭氧化系统中加入催化剂,反应溶液的pH 升高将会使得臭氧的分解速率增加,从而导致更多的羟基自由基产生,因此提高了甲硝唑的降解效率[10,20]。另外,这两种材料较高的催化性能可以归因于臭氧与增加的羟基之间的相互作用,而羟基在增加臭氧转化为羟基自由基的过程中起了主要的作用[21]。根据图4的傅里叶红外光谱图可知在这两种不同形貌的纳米Mg(OH)2催化剂的表面有大量的羟基,这些碱性官能团可以作为臭氧分解的引发剂[22]。
另外,在这两种材料的催化臭氧化过程中,Mg(OH)2-2 的催化臭氧化效果要好于Mg(OH)2-1。为了探究其原因,对这两种催化剂的比表面积进行了测试,催化剂的比表面积能够在很大程度上影响催化剂活性位点的暴露,从而影响催化活性。通过测试可知,Mg(OH)2-1 和Mg(OH)2-2 的BET 比表面积分别为35.642m2/g和40.195m2/g。由此可以看出,Mg(OH)2-2 的比表面积大于Mg(OH)2-1,比表面积的增大引起活性位点的增加,从而引起甲硝唑的去除速率提高。
2.4 催化剂的稳定性

图7 催化剂循环6次后的甲硝唑降解效率
催化剂的循环稳定性和可重复利用性是其能否应用于实际的关键因素。图7显示了催化剂的重复使用效果,从图中可以看出,与第一次使用相比较,6 次 循 环 后,Mg(OH)2-1 和Mg(OH)2-2 催 化 臭氧化降解甲硝唑的活性几乎未发生明显变化,表明这两种形貌的纳米Mg(OH)2都具有良好的稳定性。另外,从图中还可以看出在六次循环使用后,Mg(OH)2-2 的催化性能要优于Mg(OH)2-1。由于使用过的催化剂的团聚以及催化剂活性位点的堵塞[23],使得6次循环后甲硝唑的去除效率较第一次有所降低。总之,所制得的这两种纳米Mg(OH)2在用于催化臭氧化降解有机污染物时具有良好的稳定性。
3 结论
(1)分别以氯化镁和取自察尔汗盐湖的天然水氯镁石为原料通过化学沉淀法成功的制备了不同形貌的纳米Mg(OH)2催化剂[Mg(OH)2-1和Mg(OH)2-2]。通过表征可以发现Mg(OH)2-1 为片状,Mg(OH)2-2为花状,且这两种催化剂的表面都含有大量的羟基。
(2)这两种不同形貌的纳米Mg(OH)2在臭氧化过程中均可以提高甲硝唑的降解和矿化效率,且Mg(OH)2-2 的催化臭氧化性能要优于Mg(OH)2-1,这可能是由于比表面积的差异引起的。
(3)这两种不同形貌的催化剂在循环使用六次后仍然能保持较高的污染物去除效率。这为水环境中抗生素的去除,氧化方式及催化剂的选择提供了新思路。
