Erastin 对脂多糖诱导的支气管上皮细胞炎症反应的影响*
2020-03-27邵强刘芬李勇徐泽尧陶文强张建国赵宁钱克俭
邵强,刘芬,李勇,徐泽尧,陶文强,张建国,赵宁,钱克俭
(1.南昌大学第一附属医院重症医学科,南昌330006;2.南昌大学第一附属医院肿瘤科,南昌330006)
铁死亡(Ferroptosis) 是一种铁依赖性的,以脂质过氧化物的积累为特征的非细胞凋亡形式的细胞死亡。 脂质过氧化物的积累是细胞死亡的主要原因,它的形成与活性氧(ROS)有关。谷胱甘肽过氧化物酶4 (Glutathione peroxidase 4, GPX4) 是铁死亡的关键调节基因。 目前已知铁死亡参与多种疾病的发生发展,如肿瘤,神经系统疾病、组织缺血再灌注损伤、炎症反应、肾衰竭等。 在炎症反应中,上皮细胞等发生铁死亡释放炎症因子或免疫细胞直接发生铁死亡参与炎症反应调控。 研究发现,铜绿假单胞菌通过脂氧合酶诱导支气管上皮细胞发生铁死亡,是其致病的重要机制[1]。 LPS 是TLR4/NF-κB 炎症通路激活剂, 常常用于构建炎症反应模型[2,3]。在LPS 诱导的支气管上皮细胞炎症反应模型中,铁死亡是否参与其调控,目前尚未见报道。本研究将铁死亡激活剂应用于LPS 诱导的支气管上皮细胞炎症反应模型,检测支气管上皮细胞炎症因子的表达变化,进一步探讨铁死亡在支气管上皮细胞炎症反应中的作用。
1 材料与方法
1.1 实验材料 HBE 细胞株购于美国模式培养物集存库、胎牛血清(GIBCO 公司,美国)、DMEM 高糖培养液(BI 公司 以色列)、LPS(E.coli,O111:B4,Sigma 公司,美国)、Erastin(Sigama-Aldrich,E7781)、Ferrostain -1 (Sigama -Aldrich,SML0583)、TRIzol(Invitrogen,美国)、四甲基偶氮唑盐(MTT,北京索莱 宝 科 技 有 限 公 司)、PrimeScript·RT reagent Kit(DRR037S, 大 连 宝 生 物 工 程 有 限 公 司)、SYBR Premix Ex Taqtm II (DRR820S,大连宝生物工程有限公司)、β-actin 及IL-6 引物由北京擎科公司合成、ABI Step One Plus 实时荧光定量PCR 仪、超速离心机(Thermo Fisher 公司,美国)、氯仿、异丙醇、无水乙醇等均为国产分析纯。
1.2 方法
1.2.1 细胞培养 HBE 细胞培养于含10%胎牛血清,不含丙酮酸钠的DMEM 高糖培养基中,置于37℃、5%CO2恒温培养箱中培养,2-3d 更换培养液。
1.2.2 MTT 比色法检测Erastin 对细胞活性的影响取指数生长期HBE 细胞,按每孔5×103接种至96孔板,细胞贴壁90min 后,分别加入10μmol/L、20 μmol/L、40 μmol/L、80 μmol/L 终浓度的Erastin,每组设5 个复孔,同时设阴性对照组(等体积PBS 替代Erastin) 及 阳 性 对 照 组 (10%DMSO 替 代Erastin),加药后细胞培养24h,再加入5 g/L MTT溶液10μl/孔,继续培养4 h,吸弃上清液后每孔加入200μl DMSO,用酶标仪(波长570nm)测定各孔的吸光度(OD 570nm)值。
1.2.3 处理及分组 取指数生长期HBE 细胞,按每孔细胞5×105接种至6 孔板,每孔2ml。实验分为5组:⑴PBS 对照组:加入等体积PBS 溶液;⑵LPS组:加入0.1g/L LPS 溶液;⑶ERA 组:加入20μmol/L Erastin 溶液; ⑷LPS+ERA 组: 加入20μmol/L Erastin 溶液预处理30min 后, 加入0.1g/L LPS 溶液;⑸LPS+FER-1 组:加入500nmol/L Ferrostain-1溶液预处理30min 后,加入0.1g/L LPS 溶液。 细胞培养24 h 后,收集细胞,用于提取总RNA。
1.2.4 q-PCR 检测 采用TRIzol 法提取细胞中的总RNA,通过琼脂糖凝胶电泳检测RNA 完整性及纯度, 紫外分光光度计测定总RNA 浓度, 采用takara 逆转录试剂盒进行反转录, 应用SYBR Green 荧光染料试剂盒进行q-PCR,所有操作均在冰上完成,选取β-actin RNA 作为内参照,目的基因的相对表达量采用2-ΔΔCt 表示。
1.3 统计学处理 所有数据均使用SPSS 20.0 软件进行数据分析, 应用GraphPad Prism 5 软件作图。数据以均差±标准差表示。 两样本比较采用独立样本t 检验。 以P<0.05 为差异具有统计学意义。
2 结果
2.1 MTT 比色法检测Erastin 对HBE 细胞活性的影 响 Erastin 在10 ~80μmol/L 的 浓 度 范 围 内 对HBE 细胞无明显毒性作用,见图1。
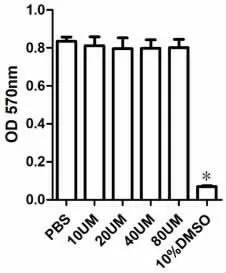
图1 MTT 比色法检测Erastin 对HBE细胞活性的影响
2.2 Erastin 对细胞IL-6 mRNA 转录水平的影响与PBS 对照组相比,LPS 组、ERA 组和LPS+ERA组IL-6 mRNA 相对表达量显著增高(P<0.01)。 与LPS 组相比,LPS+ERA 组IL-6 mRNA 相对表达量显著增高(P<0.01),LPS+FER-1 处理组IL-6 mRNA相对表达量显著降低(P<0.01),差异具有统计学意义。 见图2。
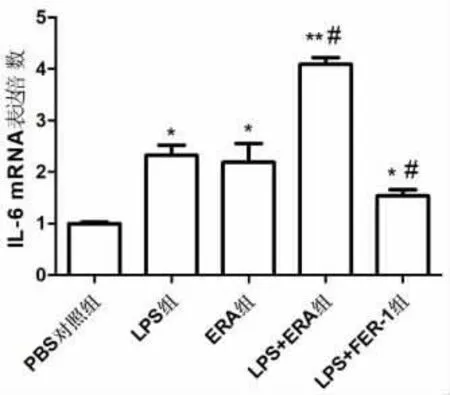
图2 HBE 细胞中的IL-6 mRNA 相对表达量
3 讨论
铁死亡由Stockwell 等学者于2012 年提出,其在形态学、 生物化学以及基因学方面均不同于凋亡、坏死和自噬等死亡形式。 多不饱和脂肪酸在脂氧合酶( LOXs) 的作用下发生氧化,形成脂质过氧化物, 而脂质过氧化物的积累是细胞铁死亡的主要机制。 脂质过氧化物的产生依赖于细胞内铁的芬顿反应, 其清除主要由谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)完成,故可认为铁、脂质过氧化物和GPX4 是铁死亡的3 个重要关键因素,早期研究发现铁死亡与肿瘤的发生、发展密切相关,铁死亡能够抑制肿瘤细胞的生长[4,5]。 随着铁死亡研究的广泛开展, 越来越多的研究发现铁死亡普遍存在于人体细胞中, 并且与多种疾病状态密切相关,其中包括神经系统疾病、组织缺血再灌注损伤、炎症反应、肾衰竭等[6-10]。
研究发现,细胞发生铁死亡时,通过释放损伤相关分子模式 (damage -associated molecular patterns,DAMPs)家族成员高迁移率族蛋白1 (high mobility group box 1,HMGB1) 活化巨噬细胞, 激活炎症反应[11]。 构建大鼠心力衰竭模型后,发现心肌细胞出现铁死亡,而沉默TLR4 能抑制心肌细胞铁死亡,改善大鼠心功能[14]。 此外,Hee 等人研究发现小剂量铁死亡激活剂Erastin 对骨髓来源的巨噬细胞活性无影响, 并且能够抑制NF-κB 信号通路,减轻LPS 诱导的炎症反应[13]。 本研究同样发现,小剂量Erastin 对支气管上皮细胞活性无明显影响。这与Tang 等研究结果相似,他们采用Erastin 刺激人外周血单核细胞,并未引起细胞铁死亡,反而促进单核细胞的增殖与分化[14]。 同时,我们检测了细胞内炎症介质IL-6 mRNA 表达变化, 结果显示Erastin 能够诱导支气管上皮细胞释放炎症介质,并能够放大LPS 诱导的炎症介质的释放。 我们研究结果与Tang 等研究结果相类似,他们诱导MEF细胞铁死亡, 并与BMDM 细胞共培养, 结果发现MEF 铁死亡后释放炎症介质HMGB1, 并激活BMDM 释放炎症因子[11]。此外,Ferrostatin-1(Fer-1)可以抑制LOXs 的活性,是铁死亡抑制剂,我们将Fer-1 预处理支气管上皮细胞后加入Erastin,结果显示Fer-1 能够减轻炎症介质释放。这表明Erastin未能诱导支气管上皮细胞铁死亡, 但能诱导并放大炎症介质释放。
总之,支气管上皮细胞是肺组织应对感染的第一道屏障,支气管上皮细胞的损伤以及炎症介质的释放可能是启动肺内炎症瀑布反应的关键。Erastin是铁死亡诱导剂,诱导了支气管上皮细胞释放炎症因子,但未能诱导细胞发生铁死亡,可能与不同细胞类型及细胞外环境相关。 我们推测Erastin 可能通过不同的通路,参与调控细胞的病理状态。因此,下一步我们将采用高通量测序检查差异表达基因与蛋白,筛选目标基因或蛋白,进一步研究Erastin诱导支气管上皮细胞释放炎症介质的机制。
