硫酸羟氯喹治疗类风湿关节炎合并冠状动脉粥样硬化性心脏病的临床研究*
2020-03-27庄铭城黄燕妮王小燕卢帆黄懋
庄铭城,黄燕妮,王小燕,卢帆,黄懋
(广东省普宁市人民医院,普宁515300)
类风湿性关节炎 (rheumatoid arthritis, RA)是临床常见的以关节滑膜组织和周身血管慢性炎症为主的自身免疫性疾病, 是引起我国劳动力丧失的主要原因之一。 近年来, 越来越多的研究发现RA 患者发生心、 脑血管病的危险性显著增加,将近50%的RA 患者死于心血管疾病[1]。 特别是慢性炎症可导致RA 患者发生动脉粥样硬化而形成冠状动脉粥样硬化性心脏病(Coronary artery disease,CAD)。并且,已有充足的证据证实RA 患者冠心病发病率较一般人群高且早,RA 被认为是CAD 的独立危险因素, 而CAD 是RA 患者死亡的主要病因之一[2]。 因此,RA 合并CAD 越来越受到临床医务工作者的重视,也成为临床治疗的重点和难点。探讨RA 合并CAD 的相关机制并给予有效治疗,对于减少心脑血管疾病的发生率和病死率, 进一步改善患者生存质量有重要的临床意义。 研究表明,早期应用改善病情类抗风湿药物(DMARD)不仅能够延缓关节变形, 且能延缓动脉粥样硬化发生及减少心血管疾病风险。 羟氯喹(HCQ)作为一种DMARD,对改善RA 的疗效确切,同时对于延缓动脉粥样硬化有一定的作用[3]。 但是,HCQ 治疗RA 合并CAD 的临床有效性和安全性尚无大样本临床随机对照试验证实。 另外,羟氯喹治疗RA 合并CAD 的相关机制和影响因素尚未见报道。 本文拟探讨羟氯喹治疗类风湿关节炎合并冠状动脉粥样硬化心脏病的疗效及可能机制。
1 资料与方法
1.1 一般资料 选择医院于2017 年2 月-2018 年9 月收治的符合纳入标准的RA 合并CAD 患者200 例,采用随机数字表法随机分为对照组和观察组,每组100 例。 对照组中,男32 例,女68 例,年龄42-69 岁,平均年龄(56.82±6.82)岁;病程11-145 个月,平均病程(55.23±41.64)个月。观察组中,男31 例,女69 例,年龄39-68 岁,平均年龄(56.22±6.51)岁,病程12-146 个月,平均病程(56.04±40.88)个月。 两组患者的一般资料,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准 纳入标准: ⑴RA 诊断符合1987 年美国风湿病学会《类风湿关节炎分类标准》[3]; ⑵CAD 诊断符合1979 年国际心脏病学会和协会及世界卫生组织临床命名标准化联合专业组的报告标准;⑶患者伴有关节肿胀或疼痛;⑷接受本次治疗前,1 个月内未使用其它激素治疗; ⑸患者自愿参与本次研究,签署知情同意书。排除标准:⑴严重肝肾功能不全者;⑵合并恶性肿瘤患者;⑶精神障碍,不能配合研究者;⑷严重心脑血管疾病者;⑸对本次研究药物过敏者。
1.3 方法 观察组患者采用口服药物的治疗方式,给予患者羟氯喹 (赛诺菲制药有限公司, 批号:H20160306)0.2g/次,2 次/d+甲氨蝶呤片(上海信谊药厂公司,批号:H31020644)10mg/次,1 次/周。 服用甲氨蝶呤片明显胃肠道反应、骨髓抑制的则改用来氟米特(苏州长征-欣凯制药有限公司, 批号:H20000550)10~20mg,1 次/d。 对照组给予甲氨蝶呤片(上海信谊药厂公司,批号:H31020644)治疗,口服;10mg/次,1 次/周。每位患者均于治疗后12 个月随访。
1.4 观察指标 参考美国风湿病学会制定的类风湿关节炎的诊断和治疗标准制定疗效判定标准,根据患者晨僵、关节压痛与肿胀、握力及患者红细胞沉降率(ESR)水平将患者的疗效分别评定为显效、好转、无效,显效:患者的关节压痛、肿胀症状消失,关节功能好转,晨僵情况大为改善;好转:患者的关节压痛、肿胀症状缓解,关节功能有所好转,晨僵情况有一定缓解;无效:患者的疼痛、肿胀等症状无改善或加重。 总有效率=(显效+好转)/总例数×100%。分别于治疗前和治疗后采集患者静脉血,采用全自动血液分析仪(日立7080 型)检测甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、脂蛋白a 含量、超敏C 反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)含量和血沉(ESR)。 免疫电泳扩散法测定患者血清载脂蛋白-A1 (APOA1)、载脂蛋白-B (APO-B)水平。 采用彩色多普勒超声检测颈动脉内膜中层厚度(IMT)和动脉粥样硬化斑块面积;采用酶联免疫吸附剂测定(ELISA)法检测静脉血中白介素-6(IL-6)、肿瘤坏死因子α(TNF-α)、 人 单 核 细 胞 趋 化 蛋 白4 (Human monocyte chemotactic protein 4,MCP-4)、核因子κB(nuclear factor kappa B,NF-κB) 高迁移率族蛋白B1(HMGB1)表达量,HMGB1 试剂盒购自武汉启迪生物科技有新公司, 室温下平衡30min 后打开ELISA 试剂盒,按照说明书进行血清HMGB1 水平检测。
治疗前后采用迈瑞Mindray 彩色多普勒超声系统DC-N2S 检测颈动脉中膜厚度(CIMT)及动脉粥样硬化斑块面积,探头频率8-12 MHz。颈动脉中膜厚度(CIMT)为颈动脉壁中膜厚度与内膜之和,用彩色多普勒超声测定其颈动脉动脉管腔, 测定管壁膜与血液内膜界面的距离,多次测量取平均值。
1.5 统计学方法 采用SPSS 21.0 进行分析, 计量资料采用均数±标准差(±s)表示,计量资料的两组间对比采用t 检验,多组间对比采用单因素方差分析,计数资料采用(%)表示,计数资料的对比采用χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗前后血脂水平比较 治疗前,两组患者血脂水平比较, 差异无统计学意义 (P>0.05)。 治疗后,观察组患者TC、TG、LDL-C、LP(a)水平均低于对照组,APO-A1、HDL-C 水平高于对照组,差异有统计学意义(P<0.05)。 见表1。
表1 两组患者治疗前后血脂水平比较(±s)
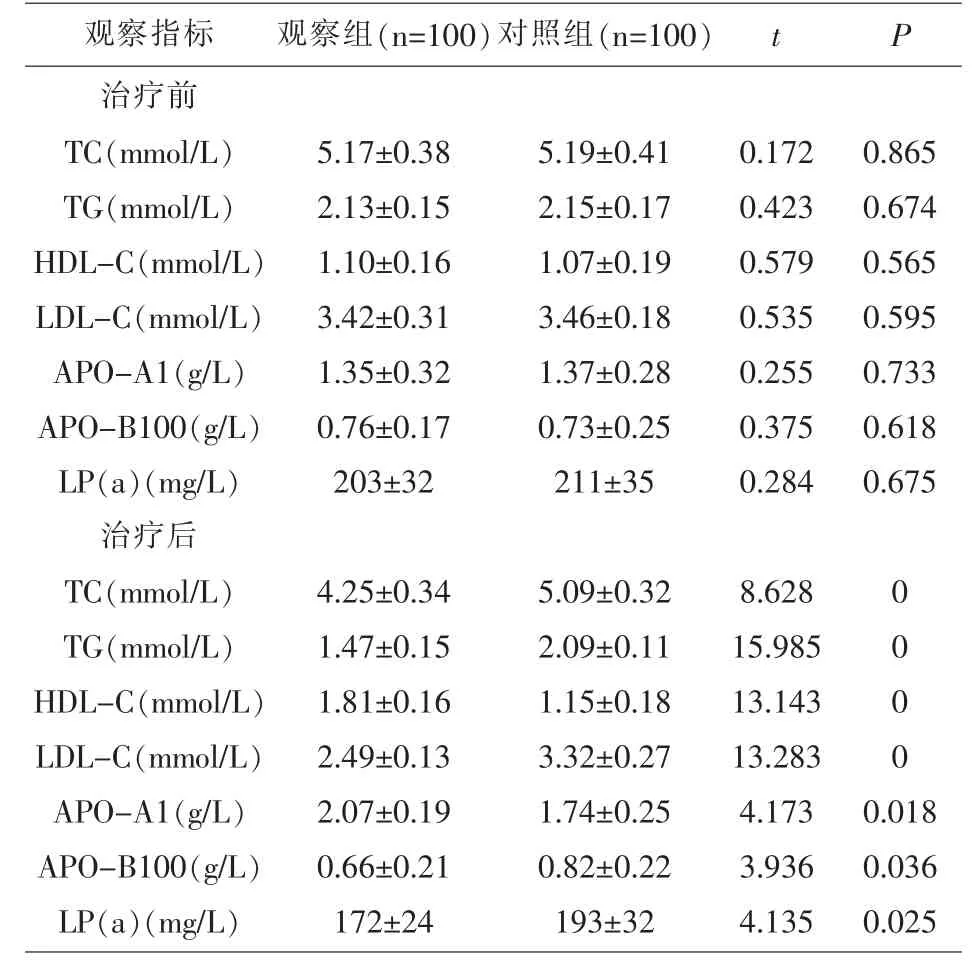
表1 两组患者治疗前后血脂水平比较(±s)
观察指标 观察组(n=100)对照组(n=100) t P治疗前TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)APO-A1(g/L)APO-B100(g/L)LP(a)(mg/L)治疗后TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)APO-A1(g/L)APO-B100(g/L)LP(a)(mg/L)5.17±0.38 2.13±0.15 1.10±0.16 3.42±0.31 1.35±0.32 0.76±0.17 203±32 5.19±0.41 2.15±0.17 1.07±0.19 3.46±0.18 1.37±0.28 0.73±0.25 211±35 0.172 0.423 0.579 0.535 0.255 0.375 0.284 0.865 0.674 0.565 0.595 0.733 0.618 0.675 4.25±0.34 1.47±0.15 1.81±0.16 2.49±0.13 2.07±0.19 0.66±0.21 172±24 5.09±0.32 2.09±0.11 1.15±0.18 3.32±0.27 1.74±0.25 0.82±0.22 193±32 8.628 15.985 13.143 13.283 4.173 3.936 4.135 0 0 0 0 0.018 0.036 0.025
2.2 两组患者治疗前后CIMT 与FMD 比较 治疗后, 观察组动脉粥样硬化斑块面积改善效果优于对照组,且观察组CIMT 低于对照组,差异有统计学意义(P<0.05)。
2.3 两组患者治疗前后血清炎症因子比较 治疗前,两组患者血清炎症因子水平比较,差异无统计学意义(P>0.05)。 治疗后,观察组患者血清炎症因子水平均低于对照组, 差异有统计学意义 (P<0.05)。
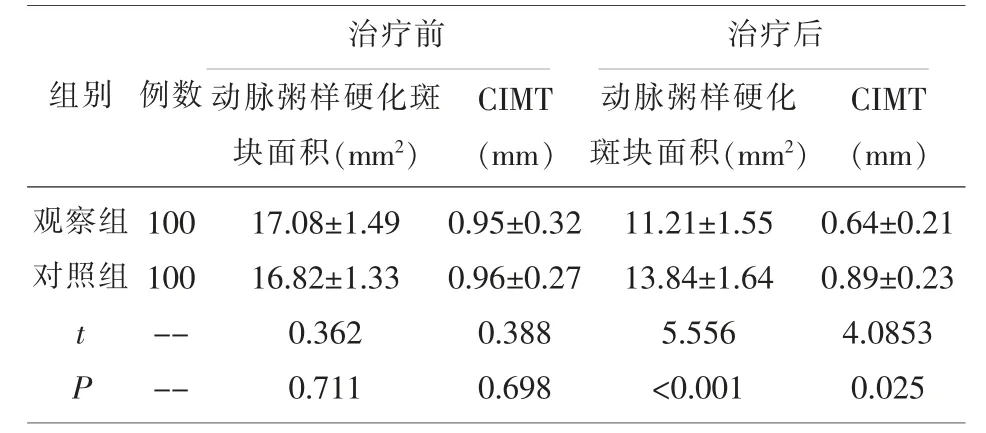
表2 两组治疗前后CIMT、FMD 比较

表3 两组患者治疗前后血清炎症因子比较
2.4 两组患者治疗前后Hcy、ESR、RF 等指标变化治疗前,两组患者Hcy、ESR、RF 水平比较,差异无统计学意义(P>0.05)。 治疗后, 观察组患者血清Hcy 水平均低于对照组,差异有统计学意义(P<0.05)。

表4 两组患者治疗前后Hcy、ESR、RF 等指标变化
3 讨论
RA 是全身性的自身免疫性疾病,可累及全身多个部位的关节,导致关节畸形,严重影响患者的生活质量。 RA 的发病机制尚未完全明确,但多项研究表明, 其发病与感染因子和自身免疫能力较低相关, 其感染因子抗原多肽通过抗原提呈细胞将信息转导至T 细胞,从而激活机体的免疫反应,使其他免疫细胞活化,但由于RA 患者多为体质较弱, 免疫能力较差的女性, 因而机体的内炎性因子、氧自由基等炎症介质会在病灶处积累[4]。 造成RA 的主要炎性因子主要有白细胞介素、肿瘤坏死因子等,随着关节炎症的发展,继而通过IL-1、IL-6 造成全身反应,诱导金属蛋白酶的产生,造成关节功能的退化。本文患者的血清IL-1、IL-6 及肿瘤坏死因子水平均显著升高,与文献报道相符。 研究表明,RA 患者CAD 的发病率较一般人群高且早,RA 被认为是CAD 的独立危险因素[5]。 CAD 是RA患者死亡的主要原因之一。 RA 产生的慢性炎症是患者发生动脉粥样硬化的主要病因[6]。 目前研究认为,高迁移率族蛋白B1(HMGB1)是RA 发病过程中重要的炎症因子,通过影响单核/巨噬细胞、血管内皮细胞、 血管平滑肌细胞的功能而促进局部炎症、单核/巨噬细胞聚集、血管平滑肌细胞趋化性及其细胞骨架的重构, 参与了动脉粥样硬化的发生发展[7]。 因此,降低HMGBl 的表达水平,可以减少RA 患者动脉粥样硬化的发病率, 降低RA 患者病死率。其中,超敏C 反应蛋白(hs-CRP)、同型半胱氨酸 (Hcy)、 脂蛋白a 在其过程中起重要作用。HMGBl 可刺激巨噬细胞释放出VCAM-1。 hs-CRP主要由肝细胞在细胞因子作用下分泌产生, 也可在动脉粥样硬化斑块细胞中产生。 hs-CRP 既是炎症因子,又参与导致动脉粥样硬化的过程,被认为与心血管疾病关系密切。Hcy 是一种具有细胞毒性的代谢产物, 被证实与心血管疾病发生具有密切关系,是冠心病发生的危险因素之一[8]。 脂蛋白a是一种特殊大分子蛋白,其内富含胆固醇,结构与低密度脂蛋白类似, 被认为与心血管疾病和血栓形成有关[9]。
类风湿关节炎患者中因心血管疾病死亡的病例占总死亡人数的一半以上, 相关危险因素包括慢性炎症、患者血管内皮功能障碍、患者体内脂质代谢异常,胰岛素抵抗等,大部分类风湿关节炎患者出现动脉粥样硬化症状均由上述原因引起[10]。近年来的研究显示[11],临床常见类风湿性关节炎等慢性炎症导致的患者体内脂质代谢紊乱症状。 本文选择的活动期类风湿性关节炎患者血清中TC、TG、LDL 等水平显著升高。 研究表明,慢性炎症可能通过一定途径对脂蛋白的分子结构进行改造,使极低密度脂蛋白颗粒变小,密度变大,促进动脉粥样硬化进程,另外,炎症因子还可能刺激单核细胞和内皮细胞内超氧化物的分泌, 加速低密度脂蛋白的氧化程度,相应的,低密度脂蛋白氧化后又会反过来对血管内皮细胞进行反馈性调节, 导致IL-1、TNF-α 等炎症因子的增加,如此往复,加速动脉粥样硬化的发生发展。
载脂蛋白在脂质代谢中发挥重要作用, 其中apoA1 于apoB100 是两类主要的载脂蛋白,apoA1是血清高密度脂蛋白的主要载脂蛋白, 其主要功能是可作为辅助因子激活血浆中的卵磷脂, 胆固醇酯酰基转移酶,调节胆固醇代谢。 apoB100 是血清极低密度脂蛋白、 低密度脂蛋白的主要构成蛋白, 其主要功能是作为肝细胞和肝外一些组织细胞表面脂蛋白受体的识别标志, 当身体炎症反应增加时, 肝合成apoA1 与apoB100 的能力受损[12]。本文两组患者采用改善病情抗风湿药物后, 患者的病情逐渐得到缓解, 体内的脂质指标异常得到纠正, 高密度脂蛋白水平与apoA1 /apoB100 的比值均得到升高,其中,观察组患者治疗后的apoA1 /apoB100 比值高于对照组,一方面提示硫酸羟氯喹可能改善了患者体内的脂质代谢, 另一方面也提示诸多炎症因子推进了类风湿性关节炎患者体内的脂质代谢功能障碍。
CIMT 是评估冠状动脉粥样硬化的可靠指标,是心脑血管事件的独立危险因子[13]。 CIMT 是临床最有效且最常用的检测早期动脉粥样硬化和动脉粥样硬化范围、程度的超声指标,且可用来筛查心血管事件高危人群。 本文超声结果显示,类风湿性关节炎患者治疗前的IMT 显著升高, 与TC、TG、LDL 水平可能存在一定的正相关性, 两者从不同水平验证了类风湿性关节炎患者可能会导致动脉粥样硬化的趋势,并以此建议临床应早采取措施,抑制体内炎症程度,改善代谢紊乱,以及早预防动脉粥样硬化。
综上所述, 类风湿关节炎合并冠状动脉粥样硬化心脏病的影响因素较多, 硫酸羟氯喹可能通过降低炎性指标水平以抑制患者体内炎症程度,并进一步改善脂质代谢障碍, 以达到对脉粥样硬化的防治目的。
