18F-FDG PET/CT 对发作间期难治性癫痫诊断及定位的价值*
2020-03-27邵明岩徐荣吴晓牧陈小华金爱芳张慧宁
邵明岩,徐荣,吴晓牧,陈小华,金爱芳,张慧宁
(江西省人民医院,南昌330006)
癫痫是神经系统的第二大疾病,是一种慢性脑部疾病, 是脑皮质异常发电导致的临床综合征[1],具有长期性、反复发作性、难治性特点,临床约有20%-30%的癫痫患者因药物不能控制其发作,发展成为难治性癫痫[2]。 以往难治性癫痫患者主要靠MRI、脑电图等进行诊断及定位,诊断及定位准确率较低,随着分子影像技术的发展,PET/CT 可从解剖、代谢、血流灌注、生化、功能、氧耗、化学递质及神经受体等方面对致痫灶进行显像和定量分析,从而提高了癫痫灶的检出率。 本研究主要通过回顾性分析70 例难治性癫痫患者术前18F-FDGPET/CT 发作间期表现, 通过对癫痫患者病史、 发病频次、致痫灶的SUVmax 值、AI 指数等指标,并与术中癫痫灶对比,探讨PET/CT 对难治性癫痫致痫灶的定性、定位诊断价值,为临床治疗难治性癫痫提供依据。
1 资料与方法
1.1 病例资料 收集江西省人民医院难治性癫痫患者70 例, 其中男37 例, 女33 例, 年龄10-78岁,平均35 岁,体重46-100 kg,病史3-50 年。 其中单纯部分性发作25 例,复杂部分性发作29 例,全面强直阵挛性发作16 例。 难治性癫痫纳入标准:⑴年龄≥10 岁,性别不限,临床通过症状已诊断为癫痫患者; ⑵频繁的癫痫发作至少每月4 次以上,经过一线抗癫痫药物正规治疗2 年以上,血药浓度已达有效水平。 排除标准:⑴医源性癫痫;⑵没有正规治疗的癫痫患者。 其中51 例患者通过手术切除癫痫灶,临床达到治愈或控制,随访1 年无复发。
1.2 检查方法 PET/CT 检查采用美国GE 公司生产的Discovery-64CT 和mini trace 回旋加速器,18F-FDG 由Tracerlab FXFN 合成器完成,FDG 的放化纯度>96%。 经肘静脉按0.12 mci/kg 分装注射18F-FDG,采用患者发作间期脑显像,嘱患者在安静的房间里休息40~60 min, 并进行视听封闭,直到检查结束。 根据PET/CT 扫描计划,扫描1 个床位,先行CT 扫描,再行PET 图像采集。 具体参数:电压120 kV,电流200mA,采用FORE-Iterative 重建,FOV 为25cm,发射扫描采集25min,轴向间隔4.25 ram,层厚3.75 mm,矩阵128×128,扫描范围包含整个头部,获得40 帧横断面图。 图像融合通过Xeleris 及AW4.6 工作站重建轴位、 冠状位、矢状位图像。 采用感兴趣区分析及半定量分析法,通过划定致痫灶感兴趣区 (ROI), 直接测定致痫灶SUV 值。 在 临 床 工 作 中, 一 般 取SUVmax 值,SUVmax 值是反应组织的核素最大摄取量,克服了不同检查时注射剂量差异、 注射显像时间间隔差异及不同患者体内放射性分布差异等因素, 使得结果更加准确稳定,重复性及可比性好。
1.3 诊断标准
1.3.1 视觉分析法 大脑皮层病变影像分析以对侧和或相邻皮层为参照, 皮层放射性分布明显低于或高于参照区连续2 层或2 个横断面以上时,判断为异常;对皮层下结构主要行双侧对比分析,当放射性摄取不对称、 一侧显著低于或高于对侧连续2 层或2 个横断面以上时,判断为异常。
1.3.2 半定量分析法 通过划定ROI 直接测定组织FDG 的摄取量即可反映癫痫灶的葡萄糖代谢(MRGlu),通过SUVmax 反应癫痫灶的核素最大摄取量。 SUV 值克服了不同检查时注射剂量差异、注射显像时间间隔差异及不同患者体内放射性分布差异等因素,使得结果更加准确稳定。
1.3.3 目前采用半定量、 视觉分析法相结合 利用AI 放射性分布不对称指数(Aymmetric index, AI)来定位及诊断癫痫灶,AI 指数>15%视为异常。 这种方法减低了人为因素,使结果更加准确。 AI=(SUV病灶-SUV 对侧)/(SUV 病灶+SUV 对侧)×200%[3]。由本院2 名有经验的PET-CT 医师同时双盲阅片。
1.4 统计学分析 采用SPSS17.0 统计软件进行数据分析。 符合正态分布的计量资料以均数±标准差(x±s)表示,计数资料以例(%)表示;配对样本采用t 检验, 计量资料的相关性采用Pearson 相关进行分析。 以P<0.05 为差异有统计学意义。
2 结果
2.1 PET/CT 与手术结果 70 例难治性癫痫患者中,PET/CT 诊断癫痫阳性59 例,正常11 例,诊断阳性率为84.2%。 其中手术51 例,PET/CT 与术中定位相符合46 例,5 例不符合,PET/CT 准确定位率为77.9%。病理结果显示颞叶癫痫35 例(海马硬化及海马萎缩20 例、 局灶性皮质发育不全6 例、局灶性皮质结节2 例,脑肿瘤4 例,蛛网膜囊肿3例),额叶癫痫11 例(局灶性皮质发育不全8、蛛网膜囊肿3 例),顶叶癫痫5 例(蛛网膜囊肿2 例,局灶性皮质发育不全3 例)。PET/CT 表现为癫痫灶发作间期均呈放射性摄取均减低,花斑样缺损改变,呈单一或多个脑内低代谢病灶, 按代谢类型分为单一病灶、 多发病灶、 弥漫型。 其中脑内致痫灶SUVmax 值及AI 指数, 经多样本t 检验,P≤0.05,有统计学意义。 见表1。
2.2 致痫灶的SUVmax 与病史、发作频次的相关性采用统计学Pearson 相关性对病史及发作频次进行分析,致痫灶的SUVmax 值与病史、发病频次呈正相关, 病史越长, 发病频率越多,SUVmax 值越低,P<0.05 有统计学意义。 见表2。

表1 PET/CT 显像中致痫灶SUVmax、AI 指数
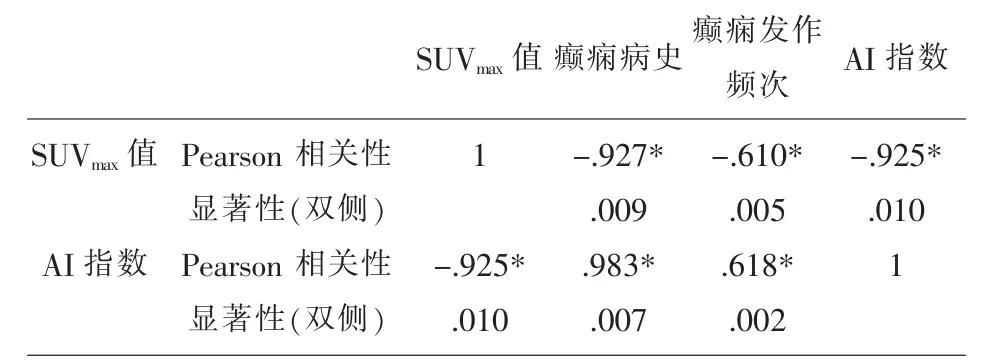
表2 SUVmax 值与病史、发病频次Pearson 相关性
2.3 Roc 曲线分析 以AI 指数15%为致痫灶的诊断阈值,评价PET/CT 对致痫灶的灵敏度、准确度、特异度分别为37.15%、79.46%, 以AI 指数为指标绘制Roc 曲线,曲线下面积为0.769,获得致痫病灶位置的最佳截断值为13.6%,该曲线下对致痫病灶位置的灵敏度、特异度分别为42.85%、85.35%。
3 讨论
难治性癫痫是一种慢性神经系统疾病, 以脑神经元过度放电导致发作性、重复性、刻板性和短暂性的中枢神经系统功能失常为特征的神经综合征[1],临床上这类癫痫治疗困难,约占癫痫种类的25%。难治性癫痫易复发,药物治疗不彻底,手术是其根治的重要手段, 通过癫痫外科手术对致癫痫灶进行切除, 可以实现难治性癫痫的无发作或少发作,文献报道[4]切除致痫灶能显著提高癫痫患者的认知水平、 精神状态、 社会适应能力和生活质量,明显改善预后。 因此准确评估和定位致痫灶是难治性癫痫手术治疗成功的关键。
PET/CT 脑显像作为功能代谢显像, 能够从分子水平揭示致痫灶的代谢、氧耗、血流灌注及生化等,通过18 F 标记的FDG,对致痫灶进行显像,从而获得大脑皮层下结构和神经核团局部葡萄糖代谢率(LCMRGlu)及全脑葡萄糖代谢率(CMRGlu)等定量指标,大脑皮层下结构包括基底核、丘脑、间脑、脑干、小脑等神经组织,大脑皮层与皮层下存在着广泛而密切的联系网络和信息环路, 癫痫的发病机制多是由于病变导致大脑皮层与皮层下神经网络通讯发生功能性变化, 使癫痫患者皮层下结构出现血流或代谢异常[5]。 多项研究[6-8]发现难治性癫痫患者可伴发皮层下组织结构功能和代谢变化,分析其原因可能是由于皮层神经元损伤,引起神经投射路径和神经网络传导部位继发性神经组织血流减慢,从而导致远隔部位功能减低,因此PET/CT 上表现为低放射性摄取。 国内外学者[8,9]均报道在癫痫发作期, 脑组织代谢和脑血流量均明显地增加,18F-FDG PET/CT 表现为致痫灶放射性核素摄取增高,即局部脑区的高代谢区,而在发作间期, 脑组织代谢和脑血流量减少, 因此PET/CT图像可观察到致痫区域血流量灌注明显减少,表现为SUVmax 降低,基于此,可定位致痫灶。
既往PET/CT 相关研究表明PET/CT 对难治性癫痫术前定位具有一定的价值, 其价值大于常规的MRI 及脑电图[10],主要原因是癫痫属于功能性疾病,这类癫痫定位比较困难,常规MRI 及脑电图不能准确找到致痫灶。 常规磁共振对难治性癫痫致痫灶定位准确率与采集技术相关, 磁共振主要通过较高的软组织分辨率和形态异常, 比如脑萎缩、海马萎缩、海马硬化等器质性病变来评价致痫灶,对于致痫灶较小或无明显解剖异常患者来讲,对癫痫病灶的检出存在一定局限性, 无法准确定位。 文献报道[11]18F-FDG PET/CT 可以显示MRI 图像上都无法显示的皮质小结节及脑皮质发育不全,Jiang 等[12]研究后发现一些难治性癫痫患者的癫痫发作可能是皮质损伤造成的继发性发作,其MRI 检查多正常,但可在PET/CT 图像上显示。
本研究观察到难治性癫痫患者患侧SUVmax值明显低于健侧,这与文献报道一致[7],提示SUV max 值可作为致痫灶定位的定量检测指标,ROC曲线分析AI 指数对致痫灶定位有一定价值,以AI指数15%为癫痫灶的诊断阈值,评价PET/CT 对致痫灶的灵敏度、准确度、特异度分别为37.15%、79.46%,以AI 指数为指标绘制Roc 曲线,曲线下面积为0.769, 获得致痫病灶位置的最佳截断值为13.6%,该曲线下对致痫病灶位置的灵敏度、特异度分别为42.85%、85.35%, 说明AI 指数可作为准确检出致痫灶的标准,与多数研究结果[5,9,10]一致。 本研究中AI 指数15%的准确率不高,究其原因可能和本研究的纳入病例、病史有关,本研究纳入的部分患者病史较短,癫痫发作不频繁。 此外本研究提示致痫灶SUVmax 值与病史、 发作次数呈正相关,说明癫痫反复发作可导致脑细胞 及周围组织缺氧、缺血,并产生大量氧自由基,破坏脑细胞和神经元,使致痫灶区域脑血流量灌注明显减少,SUVmax 值较正常侧减低。 对于病史长、发作频繁的难治性癫痫,AI 指数应适当减低,对于病史较短、发作不频繁的患者,AI 指数应适当提高,这样能够更好的诊断致痫灶。
在本研究中, 难治性癫痫患者常表现为单一或多个脑皮质代谢异常病灶, 按代谢类型分为单一病灶、多发病灶、弥漫型,国外学者[13]认为单一病灶是存在潜在的皮质发育不良, 多灶及弥漫型是可能是与代谢、遗传、神经变性相关。 笔者发现部分难治性癫痫患者PET/CT 脑显像可以表现出伴随豆状核、 脑干葡萄糖高FDG 摄取的局部皮质低FDG 摄取,这可能与复杂的皮质-皮质下相互作用有关,此外基底节和脑干的高FDG 摄取,可能表明其与局灶性皮质放电的二次泛化有关。 在部分难治性癫痫患者脑图像中, 还可以发现癫痫灶以外的低代谢区域, 这可能由于癫痫电扩散或传播造成的,对于病史长、癫痫发作频繁的患者,整个大脑的FDG 摄取均减低,这可能是由于频繁、长期的癫痫发作改变了大脑结构的功能网络, 从而造成与致痫区密切相关的网络结构代谢减低。 因此,以PET/CT 低代谢区来判断是否为致痫区, 也存在一定的假阳性,仍需要结合临床病史。
总之,PET-CT 虽然存在一定的假阳性, 但对癫痫灶定位目前其仍是敏感性、 准确性相对较高的功能影像技术,其中PET/CT 中SUVmax 值及AI指数可以能够较准确判断致痫灶, 但仍需要结合临床病史,临床上病史短、发作不频繁的患者,AI指数应适当减低, 以期对癫痫灶做出更准确的诊断。
