三种不同肠内营养支持方案对胃癌胃切除病人预后影响的比较
2020-03-26卞晓洁韩菲王黎娜顾伟楠曾深陈大宇葛卫红管文贤
卞晓洁,韩菲,王黎娜,顾伟楠,曾深,陈大宇,葛卫红,管文贤
(南京大学医学院附属鼓楼医院,1.药学部,2.普外科,江苏 南京 210008)
胃癌是目前我国第三位的常见恶性肿瘤及肿瘤致死病因[1],手术治疗是首选的治疗方案,肠内营养支持是首选的营养支持方式。2018年国家卫生健康委员会制定《胃癌诊疗规范》推荐:胃癌病人围术期推荐使用免疫营养[2]。然而,免疫增强型肠内营养制剂:肠内营养混悬液(TPSPA)尚未上市,含有足量鱼油肠内营养制剂:肠内营养乳剂(TPF-T)脂肪供能达到50%,用于胃切除术后易导致脂肪泻。因此,胃癌胃切除围术期肠内营养制剂的选择仍存在争议,有研究推荐术后早期使用不含膳食纤维且易吸收的要素型制剂,但易导致高渗性腹泻[3]。整蛋白制剂是否宜选择含膳食纤维制剂也存在争议:有观点认为,肠内营养(EN)中的膳食纤维有利于肠蠕动,缩短粪便通过肠道的时间[4]。另外,膳食纤维在肠道内酵解后产生短链脂肪酸,为结肠黏膜提供燃料,促进细胞增殖保护肠黏膜屏障。另有学者认为,膳食纤维经细菌酵解后在产生短链脂肪酸的同时,还会产生氢气、二氧化碳和甲烷等气体,加重术后腹胀,在术后选用短肽蛋白、不含膳食纤维的肠内营养制剂为佳[5]。且含膳食纤维制剂腹胀和堵管发生概率较大,因此,本研究选择不含膳食纤维整蛋白型以及短肽型制剂,制定不同营养支持方案应用于胃癌胃切除病人,比较其营养支持效果、不良反应,以及术后住院时长、术后并发症发生率等指标,以期为胃癌胃切除围术期安全、有效选择肠内营养制剂提供借鉴。
资料与方法
一、一般资料
回顾性分析2014年1月至2015年10月期间入住我院胃肠外科的90例胃癌并行根治性胃切除病人,男性70例,女性20例,平均年龄为60.6岁。全部病人均于入院24 h内使用营养风险筛查2002(NRS2002)及病人主观整体评估(PG-SGA)进行营养风险筛查以及营养评估,手术中放置鼻空肠营养管。入选病人按不同肠内营养方案分为A、B、C三组,A组(肠道预适应组,30例):术前口服、术后管饲肠内营养混悬液[整蛋白-中链三酰甘油(TP-MCT)];B组(整蛋白组,33例):术后管饲肠内营养混悬液(TP-MCT);C组(短肽组,27例):术后管饲肠内营养混悬液[短肽(SP)]。两种肠内营养制剂比较见表1。
肠内营养混悬液(TP-MCT)特点:口感好、蛋白含量高、富含MCT(中链三酰甘油),更适合脂代谢异常病人;等渗、不含膳食纤维,适用于术后早期病人减少腹胀发生概率。肠内营养混悬液(SP)特点:口感差、高渗、不含膳食纤维,含有MCT,低脂、不刺激消化液分泌,缺点是容易引起高渗性腹泻。
入选标准:①所有病例均经临床诊断为胃癌,并拟行根治性胃切除手术;②年龄18~75岁;③术前未行放化疗;④术前未行静脉营养支持,未使用外源性白蛋白制剂者;⑤术前营养风险筛查无营养风险者。排除标准:①术前根据营养状况评定法测定为恶病质的病人;②存在明显心肝肾功能障碍;③合并代谢性疾病,如糖尿病等;④术前存在肠梗阻、严重休克、肠道局部缺血等肠内营养禁忌证的病人;⑤术中发现转移灶或者不能按照术前计划行根治性胃切除转而姑息治疗的病人。
二、病人基线情况
三组病人术前年龄、性别、体重、体质量指数(BMI)、手术方式、病理分期、手术时长、术中出血量、 美国麻醉医师协会(ASA)分级等差异均无统计学意义(P>0.05),具有可比性,见表2。
三、 营养支持方法
1.A组(肠道预适应组)营养支持方案 术前第1~3天在半流饮食的基础上每日口服肠内营养混悬液(TP-MCT)500 ml,总目标需要量为25~30 kcal·kg-1·d-1。术后第1天起经鼻饲管由输注泵以20~40 ml/h速度输注500 ml葡萄糖氯化钠注射液,术后第2天起经鼻饲管由输注泵以20~30 ml/h速度输注500 ml肠内营养混悬液(TP-MCT);术后第3天以 40~50 ml/h速度输注1 000 ml肠内营养混悬液(TP-MCT);术后第4~7天, 以50~60 ml/h 速度输注1 000~1 500 ml肠内营养混悬液(TP-MCT)。速度可根据病人具体情况进行适当调整,目标需要量25~30 kcal·kg-1·d-1,能量不足部分由静脉营养供给。
2.B组(整蛋白组)营养支持方案 术前半流饮食,目标需要量25~30 kcal·kg-1·d-1。术后第1天起经鼻饲管由输注泵以20~40 ml/h速度输注500 ml葡萄糖氯化钠注射液,术后第2天起经鼻饲管由输注泵以20~30 ml/h速度输注500 ml肠内营养混悬液(TP-MCT);术后第3天以 40~50 ml/h速度输注1 000 ml肠内营养混悬液(TP-MCT);术后第4~7天, 以50~60 ml/h速度输注1 000~1500 ml肠内营养混悬液(TP-MCT)。速度可根据病人具体情况进行适当调整,能量不足部分由静脉营养供给。
3.C组(短肽组)营养支持方案 术前半流饮食,目标需要量25~30 kcal·kg-1·d-1。术后第1天起经鼻饲管由输注泵以20~40 ml/h速度输注500 ml葡萄糖氯化钠注射液,术后第2天起经鼻饲管由输注泵以20~30 ml/h速度输注500 ml肠内营养混悬液(SP);术后第3天以 40~50 ml/h速度输注1 000 ml肠内营养混悬液(SP);术后第4~7天, 以50~60 ml/h速度输注1 000~1 500 ml肠内营养混悬液(SP)。速度可根据病人具体情况进行适当调整,能量不足部分由静脉营养供给。
四、 仪器和方法
本研究采用生物电阻抗方法进行人体成分分析,使用韩国Inbody公司的Inbody 720人体成分检测仪,测量病人的身体水分含量、肌肉量、去脂体重、体脂肪、骨骼肌、水肿等营养指标。
五、观察指标
术前:肱三头肌皮褶厚度(TSF)、上臂围、上臂肌围、非利手(或非损伤手)握力;身高、体重(计算BMI);血红蛋白、白蛋白、总白蛋白、前白蛋白;空腹血糖、血清胰岛素。

表1 两种肠内营养制剂比较
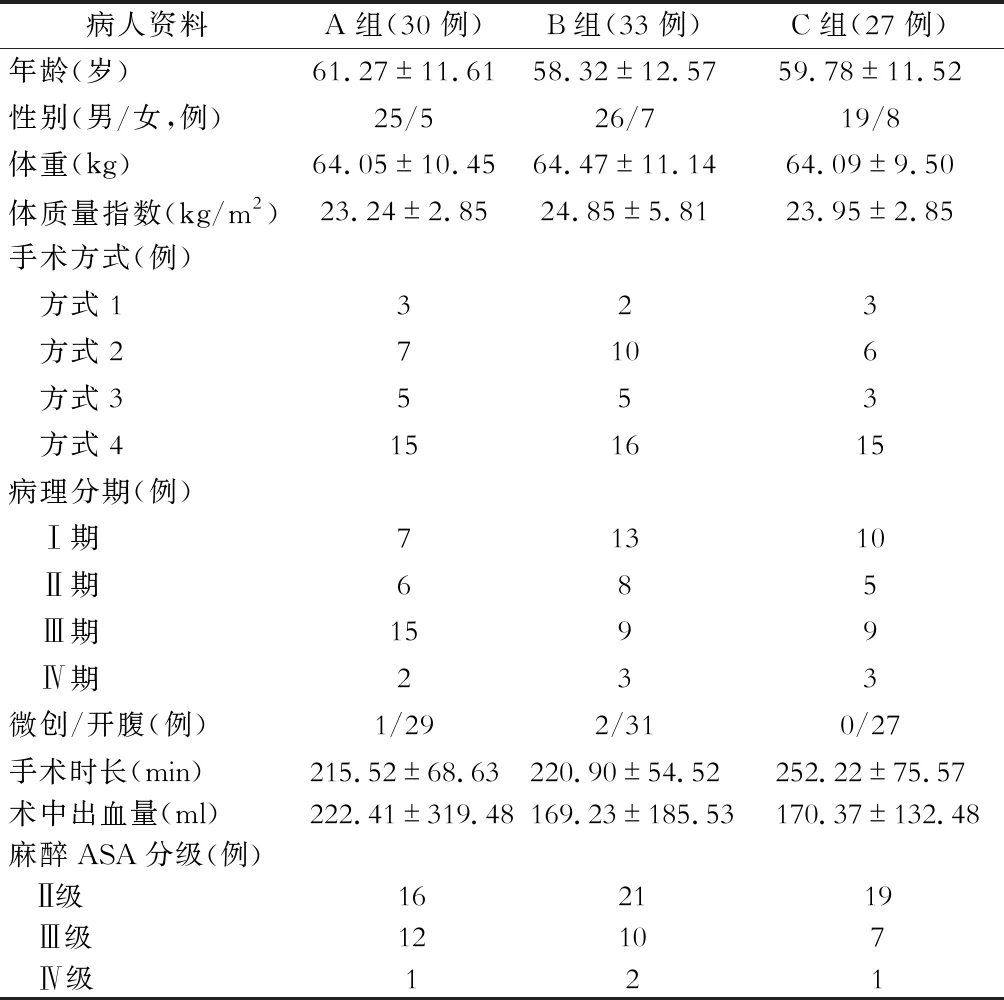
表2 三组病人基线情况比较
注:方式1.近端胃切除+双通道吻合术;方式2.远端胃切除+Roux-en-Y吻合术;方式3.远端胃切除+毕Ⅱ式吻合术;方式4.全胃切除+ Roux-en-Y吻合术
术后:术后第1、7天的血红蛋白、白蛋白、总白蛋白、前白蛋白;术后第 1、3、7天清晨空腹血糖及血清胰岛素水平,胰岛素敏感性以空腹血糖与血清胰岛素乘积的倒数(×1 000)计算;术后第7天体重、BMI、TSF、上臂围、上臂肌围、非利手(或非损伤手)握力;术后腹泻、腹胀、胃瘫、消化道瘘、感染等并发症的例数;术后肠功能恢复首次排气、排便时间、恢复流质时间、耐受流质时间、术后住院时长。
六、统计学处理
结 果
一、营养相关指标
三组病人的血红蛋白、血清白蛋白、总白蛋白以及前白蛋白均在术后第1 天较术前有不同程度的下降,三组间差异无统计学意义(P>0.05)。其中血清白蛋白、总白蛋白以及前白蛋白水平,经术后第7 天营养支持后有所上升,组间差异无统计学意义(P>0.05),见表3。
二、胰岛素抵抗相关指标
三组病人的血糖、血清胰岛素水平均在术后第1天较术前明显上升,术后第3天、第7天进行性下降,组间差异无统计学意义(P>0.05)。三组胰岛素敏感指数均在术后第1天明显下降,术后第3天、第7天逐渐上升,组间差异无统计学意义(P>0.05),见表4。
三、人体测量指标和握力
三组病人术后体重、BMI、上臂围、TSF、上臂肌围、握力较术前均有下降,组间差异无统计学意义(P>0.05),见表5。
四、人体成分分析指标
三组病人术后蛋白质、体脂肪、骨骼肌、肌肉量、去脂体重及基础代谢率较术前均有下降,组间差异无统计学意义(P>0.05),见表6。
五、临床结局指标的比较
三组病人术后并发症的发生情况,以及排气、排便、恢复经口进食、术后住院时长等指标,见表7。①在所有观察的病人中,无一例发生死亡,术后不良反应以腹胀最为常见,发生率达18.9%。A组腹胀的发生例数显著低于B组(P<0.05),A组与C组间差异无统计学意义(P>0.05)。②除了腹胀,恶心呕吐的发生率为3.3%,三组各发生1例,三组间差异无统计学意义(P>0.05)。③术后并发症以感染、胃瘫、消化道瘘为主,术后感染的发生率为11.1%,

表3 三组病人实验室检查营养指标比较

表4 三组病人胰岛素抵抗情况比较

表5 三组病人人体测量指标和握力比较

表6 三组病人人体成分分析指标比较

表7 三组病人临床结局指标比较
注:与B组比较,aP<0.05
其中A组的感染发生例数显著低于B组(P<0.05),A组与C组、C组与B组,差异均无统计学意义(P>0.05)。④术后胃瘫的发生率为5.6%,A组胃瘫0例,B组5例,C组0例,其中A组、C组的胃瘫发生例数显著低于B组(P<0.05),A组、C组组间差异无统计学意义(P>0.05)。⑤术后十二指肠残端瘘的发生率为4.4%,三组间差异无统计学意义(P>0.05)。⑥术后恢复指标包括术后排气排便时间、恢复经口进食时间、平均住院时长。其中,排气时间C组
讨 论
胃癌胃切除病人易发生营养不良,发生率高达40%,严重影响术后并发症发生率及死亡率,营养支持治疗能够显著改善病人预后[3]。胃的功能于术后1~2 d恢复正常,而小肠的蠕动、消化、吸收功能术后6~8 h即可恢复,因此,胃癌病人术后早期营养支持是安全可行的[6-7]。对于术前存在营养不良的大手术病人,术前营养支持能降低手术并发症的发生率[8],然而对于术前无营养风险的病人,术前口服500 kcal/d的肠内营养制剂行肠道预适应是否能使病人获益是我们研究的目标之一。
本研究比较了三组不同肠内营养支持方式,对病人术后营养状况、胰岛素抵抗、并发症、术后住院时长等指标的影响。结果显示,三组病人的血清白蛋白、总白蛋白以及前白蛋白水平在经过7 d的营养支持后,较术后1 d有所上升,营养状况有所改善,但三组间差异无统计学意义,因此,对于术前无营养风险的病人术前给予肠道预适应,以及术后使用不同种类的等量肠内营养制剂对病人术后的营养状况改善无影响。
胃切除术后的血糖控制十分重要,基本上所有手术术后均有发生胰岛素抵抗的可能,这与手术规模以及术后并发症有关[3]。胰岛素抵抗会引起严重的代谢紊乱,影响糖、脂肪、蛋白质的正常代谢,出现高血糖、高胰岛素血症和高乳酸血症,对病人的病情恢复产生不良影响[9],有研究证实,术后早期肠内营养能够在一定时间内减少胰岛素抵抗的发生[10-11]。本研究结果显示,三组病人的血糖、血清胰岛素水平均在术后1 d明显上升,术后3 d、7 d下降;胰岛素敏感指数术后1 d明显下降,术后3 d、7 d逐渐上升。病人在经过1周的肠内营养支持后血糖水平以及胰岛素水平均有所改善,胰岛素敏感指数逐渐恢复,术后早期肠内营养能够改善病人术后的血糖及胰岛素水平,但是术前肠道预适应以及术后使用不同种类的非糖尿病适用型等量肠内营养制剂对病人术后的血糖、血清胰岛素水平及胰岛素敏感指数无显著影响。
术后早期肠内营养在改善胃肠道功能、恢复肛门排气及排便、进食时间提前等方面已得到肯定[12]。同时,给予肠内营养能够保护肠黏膜屏障功能,增加胃肠道血流并改善吻合口局部血液循环,促进吻合口愈合,减少感染、胃瘫、吻合口瘘的发生[13-14]。本研究结果显示,术前给予肠内营养进行预适应,可显著减少术后腹胀腹痛的发生,提高病人使用肠内营养的依从性,同时,胃瘫、感染等术后并发症的发生率亦明显减少,恢复经口进食时间明显提前,有利于病人的术后恢复。术后使用短肽型肠内营养剂较整蛋白型肠内营养剂而言,并发症的发生显著减少,腹痛腹胀的发生例数减少,恢复经口进食的时间亦有所提前,因此,术后选择短肽型肠内营养剂更有利于病人的恢复。
综上所述,对于术前无营养风险的病人,术前3 d常规口服肠内营养混悬液(TP-MCT)行肠道预适应,能够减少术后腹胀等消化道不良反应的发生,降低感染、胃瘫等并发症的发生率,尽早恢复病人经口进食,提高了病人术后使用肠内营养的依从性,有利于病人术后恢复。术前无肠道预适应病人,术后使用短肽型营养剂在不良反应、并发症的发生方面优于使用整蛋白型肠内营养剂,更有利于病人恢复。三种肠内营养支持方案围术期营养指标差异无统计学意义,营养支持效果相当。
