腹腔镜与开腹胃癌根治术后并发症的Clavien-Dindo分级及危险因素分析
2020-03-26陈杰李政焰季刚王士祺王娟赵青川
陈杰,李政焰,季刚,王士祺,王娟,赵青川
手术是胃癌治疗的主要手段[1]。近年来,腹腔镜手术已越来越广泛地应用于胃癌的外科治疗。腹腔镜手术的并发症及安全性已成为关注的焦点。Clavien-Dindo术后并发症分级系统[2]是目前国际上评价包括腹腔镜胃癌手术在内的术后并发症的最具公信力的标准。本研究通过回顾性分析本中心2 966例接受胃癌根治手术病人的资料,比较腹腔镜及开腹胃癌根治术后总体并发症以及严重并发症的发生情况,探讨发生术后并发症的危险因素。
资料与方法
一、临床资料
回顾性分析2009年2月至2016年3月在西京医院消化外科行胃癌根治性切除术的2 966例病人临床病理资料,所有病人均经病理确诊为胃癌,并行开腹或者腹腔镜胃癌根治术。胃癌TNM分期以第8版国际抗癌联盟(UICC)肿瘤分期标准为依据[3],清扫淋巴结分类后与标本送病理检测。本研究通过西京医院伦理委员会批准,术前所有病人自愿选择腹腔镜或开腹手术并签署书面手术知情同意书。
纳入标准:①病理确诊为原发性胃癌,病理分期T1~T4a,N0~N3,M0;②年龄18~75岁;③接受胃癌根治性切除术。排除标准:①合并严重系统性疾病、急诊手术者;②合并其他部位恶性病变者;③残胃癌、非腺癌者;④术前放、化疗者,联合重要脏器切除者;⑤资料缺失影响分析者。
根据手术方式分为腹腔镜组、开腹手术组。最终共2 966例病人纳入研究,其中腹腔镜组:687例,开腹组2 279例。采用倾向评分匹配法,对年龄、性别、美国麻醉医师协会(ASA)分级、胃切除范围、肿瘤分化、TNM分期、体质量指数(body mass index,BMI)、肿瘤大小等基线资料匹配后,共1 354例病人符合纳入及排除标准,两组各677例,病人基线资料见表1。
二、手术方式
所有手术均由西京医院消化外科手术团队完成,术者均具有5年以上胃外科手术经验。根据肿瘤大小和部位,依第4版日本胃癌治疗指南[4],胃切除范围分为:全胃切除、远端胃切除和近端胃切除(表1),危险因素分析时将近端与远端胃切除定义为部分胃切除;近端胃切除吻合方式:双通道吻合、食管残胃吻合、空肠间置吻合。所有纳入病例均达到切缘阴性。具体手术方法见本中心已发表文章[5-6]。进展期胃癌病人视病情在术后1个月左右开始接受化疗。
三、评价方法
主要评价术后并发症发生情况与严重程度及其相关的危险因素,并发症定义为术后30 d内发生的与手术相关的不良反应,类别按照2018年国际胃癌协会和日本胃癌协会制定的共识[7]分类。并发症严重程度采用Clavien-Dindo分级系统[2,8]评价。本研究将≥Ⅲa定义为严重并发症,如某病人有多种并发症则按最严重的并发症进行分级。
四、统计学分析

表1 病人一般资料统计
注:表中各项目的单位除已标注外,其余各项单位均为“[例(%)]”;ASA.美国麻醉医师协会;BMI.体质量指数
结 果
一、一般资料比较
匹配后两组病人年龄、性别、术前ASA评分、胃切除范围、肿瘤分化程度、TNM分期、肿瘤长径、术前体质量指数(BMI)等基线资料差异均无统计学意义(均P>0.05,表1)。开腹组与腹腔镜组病人术后住院时间分别为(8.3±5.8) d、(8.0±3.5) d,差异无统计学意义(P=0.212);淋巴结送检数两组差异亦无统计学意义(P=0.139,表1);腹腔镜组较开腹组病人手术时间长[(266.1±70.1) min比(186.7±55.7) min,P<0.01],术中估计出血量较少[(181.2±172.1) ml比(208.4±152.8) ml,P=0.002]。开腹组术后1例病人因切口裂开后抢救无效死亡,腹腔镜组1例病人因突发腹泻、多器官功能衰竭死亡,两组病人术后病死率差异无统计学意义(P>0.05,表2)。
二、依据Clavien-Dindo分级系统对并发症类别进行分析
按Clavien-Dindo分级系统对匹配后的样本按并发症类别进行比较,两组病人并发症例数之比如下(腹腔镜组∶开腹组),①≤Ⅱ级:切口并发症(9∶20)、肺部感染(15∶36)、腹腔感染(7∶8)、发热(>38 ℃)(4∶5)、贫血(15∶12)、呕吐(2∶3)、一过性肝功能损害(1∶3)、胸腔积液(3∶5)、吻合口出血(6∶8)、肠梗阻(6∶9)、低蛋白血症(2∶3)、淋巴瘘(3∶5)、吻合口狭窄(1∶3)、腹腔内出血(1∶1)、尿潴留(0∶1)、腹腔积液(1∶2);②Ⅲa级:胸腔积液(6∶7)、腹腔内出血(1∶0)、切口并发症(2∶1)、腹腔积液(3∶0)、吻合口瘘(11∶13)、吻合口出血(0∶2)、腹腔感染(1∶1);③Ⅲb级:切口并发症(1∶1)、腹腔感染(2∶1)、吻合口出血(2∶1)、腹腔内出血(1∶1)、肠梗阻(4∶1)、胰腺炎(0∶1)、下肢静脉血栓形成(2∶0)、吻合口瘘(2∶5);④Ⅳa级:心功能障碍(0∶1)、肺功能衰竭(0∶1)、肾衰竭(0∶1);⑤Ⅴ级:死亡(1∶1)。开腹组与腹腔镜组轻度并发症(Clavien-Dindo分级≤Ⅱ级)发生率分别为18.2%、11.2%,差异具有统计学意义(P<0.001),两组≥Ⅲa级并发症发生情况差异无统计学意义(P>0.05),详见表3。
三、按Clavien-Dindo分级标准依据病人一般资料及手术数据分别进行亚组分析
亚组分析显示在大多数亚组里腹腔镜组总体并发症发生风险低于开腹组(P<0.05),在女性、ASA分级Ⅲ级、TNM分期Ⅰ期、BMI≥24 kg/m2、远端胃切除、肿瘤长径<5 cm、手术时间<180 min、送检淋巴结数目<25枚等亚组内差异无统计学意义(P>0.05);在对严重并发症进行分析时发现除送检淋巴结数目≥25枚亚组腹腔镜组严重并发症发生率低于开腹组外(P=0.001),其余各亚组发生率差异均无统计学意义。亚组分析情况见表4、表5。

表2 两组病人术后并发症情况[例(%)]
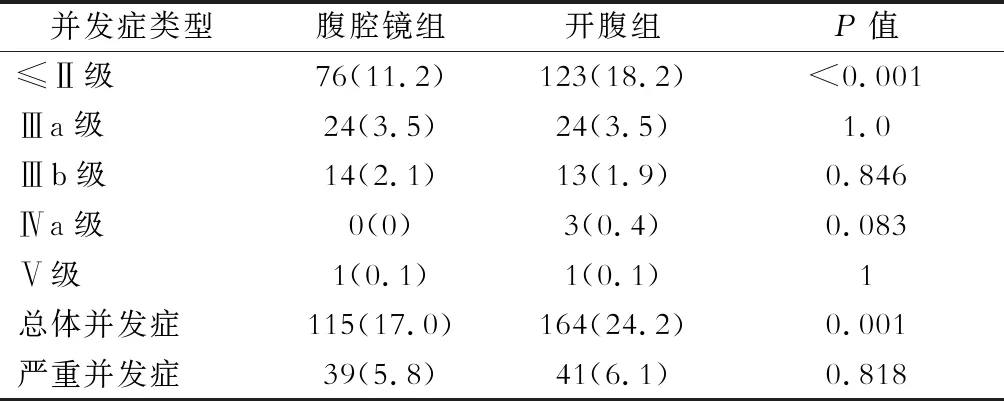
表3 根据Clavien-Dindo分级系统对并发症类别 进行评价[例(%)]

表4 总体并发症发生率亚组分析
注:OR.比值比;CI.置信区间; ASA.美国麻醉医师协会;BMI.体质量指数

表5 严重并发症发生率亚组分析
注:OR.比值比;CI.置信区间; ASA.美国麻醉医师协会;BMI.体质量指数
四、并发症发生的危险因素的单因素和多因素分析
单因素分析显示:年龄、胃切除范围、ASA分级、肿瘤长径、T分期、TNM分期、术中出血、手术方式与术后总体并发症相关,年龄、胃切除范围、肿瘤长径、T分期、TNM分期、术中出血量与术后严重并发症相关(P<0.05)。多因素分析显示:腹腔镜手术为术后并发症减少的保护性因素,年龄≥60岁、ASA分级Ⅲ级、术中出血≥200 ml为总体并发症的独立危险因素,年龄≥60岁、T2~T4a期、术中出血≥200 ml是严重并发症的独立危险因素(表6)。
讨 论
腹腔镜现已广泛地应用于胃癌的外科治疗[5-6,9-11]。Clavien-Dindo术后并发症分级系统是目前国际上评价包括胃癌手术在内的术后并发症的最具公信力的标准[2,8,12-13]。术后远期生存率及手术的安全性是外科医师关注的焦点,已有研究证实腹腔镜胃癌根治术远期预后不差于开腹手术[14-15]。手术后近期疗效主要以并发症发生情况以及术后康复情况来评价,本研究主要分析了腹腔镜与开腹胃癌根治术后近期并发症发生情况的差异,结果显示腹腔镜组术后总体并发症、术中出血量低于开腹组,并具有良好的微创效果。
目前关于腹腔镜应用于胃癌根治术安全性的研究结论尚不统一。Kim等[16]研究认为腹腔镜与开腹远端胃切除术后并发症发生率和死亡率差异均无统计学意义,其观点与Yasunaga等[17]、Shinohara等[18]的研究及Best等[19]系统综述结论一致。但Lee等[20]研究显示远端胃切除手术病人腹腔镜组总体并发症、严重并发症发生率均较低,与Zou等[21]Meta分析结果类似。Higgins等[22]研究认为相对于开腹组,腹腔镜组并发症更少[OR=0.61,95%CI(0.45,0.82),P=0.001],病死率差异无统计学意义[OR=0.74,95%CI(0.32,1.72),P=0.481]。从术后康复的角度,Yasunaga等[17]研究认为,对于早期胃癌远端胃切除病人,腹腔镜手术可缩短术后住院时间 (13 d比15 d,P<0.001)。虽然Shinohara等[18]研究显示腹腔镜与开腹胃癌手术病人术后并发症发生率、病死率差异无统计学意义,但腹腔镜组肠功能恢复更快、住院时间更短。Tu等[23]认为腹腔镜与开腹手术后并发症发生率差异无统计学意义(14.2%比16.5%,P=0.093),但出现并发症后开腹手术组死亡率更高(0.3%比1.2%,P=0.004)。Huscher等[24]研究认为腹腔镜与开腹胃癌根治术后死亡率、并发症发生率差异虽无统计学意义,但腹腔镜组术中出血少、康复较快。考虑到以上不同结论可能由于腹腔镜和开腹术后并发症的定义和分类无统一标准造成,本研究应用Clavien-Dindo分级系统这一评价手术安全性的通用标准,并依据基线资料对病人进行倾向评分匹配,按并发症类型及严重程度分析发生率及其相关的危险因素。

表6 胃癌术后发生并发症的危险因素的单因素和多因素分析
注:OR.比值比;CI.置信区间; ASA.美国麻醉医师协会;BMI.体质量指数
与现有研究[5,25-26]结论一致,本研究发现腹腔镜可以与开腹胃癌根治术淋巴结清扫数目(24.8±7.1比25.5±8.5,P=0.139)达到同样的效果。与当前研究[18,23-24]结论不完全一致的是,本研究发现腹腔镜手术为术后并发症减少的保护性因素,腹腔镜组与开腹组病人总体并发症发生率比较(17%比24.2%,P=0.001),差异具有统计学意义,但严重并发症发生率(5.8%比6.1%,P=0.818)差异无统计学意义,腹腔镜组病人术后Clavien-Dindo评分≤Ⅱ级的并发症发生率明显低于开腹组,主要体现在轻度切口并发症、发热、肺部感染等发生率明显较低,可能与腹腔镜切口较小,术后疼痛较轻,利于病人术后咳嗽排痰、切口愈合,应激反应较低等因素有关。本研究中两组病人严重并发症的发生率差异无统计学意义。这一结果也与文献[22]的研究结果相似。
此外,本研究显示术前ASA评分≥Ⅲ级是术后总体并发症的独立危险因素,可能由于ASA评分越高合并症越多导致,有学者[27-28]也认为胃癌术后并发症的发生与合并症相关。年龄≥60岁为术后总体并发症及严重并发症的独立危险因素,可能与老年病人身体耐受性较差所致,这一点也得到其他研究支持[29-30],本研究中pTNM分期是严重并发症的独立危险因素,与Nevo等[31]的研究结论相似。本研究还发现:相对于开腹手术病人,腹腔镜手术病人手术时间明显较长,特别是在本中心开展腹腔镜手术初期,但手术时间似乎与术后并发症无明显关联,与Watanabe等[32]的研究结论一致。且本研究可看出腹腔镜手术方法存在一定的微创优势,如术中出血量少,总体并发症少,并且已有学者证实随着腹腔镜技术的发展、术者手术熟练程度的提高,可明显缩短手术时间[33-34]。
综上,相对于传统开腹手术,腹腔镜胃癌根治术术后总体并发症发生率低,术中出血量少,安全可行且具有微创优势。
