亚硫酸钙两步法制备高浓度亚硫酸氢钠溶液
2020-03-21李文俊王金玉李洪玲洪成林但建明乔秀文
李文俊,王金玉,李洪玲,洪成林,但建明,乔秀文
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地,新疆石河子832003)
中国大型PVC 企业一般都建有配套的燃煤电厂。 电厂燃煤排放烟气中的SO2一般采用石灰石/石灰-石膏湿法脱硫,脱硫过程中SO2首先被吸收生成CaSO3,然后通过大功率风机氧化为脱硫石膏[1]。 目前,中国脱硫石膏的综合利用率较低[2],特别是在北方地区利用率更低。 同时,PVC 企业在烧碱生产除杂和氯乙烯干燥过程中会产生大量芒硝和废硫酸[3],目前这两种副产物均没有较好的处理方法,对当地环境和企业可持续发展产生负面影响。 如何有效地将脱硫中间副产物CaSO3和副产物芒硝及废硫酸的利用结合起来,成为值得研究的课题。
亚硫酸氢钠是一种常用的基础化工产品, 在有机物漂白、化学还原、食品防腐消毒、废水处理等方面得到广泛应用,年使用量在千万吨以上[4]。 吕凯等[5]利用烟气脱硫中间产物亚硫酸钙与芒硝和硫酸制备NaHSO3溶液,优化条件下制备的NaHSO3质量浓度达到206 g/L,为3 种工业副产物的循环利用提供了一种有效的方法。 但是,该方法制得的NaHSO3溶液未达到饱和,对后续蒸发工序和能耗影响较大。为简化后续的浓缩工序和降低结晶能耗, 笔者采用两步法制备接近饱和的NaHSO3溶液, 以降低其生产能耗。 第一步,利用CaSO3、芒硝和硫酸制备低浓度的NaHSO3溶液;第二步,在第一步制备的低浓度NaHSO3溶液中加入CaSO3固体,再滴加相应量的芒硝和硫酸,反应后得到接近饱和的NaHSO3溶液。 通过两步法制备接近饱和的NaHSO3溶液,不但循环利用了PVC 企业的副产物,减少了其对环境的污染,同时生产出附加值较高的NaHSO3,符合环保型经济理念,具有显著的经济、环保和社会意义。
1 实验部分
1.1 试剂和仪器
试剂:CaSO3(化学纯);H2SO4(分析纯);Na2SO4(分析纯);CaSO4·2H2O(分析纯);可溶性淀粉(分析纯);Na2CO3(分析纯);NaHSO3(分析纯);Na2S2O3(分析纯);KI(分析纯);I2(分析纯)。
仪器:JB-10 型磁力搅拌器;RW 20 digital IKA型机械搅拌器;RCT basic IKA 型搅拌恒温水浴锅;GZX-9140 MBE 数显鼓风干燥箱。
1.2 实验原理和实验方法
1.2.1 实验原理
以脱硫中间产物CaSO3为原料, 在其中加入Na2SO4-H2SO4混合溶液进行反应, 制备NaHSO3溶液。 反应方程式:
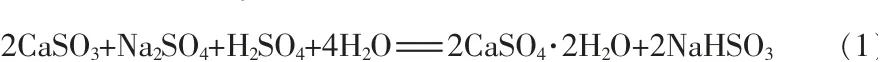
1.2.2 实验方法
1)制备低浓度的NaHSO3溶液。称取一定量CaSO3置于烧杯中,加入40 mL 水,使用机械搅拌器或磁力搅拌器以400 r/min 搅拌15 min。称取一定量Na2SO4,溶入适量3 mol/L 硫酸中。 将Na2SO4-H2SO4混合溶液滴入CaSO3悬浮液中,60~90 min 滴加完,反应30 min,减压抽滤,并用蒸馏水洗涤3~4 次,将滤液定容至250 mL 容量瓶中,参照文献[6]方法,采用间接碘量法测定NaHSO3溶液质量浓度。
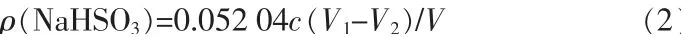
式中:ρ 为NaHSO3溶液质量浓度,g/L;V1为空白试验消耗硫代硫酸钠标准溶液体积,mL;V2为加样后消耗硫代硫酸钠标准溶液体积,mL;c为硫代硫酸钠标准溶液浓度,mol/L;V为NaHSO3溶液体积,L。分别考察CaSO3加入量、反应温度、反应时间及CaSO3悬浮液质量分数对NaHSO3溶液质量浓度的影响。
2)制备高浓度的NaHSO3溶液。 模拟1.2.1 节制备的低浓度NaHSO3溶液,配制不同质量浓度的NaHSO3稀溶液,加入CaSO3配制悬浮液,滴加Na2SO4-H2SO4混合溶液,制备高浓度的NaHSO3溶液,考察低浓度的NaHSO3溶液质量浓度对制备高浓度NaHSO3溶液质量浓度的影响。
2 结果与讨论
2.1 制备低浓度的NaHSO3 溶液
2.1.1 CaSO3加入量的影响
固定条件:CaSO3悬浮液质量分数为22%,反应温度为室温,反应时间为30 min,搅拌转速为400 r/min,滴加Na2SO4-H2SO4溶液15 mL(浓度为3 mol/L,物质的量比为1∶1)。 考察CaSO3加入量对NaHSO3溶液质量浓度的影响,实验结果见图1。 由图1 可知, 当CaSO3加入量为0.052~0.068 mol 时,NaHSO3溶液质量浓度随CaSO3加入量的增加而逐渐增大,由55 g/L 上升至116 g/L;当CaSO3加入量超过0.068 mol 后,NaHSO3溶液质量浓度开始降低。
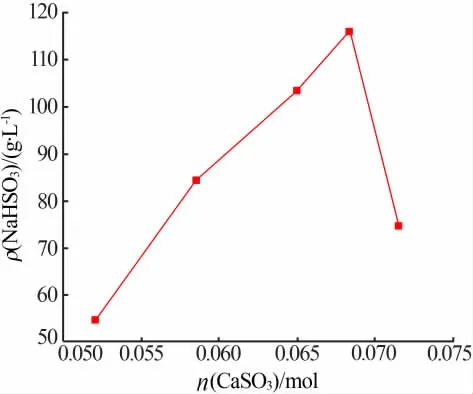
图1 CaSO3 加入量对NaHSO3 溶液质量浓度的影响
滴加定量的Na2SO4-H2SO4混合溶液时,当CaSO3加入量为0.052 mol 时,CaSO3加入量低于化学反应式(1)所需的比例,导致CaSO3用量不足,而Na2SO4-H2SO4混合溶液过剩, 故此时NaHSO3溶液浓度最低。 当CaSO3加入量超过0.068 mol 时,一是CaSO3的加入会吸附大量的水, 二是生成的石膏需要结合水,导致反应体系粘度太大,使得搅拌困难,造成局部H2SO4混合溶液浓度过高,使生成的NaHSO3分解释放二氧化硫,降低最终NaHSO3溶液的浓度。 此外,反应体系自由水过少,反应体系粘度过大,造成过滤困难,滤液较少,虽然采取洗涤工艺,但整体得到的滤液依然较少, 故导致最终NaHSO3浓度较低。 因此,选择CaSO3加入量为0.068 mol。
2.1.2 反应温度的影响
固定条件:CaSO3悬浮液质量分数为22%,CaSO3加入量为0.068 mol,反应时间为30 min,搅拌速度为400 r/min,滴加Na2SO4-H2SO4溶液15 mL(浓度为3 mol/L、 物质的量比为1∶1)。 考察反应温度对NaHSO3溶液质量浓度的影响,实验结果见图2。 由图2 可知,在0~13 ℃时,NaHSO3溶液质量浓度随温度的升高呈现上升趋势,由约100 g/L 上升到136 g/L。当反应温度超过13 ℃时,NaHSO3溶液质量浓度随温度的升高而下降。
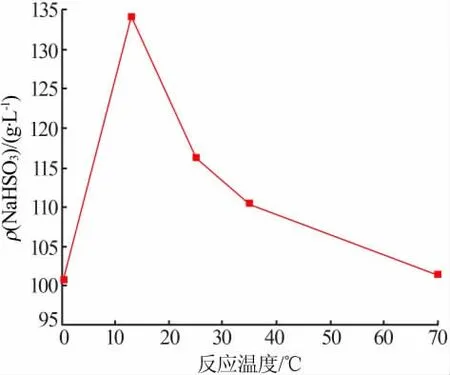
图2 反应温度对NaHSO3 溶液质量浓度的影响
在0~13 ℃时, 升高温度可以提高反应速率,使反应正向进行,NaHSO3溶液质量浓度随温度的升高而上升。当反应温度进一步升高后,一方面反应为放热反应,升温会使反应逆向进行,导致NaHSO3溶液浓度降低;另一方面,温度升高,促进NaHSO3分解溢出SO2,从而降低NaHSO3溶液浓度。因此,实际生产中控制反应温度为10~15 ℃。
2.1.3 反应时间的影响
固定条件:CaSO3悬浮液质量分数为22%,CaSO3加入量为0.068 mol,反应温度为13 ℃,搅拌速度为400 r/min, 滴加Na2SO4-H2SO4溶液15 mL(浓度为3 mol/L,物质的量比为1∶1)。 考察反应时间对NaHSO3溶液质量浓度的影响, 实验结果见图3。由图3 可知,反应时间为30 min 前,NaHSO3溶液质量浓度随反应时间的增加而逐渐增大,30 min 之后NaHSO3溶液质量浓度开始逐渐减低,NaHSO3溶液质量浓度在30 min 时达到峰值(130.4 g/L)。
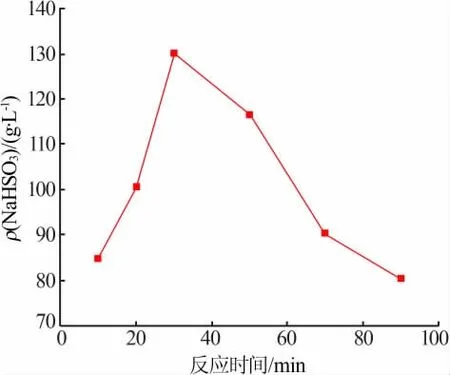
图3 反应时间对NaHSO3 溶液质量浓度的影响
随着反应时间的延长生成物越来越多,在0~30 min 内NaHSO3溶液质量浓度随着反应时间的增加而逐渐增大。按照反应方程式(1)中物质的量比可知,反应体系中CaSO3加入量不足,而Na2SO4-H2SO4混合溶液是过量的,故当反应时间超过30 min 后,多余的H2SO4与生成的NaHSO3反应生成SO2而逸出,从而导致NaHSO3溶液浓度降低, 并且反应时间越长逸出SO2越多,NaHSO3溶液浓度降低幅度越大。
2.1.4 CaSO3悬浮液质量分数的影响
固定条件:CaSO3加入量为0.068 mol,反应温度为13 ℃,反应时间为30 min,搅拌转速为400 r/min,滴加Na2SO4-H2SO4溶液15 mL(浓度为3 mol/L,物质的量比为1∶1)。 考察CaSO3悬浮液质量分数对NaHSO3溶液质量浓度的影响,实验结果见图4。 由图4 可知,随着CaSO3质量分数逐渐上升,NaHSO3溶液质量浓度也在逐渐上升。 CaSO3质量分数从22%上升到25%时,NaHSO3溶液质量浓度达到198.2 g/L,此区间溶液浓度上升最快。 CaSO3质量分数为28%时,NaHSO3溶液质量浓度达到203 g/L,浓度增加不多。 另外,随着CaSO3质量分数进一步提高,会导致体系太过粘稠, 抽滤或压滤出来的NaHSO3溶液体积太小,导致NaHSO3收率降低,如果多次洗涤则会稀释NaHSO3溶液浓度。 综合考虑浓度和收率,选择质量分数为25%的CaSO3悬浮液较为合适, 此时NaHSO3溶液质量浓度接近200 g/L。
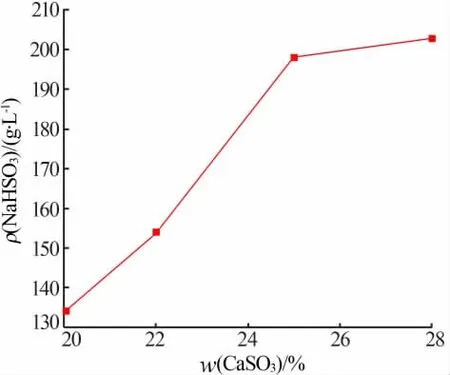
图4 CaSO3 质量分数对NaHSO3 溶液质量浓度的影响
2.2 制备高浓度的NaHSO3 溶液
由图1~图4 看出,CaSO3悬浮液与Na2SO4-H2SO4混合溶液一步复分解反应得到的NaHSO3质量浓度一般不超过200 g/L,未达到饱和浓度,此时蒸发浓缩需要消耗较高的能量。 为进一步提高NaHSO3浓度, 采用第一步制备的NaHSO3溶液配制CaSO3悬浮液,然后与Na2SO4-H2SO4混合溶液反应制备高浓度的NaHSO3溶液。
利用化学纯NaHSO3配制不同浓度的NaHSO3溶液,模拟第一步制备的NaHSO3溶液。 固定条件:反应温度为13 ℃,反应时间为30 min,搅拌转速为400 r/min。 考察初始NaHSO3溶液质量浓度对最终NaHSO3溶液质量浓度的影响。 实验结果见图5。
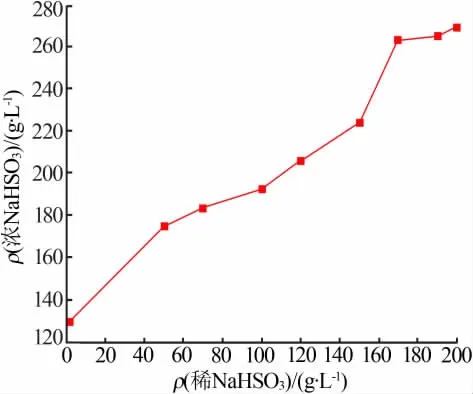
图5 NaHSO3 稀溶液质量浓度对NaHSO3浓溶液质量浓度的影响
由图5 可知,NaHSO3稀溶液质量浓度为50~170 g/L 时, 经过第二步反应制备的NaHSO3浓溶液质量浓度增加较快;NaHSO3稀溶液质量浓度为190~200 g/L 时,第二步反应得到的NaHSO3浓溶液质量浓度增加平缓。 第一步制备的NaHSO3稀溶液质量浓度为170 g/L 时,反应后制备的NaHSO3浓溶液质量浓度达到264.2 g/L,接近饱和,为后续浓缩结晶提供了条件。 第一步制备的NaHSO3稀溶液质量浓度为200 g/L 时,反应后制备的NaHSO3浓溶液质量浓度达到270.3 g/L,增加幅度较小。第一步制备的NaHSO3溶液浓度太高,反应体系粘稠度提高,导致最终NaHSO3收率较低。 故实际生产中第一步制备的NaHSO3溶液质量浓度控制在170 g/L 时较为合适。
3 结论
1)利用脱硫中间体CaSO3和氯碱副产物芒硝和废硫酸采用两步法制备高浓度的NaHSO3溶液。第一步反应, 在反应温度为13 ℃、CaSO3加入量为0.068 mol、CaSO3悬浮液质量分数为25%、反应时间为30 min 条件下, 制备的NaHSO3稀溶液质量浓度达到198.2 g/L。 当第一步制备的NaHSO3稀溶液质量浓度为170 g/L 时,第二步制备的NaHSO3浓溶液质量浓度达到264.2 g/L,接近饱和。
2)采用两步法制备高浓度的NaHSO3溶液,避免了一步法反应体系粘稠而导致NaHSO3收率较低的缺陷,提高了最终NaHSO3溶液的浓度,质量浓度达到264.2 g/L,接近饱和浓度,简化了后续的浓缩工序并降低了能耗,具有显著的经济效益和社会效益。
