叠氮化钠对荧光性晚期糖基化终末产物的影响
2020-03-13杨玉莹朴春红王玉华刘俊梅胡洋唐玉芳
杨玉莹,朴春红,王玉华,刘俊梅,胡洋,唐玉芳
吉林农业大学食品科学与工程学院(长春 130118)
蛋白质非酶糖基化通常指在非酶促条件下,氨基酸或蛋白质的游离氨基与葡萄糖(Glucose)或果糖(Fructose)等还原糖,经缩合、重排、裂解、氧化修饰产生一系列稳定产物的反应,其终产物被称为晚期糖基化终末产物(Advanced glycation end products,AGEs)[1-2]。高血糖糖尿病患者体内的AGEs大量蓄积会引发糖尿病并发症,如糖尿病性肾病、周围神经病变和心血管疾病等[3-6]。在食品加工中尤其是高温和长时间反应下产生的AGEs,可以被人体吸收,引发阿尔茨海默病等多种疾病[7],受到广泛关注[8]。
AGEs的生成机制复杂,产物也不同,具有交联性或荧光性特性,一旦形成就不可逆,在人体内以多种不同形式存在[9-11]。其反应历程可分为3个阶段[12-13]:初期阶段、中期阶段和末期阶段。目前,很多带荧光性的AGEs已经成为研究主流。还原糖-蛋白质体系形成的AGEs能反映体内糖基化反应水平,常用于AGEs相关研究中。最为常见的糖基化体系中的还原糖为葡萄糖或果糖,蛋白质为牛血清白蛋白(Bovine serum albumin,BSA),其反应温度为接近人体体温37 ℃,时间为一般为4~12周[14-15]。由于反应体系中含有较高浓度的糖和蛋白质,且反应时间较长,极易滋生细菌,因此培养时常加入叠氮化钠(NaN3)达到抑菌的目的[16-17]。NaN3具有优良的防腐杀菌性能,但尚未有报道表明其在非酶糖基化反应进程中是否影响模拟体内真正的糖基化反应进程。微孔滤膜抽滤(Microaperture section filter,MSF)灭菌方式是最接近机体产生的AGEs的最优灭菌方法。体内AGEs的积累是一个长期而缓慢的过程,随着反应时间的延长蛋白修饰程度增强,产生高度糖基化的AGEs[18]。试验采用MSF和NaN3灭菌方式,研究了两种糖基化体系即葡萄糖-牛血清白蛋白(AGE-G-BSA)和果糖-牛血清白蛋白(AGE-F-BSA)反应体系在1~6个月期间AGEs生成的情况以及AGEs特性的变化,为系统的研究AGEs提供可参考的理论依据。
1 材料与方法
1.1 试验试剂
葡萄糖、叠氮化钠、L-赖氨酸、邻苯二甲醛、β巯基乙醇,北京化工厂;D-果糖、牛血清白蛋白标准品≥96%、Fructose Assay Kit,美国Sigma试剂公司;彩虹245广谱蛋白Maker,北京索莱宝科技有限公司;SDS-PAGE凝胶配制试剂盒、BCA蛋白定量测定试剂盒,北京鼎国昌盛生物技术有限责任公司;葡萄糖测定试剂盒,上海荣盛生物技术有限公司。所有试剂纯度均为分析纯。
1.2 试验仪器
3K15离心机,美国Sigma公司;ZHWY-200 B恒温培养振荡器,上海智城分析仪器制造有限公司;SYNERGYHT多功能酶标仪,美国伯腾仪器有限公司;FLUO star Omega全自动多功能酶标仪,德国BMG LABTECH;5800 MALDI-TOF/TOF基质辅助激光质谱仪,美国AB SCIEX;Mini-PROTEAN Tetra Cell小型垂直电泳槽,美国BIO-RAD;Mini BIS Pro以色列DNR凝胶成像仪,以色列DNR成像系统有限公司。
1.3 试验方法
1.3.1 叠氮化钠条件下体外非酶糖基化体系的建立
参照Wang等[19]的方法,稍作修改。向5 mL质量浓度为90 mg/mL的葡萄糖(Glucose,G)或果糖(Fructose,F)溶液中加入10 mL质量浓度为10.00 mg/mL的BSA溶液,混合均匀后在37 ℃条件下避光反应6个月,这期间分别在第1,第2,第3,第4,第5和第6个月取出部分样品,暂存于-80 ℃。
1.3.2 微孔滤膜抽滤条件下体外非酶糖基化体系的建立
参照1.3.1采用微孔滤膜抽滤的方式对反应试剂灭菌。具体为,采用不含NaN3的磷酸盐缓冲液配置反应试剂,随后将反应试剂依次通过孔径为0.45和0.22 μm的微孔滤膜,混合均匀后在37 ℃条件下避光反应6个月,这期间分别在第1,第2,第3,第4,第5和第6个月取出部分样品,暂存于-80 ℃。
1.3.3 体系中AGEs含量的测定
利用荧光酶标仪在增益50,激发波长355 nm,发射波长460 nm处测定体系的荧光值。同时以磷酸盐缓冲溶液作为空白测定空白组荧光值。
1.3.4 AGEs分子量分析
使用BCA蛋白定量测定试剂盒测定样品的蛋白浓度,确定样品的稀释倍数后分别进行Native-PAGE电泳以及SDS-PAGE凝胶电泳[15,20]。
通过基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF/TOF)在正离子模式下选择线性方法对体系蛋白分子量进行分析[20],试验产生的原始数据及图谱由4000 Series Explorer V 3.5软件导出。
1.3.5 AGEs还原糖测定
分别使用葡萄糖测定试剂盒(葡萄糖氧化酶-过氧化物酶法)及Fructose Assay Kit对体系中的葡萄糖、果糖含量分别进行测定。
1.3.6 AGEs游离氨基测定
采用邻苯二甲醛(OPA)法测定体系中游离氨基的含量[21-22]。取4.0 mL OPA试剂于试管中,加入200 μL样品,对照组加入相同体积的蒸馏水,混合均匀后,在35 ℃水浴条件下反应2 min,随后利用酶标仪测定体系在340 nm处的吸光度A340,以赖氨酸代替样品采用相同方法制作标准曲线,根据曲线计算游离氨基含量。其计算公式如下:

式中:N为反应后体系游离氨基浓度;N空白为空白组中游离氨基浓度。
1.4 统计分析
所有的试验均进行3次重复,数据均以平均值±标准偏差表示,利用Graphpad Prism 5软件绘图。利用SPSS Statistics 19软件进行数据处理并检验数据间的差异显著性(p<0.05)。
2 结果与分析
2.1 不同灭菌方式对AGEs荧光值的影响
AGEs是一类复杂的混合物,其中含有大量的具有荧光交联性的物质,如戊糖素,因此荧光值成为AGEs量化的重要指标[9,23]。两种还原糖与BSA在1~6个月期间产生的荧光值的变化情况如图1所示。总体上AGE-F-BSA体系的荧光值显著高于AGE-G-BSA体系,该结果与李晓明等[24]的结论一致,证实了果糖更容易引发牛血清白蛋白糖基化而且反应相对剧烈,可产生较多的AGEs。在AGE-G-BSA体系中,荧光值随反应时间的延长大体呈现增长趋势,只是第5个月时略有下降,当第6个月时MSF灭菌条件下其荧光值为132 916.67±50.00(p<0.05),为反应1个月时的3倍以上(图1A)。但是在AGE-F-BSA体系中,荧光值的变化与AGE-G-BSA呈现不同的趋势,NaN3存在对其荧光值变化产生重大的影响,即无NaN3时,AGEF-BSA第3个月荧光值基本达到饱和,而NaN3存在条件下,荧光值呈现以3个月为周期的周期性变化(图1B)。刘贵梅等[25]采用酪蛋白分别与甲基乙二醛、乙二醛在37 ℃条件下反应,结果表明两种体系的荧光值均在反应第20天达到最大,而当反应进行到30 d时荧光值显著减少(p<0.05),与研究结果有相似之处。这可能与非酶糖基化反应复杂,部分反应产物在达到一定反应时间时发生了降解或荧光交联键断裂有关,具体原因还需进一步探究。
两个AGEs体系中,NaN3与MSF相比,其荧光值普遍较低,说明NaN3部分地影响了体系中AGEs的形成。又由于当反应时间为1、3、6个月时体系的荧光值可以反映整体AGEs产生情况,在接下来的试验中为了简化试验步骤,选择了具有代表性的1、3、6个月的体系进行进一步研究。

图1 非酶糖基化体系荧光值
2.2 不同灭菌方式对AGEs分子量的影响
AGEs的形成过程中会产生大量的交联产物,导致分子量的增加[26-28]。用Native-PAGE(图2A、B)及SDS-PAGE(图2C、D)分析在不同灭菌条件下两个体系中蛋白分子量的变化,发现三个时间段产生的AGEs与BSA相比无明显变化,并未出现孔阳辉[26],Kong等[29]报道中提到的97 kDa的片段。然而采用MALDITOF/TOF对蛋白分子量分析后发现,随着反应时间的增长,体系分子量逐渐增加,增加范围为23.36~1 765.68 Da(见表1)。Nagai等[18]报道轻度糖基化的AGEs(培养24周)和高度糖基化的AGEs(培养40周)与BSA相比蛋白分子量分别增加了658和9 389 Da,与试验结果趋势相似,表明随着反应时间的推进其蛋白糖基化修饰程度也随之增强。Annett[16]曾报道人血清白蛋白(HSA)与葡萄糖反应一个月后,其分子量与初始分子量相比增加了4 169 Da,高于试验结果。这可能是HSA和BSA与还原糖结合的游离氨基数量不同以及结构差异,导致糖基化程度不同。有趣的是,两个体系、两个灭菌方式对分子量的增加均呈现不同的趋势。具体是,AGE-G-BSA体系的分子量均高于AGEF-BSA体系的分子量,MSF灭菌组的分子量高于NaN3灭菌组的分子量。在AGE-F-BSA体系中第1个月时的分子量甚至低于BSA。Annett[16]报道中提出荧光强度较高的体系其蛋白修饰水平并不高,这一现象与试验结果相似。这可能与非酶糖基化反应过程中不同修饰剂与蛋白间反应的比率不同有关。
2.3 不同灭菌方式对体系中还原糖含量的影响
还原糖的羰基是与蛋白的氨基结合生成荧光性AGEs的重要活性基团,在AGEs生成过程中,随着反应时间的延长果糖参加反应不断消耗导致果糖含量减少[30]。图3为非酶糖基化体系中剩余葡萄糖含量的变化,AGE-F-BSA体系中剩余果糖含量与AGE-G-BSA体系中剩余葡萄糖含量趋势基本一致,即在反应时间为1个月时,两个体系中NaN3和MSF条件下残留还原糖含量均约为反应初始质量浓度(30.00 mg/mL)的2%,这表明非酶糖基化反应在1个月时,其还原糖的利用已经基本达到了饱和状态,在随后反应时间为3、6个月的体系中,还原糖含量基本无显著变化(p>0.05)。这些数据表明添加NaN3并未显著影响荧光性AGEs形成时还原糖的消耗进程。
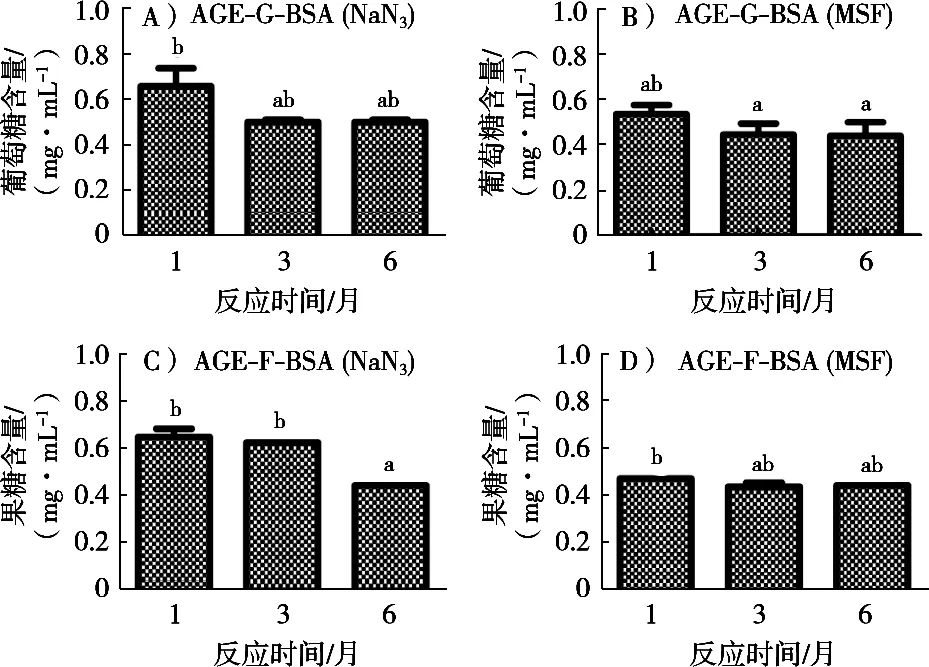
图3 非酶糖基化体系葡萄糖含量
2.4 不同灭菌方式对体系中游离氨基含量的影响
BSA分子结构中的游离氨基是荧光性AGEs生成所必须的活性基团,BSA浓度越高,氨基基团浓度越大,使得反应物分子之间碰撞作用逐步增大加快反应速率,导致荧光性AGEs大量积累,因此游离氨基含量的变化常被用来表示蛋白质与糖接枝反应的程度[30]。由图4可知,随着反应时间的延长,AGE-G-BSA体系中的游离氨基逐渐减少,当反应6个月时,其游离氨基为反应前BSA的10.3%(NaN3条件,图4A)和6.4%(MSF条件,图4B),而AGE-F-BSA体系中,当糖基化反应进行到第1个月时,其游离氨基为原BSA的11.4%(NaN3条件,图4C)和10.0%(MSF条件,图4D),之后无显著变化,且两种灭菌条件下其变化趋势一致。这种变化规律也与体系荧光值的变化趋势一致(图1),表明游离氨基的含量与荧光性AGEs的形成进程密切相关,类似结果目前无相关报道。AGEG-BSA体系中MSF条件下的游离氨基均少于NaN3条件,说明NaN3对游离氨基的消耗有一定的制约作用。
3 结论
在1、3和6个月的BSA-还原糖非酶促反应发生过程中,AGE-G-BSA体系的荧光值逐渐增加,葡萄糖和游离氨基随着培养时间的增加而逐渐减少;而在AGE-F-BSA体系中,MSF条件下果糖含量无明显变化,体系的游离氨基含量在培养1个月时基本上达到最低,之后无显著变化。对于不同灭菌方式而言,NaN3对体系产物的形成具有一定的影响,且在AGEG-BSA和AGE-F-BSA体系中表现形式并不一致。MSF灭菌方式下对反应产生的AGEs并未见明显影响,因此研究AGEs需要考虑NaN3对AGEs形成的影响因素。试验主要针对荧光性AGEs的特性进行研究,并未涉及非荧光性AGEs。非荧光性AGEs,如羧甲基赖氨酸(Carboxy methyl lysine,CML),是主要的AGEs组分之一,是非荧光AGEs的代表,因此有必要对其进行系统的评估,这将是下一步的研究内容。
