大孔树脂初步纯化美洲合欢花花色苷
2020-03-13余亚选秦飞陈仲巍纪美茹
余亚选,秦飞,陈仲巍,纪美茹
厦门医学院(厦门 361023)
美洲合欢花(Calliandra haematocephala)又名朱樱花、美蕊花,除作为绿化观赏植物外[1],还具有一定的药效。现代研究表明,美洲合欢叶中含有黄酮及其苷类、苯丙素类、4, 5-二羟基-1-哌啶酸等化合物,这些提取物具有抗氧化、抗炎、杀菌等作用[2-4]。通过前期研究[5],发现美洲合欢花富含大量花色苷。
花色苷是花青素与糖类物质以糖苷键结合的一类化合物,广泛存在于自然界中的蔬菜、水果等植物中。花色苷具有一系列生物活性,可抗氧化[6-7]、消除自由基、延缓衰老、抗炎、抗肿瘤[8-9]、降低血糖[10]、增强人体免疫功能等[11],国内外将其应用到食品、化妆品、药品等多个领域。由于植物经过溶剂浸提法提取得到的花色苷通常含有糖、蛋白质及其他非花色苷类等杂质,这会影响花色苷的性质和应用,因此提取纯化活性花色苷类物质对于保健食品及药物的研发具有重要的现实意义。大孔吸附树脂是一类有机高分子聚合物吸附剂,通过吸附性和分子筛原理将具有一定极性的有机大分子物质进行分离。与现有的天然色素分离方法相比,因其具有吸附量大、吸附速度快、洗脱率高且能够再生使用等优点,因此被广泛应用于酚类、黄酮、色素等物质的吸附纯化研究中[12-14]。
文献检索未见美洲合欢花花色苷的相关研究报道,因此试验对美洲合欢花花色苷进行提取、纯化,对比8种大孔树脂对美洲合欢花花色苷纯化效果,重点研究大孔树脂D101纯化花色苷工艺,为美洲合欢花资源的发展、评价及利用提供理论依据。
1 材料与方法
1.1 材料与仪器
美洲合欢花,采摘于福建厦门集美区灌口镇,经厦门医学院鲍红娟副教授鉴定为豆科植物美洲合欢(Calliandra haematocephala)花冠;盐酸、无水乙醇、氢氧化钠、乙腈、甲酸等(国药集团化学试剂有限公司,分析纯);大孔树脂D101、AB-8、HPD-100、HPD-100A、HPD-200A、HPD-300、HPD-500、HPD-600(沧州宝恩吸附材料科技有限公司)。
N-1210B型旋转蒸发仪(EYELA);SQP型电子分析天平、PB-10型pH计(德国赛多利斯仪器有限公司);UV-1780型紫外-可见分光光度仪、Nexera X2 LC-30AD型高效液相色谱仪、Shim-pack XR-ODS Ⅲ色谱柱(75 mm×2.0 mm,1.6 μ m)(岛津)。
1.2 试验方法
1.2.1 花色苷的提取[5]
预处理:采摘后60 ℃烘干过夜,粉碎机进行磨粉处理,过40目筛,于干燥器中避光保存备用。准确称取1.000 g样品加入70 mL 60%乙醇溶液,通过6 mol/L盐酸溶液调至pH 2.0,于60 ℃水浴中回流60 min,抽滤,取滤液稀释至适当倍数,用紫外可见分光光度计于400~800 nm下进行光谱扫描,确定美洲合欢花色苷的最大吸收波长。将滤液置于40 ℃下真空浓缩,旋蒸至干后,冷冻干燥得到花色苷粗提样品,密封,避光下至于5 ℃冰箱中冷藏备用。
1.2.2 大孔树脂的筛选
1.2.2.1 大孔树脂的预处理
将大孔树脂D101、AB-8、HPD-100、HPD-100A、HPD-200A、HPD-300、HPD-500、HPD-600用95%乙醇浸泡过夜使其充分溶胀后,倒去上层液体,用蒸馏水洗至无醇味,依次用5% NaOH溶液浸泡后蒸馏水洗至中性,5% HCl溶液浸泡后蒸馏水洗至中性,备用。
1.2.2.2 大孔树脂的静态吸附率和解吸率比较测试
准确称取预处理好的8种供试大孔树脂各1.000 g(使用前用滤纸吸干树脂表面的水分)于锥形瓶中,加入25 mL美洲合欢花花色苷粗提液(质量浓度1.5 mg/mL、pH 2.0),在25 ℃、150 r/min水浴条件下振荡24 h至吸附平衡后过滤,测定滤液中花色苷吸光度,计算各树脂的吸附率。向吸附平衡树脂加入60%乙醇25 mL(盐酸调pH 2.0),振荡24 h后过滤,测定滤液中的花色苷吸光度,计算解吸率。

式中:A0为吸附前花色苷溶液吸光度;A1为吸附后花色苷溶液吸光度;A2为解吸后花色苷溶液吸光度。
1.2.3 大孔树脂D101静态吸附及解吸试验
1.2.3.1 吸附平衡时间的测定
准确称取5.000 g大孔树脂D101于锥形瓶中,加入125 mL美洲合欢花花色苷粗提液(质量浓度1.5 mg/mL、pH 2.0),在25 ℃、150 r/min水浴条件下振荡,每隔0.5 h取样测定溶液吸光度,计算吸附率。
1.2.3.2 解吸平衡时间的测定
准确称取吸附饱和树脂5.000 g于锥形瓶中,加入pH 2.0,60%乙醇溶液125 mL,在25 ℃水浴条件下振荡,每隔0.5 h取样测定溶液吸光度,计算解吸率。
1.2.3.3 上样浓度对大孔树脂吸附能力的影响
准确称取6份1.000 g大孔树脂D101于锥形瓶中,分别加入质量浓度为0.50,0.75,1.00,1.25,1.50,1.75,2.00,2.25和2.50 mg/mL(盐酸调pH 2.0)花色苷粗提液25 mL,在25 ℃、150 r/min水浴振荡4 h至吸附平衡后抽滤,测定滤液中花色苷吸光度,计算吸附率。
1.2.3.4 溶液pH对大孔树脂吸附能力的影响
准确称取6份1.000 g大孔树脂 D101于锥形瓶中,分别加入pH 1.0,2.0,3.0,4.0,5.0和6.0花色苷粗提液25 mL(质量浓度1.5 mg/mL),在25 ℃、150 r/min水浴条件下振荡4 h至吸附平衡后抽滤,测定滤液中花色苷吸光度,计算吸附率。
1.2.3.5 乙醇浓度对大孔树脂解吸能力的影响
准确称取6份吸附饱和树脂1.000 g于锥形瓶中,分别加入30%,40%,50%,60%,70%和80%乙醇溶液(盐酸调pH 2.0)25 mL,在25 ℃、150 r/min水浴条件下振荡6 h后测定溶液吸光度,计算解吸率。
1.2.3.6 溶液pH对大孔树脂解吸能力的影响
准确称取6份吸附饱和树脂1.000 g于锥形瓶中,分别加入pH 1.0,2.0,3.0,4.0,5.0和6.0的60%乙醇溶液25 mL,在25 ℃水浴条件下振荡6 h后测定溶液吸光度,计算解吸率。
1.2.4 大孔树脂D101动态吸附及解吸试验
1.2.4.1 上样流速对大孔树脂吸附和能力的影响
称取一定量树脂D101,湿法装柱,用恒流泵控制不同的流速(1,2和3 mL/min),使花色苷粗提液上柱吸附,用自动部分收集器以每管10 mL收集流出液,流出液在530 nm波长处吸光度达到花色苷原液吸光度的10%时,记录泄漏点(V,mL)。
1.2.4.2 洗脱流速对解吸率的影响
按照确定的泄漏点上样完成后,依次分别用蒸馏水和pH 2.0的盐酸溶液洗脱吸附柱,以便除去可溶性的糖、蛋白质及其他小分子物质。用pH 2.0、60%乙醇溶液以不同的速度洗脱(1,2和3 mL/min),利用自动收集器收集洗脱液,每5 mL收集1管,测定吸光度。
1.2.5 HPLC分析纯化前后美洲合欢花花色苷提取物
对纯化前后花色苷进行成分分析,HPLC分析条件:Shim-pack XR-ODS Ⅲ色谱柱(75 mm×2.0 mm,1.6 μm),柱温25 ℃。流动相:乙腈(A)-0.1%甲酸水溶液(B)。梯度洗脱:0~20 min,0~50% A;20~30 min,50%~0 A。检测波长530 nm,体积流量0.5 mL/min,进样量10 μL,样品浓度1 mg/mL。
1.3 数据处理
试验进行3次重复试验,结果取平均值,并采用Graphpad prism 6.0软件对试验数据进行处理。
2 结果与讨论
2.1 美洲合欢花花色苷最大吸收波长的确定
研究表明,花色苷特征吸收峰在500~540 nm[15]。美洲合欢花400~800 nm吸收波长下的吸收光谱图如图1所示,美洲合欢花花色素最大吸收波长为530 nm,可见该色素为花色苷类,因此以530 nm作为检验波长。

图1 美洲合欢花花色苷吸收光谱图
2.2 大孔树脂的筛选
8种不同的大孔树脂分别吸附美洲合欢花花色苷粗提液(pH 2.0),吸附时间24 h;树脂解吸条件为60%、pH 2.0的乙醇溶液。吸附和解吸平衡后结果见表1。结果表明,除HPD-100外,其他几种树脂的吸附能力均在90%以上,差异不大。但解吸方面,D101的解吸率最大,高达81.58%,综合考虑,在后续试验中采用D101树脂。

表1 不同树脂的吸附和解吸性能比较
2.3 大孔树脂D101静态吸附及解吸试验结果
2.3.1 吸附平衡时间
由图2可知,在前3 h过程中D101树脂对美洲合欢花花色苷的吸附率随着时间延长呈明显上升趋势,尤其是初始的1 h速率最大,吸附率达63%,随后吸附速率逐渐降低。大约在4 h吸附率达93%,继续增加吸附时间,吸附率基本保持稳定,树脂与花色苷之间的作用达到动态平衡,吸附达到饱和,因此以4 h为最佳吸附时间。
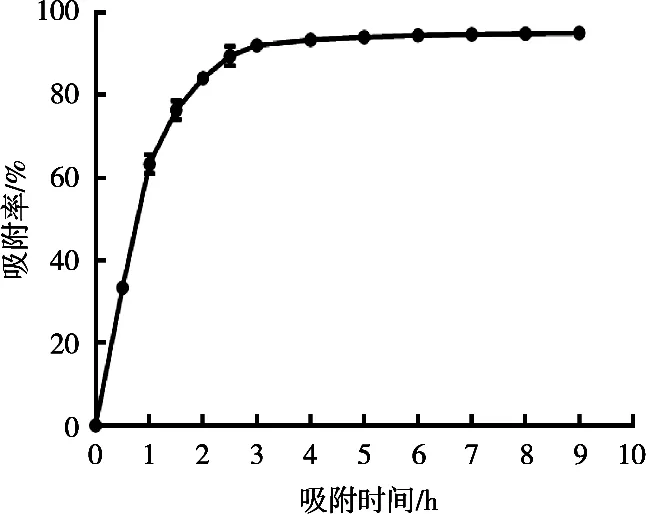
图2 D101树脂对花色苷的静态吸附曲线
2.3.2 解吸平衡时间
图3为60%酸化乙醇(pH 2.0)溶液对花色苷的解吸曲线,洗脱前2 h内,乙醇溶液对吸附在树脂上的花色苷解吸能力较强,解吸率增加较快,尤其在解吸30 min时,解吸率达59%。之后随着解吸时间延长,洗脱速率降低,解吸率增加变缓。解吸3 h后,溶液中花色苷浓度基本变化不大,这是因为此时乙醇溶液、大孔树脂对花色苷的作用达到动态平衡,解吸率变化甚微,解吸过程基本完成。因此,解吸完成时间为3 h,此时解吸率为78%。
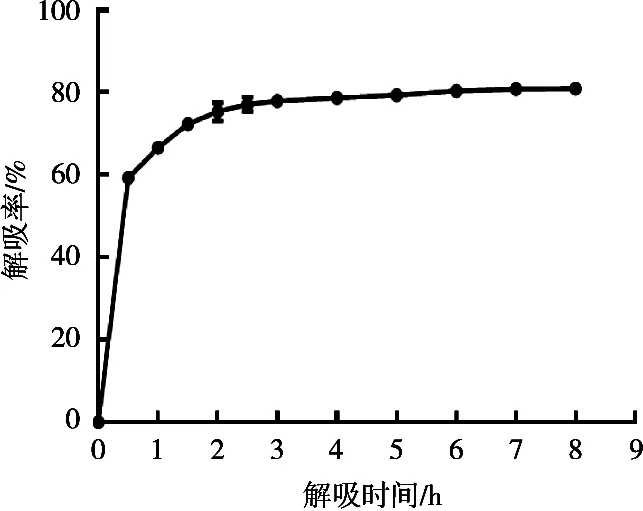
图3 D101树脂对花色苷的静态解吸曲线
2.3.3 上样浓度对吸附率的影响
由图4可知,D101树脂对美洲合欢花花色苷的吸附率随着上样浓度增加先增大后减小,样品质量浓度为1.5 mg/mL时,吸附率达到最大,吸附达到饱和状态。这是因为花色苷液质量浓度过低时,吸附时间长,且质量浓度过低造成吸附动力小,导致吸附量低[16]。质量浓度过高时,杂质吸附率增加,与花色苷竞争吸附的分子增多,花色苷分子不能与大孔树脂内表面充分交换吸附,造成吸附率降低[17]。
2.3.4 吸附液pH对吸附率的影响
由图5可知,D101大孔树脂对美洲合欢花中花色苷的吸附率随着样液pH增大先增加后减小,pH 2.0时吸附效果最佳,这是因为花色苷在不同pH下有不同存在形式,酸性条件下,花色苷大多以分子形式存在,易被树脂吸附,而随着酸性减弱,以分子形式存在的花色苷变少,影响吸附效果[18]。因此pH 2.0为最佳样液pH。

图4 样品质量浓度对吸附效果的影响

图5 吸附液pH对花色苷吸附效果的影响
2.3.5 洗脱剂浓度对解吸率的影响
由图6可知,D101大孔树脂对花色苷的解吸率随洗脱剂乙醇体积分数的增加呈增大趋势,乙醇体积分数60%时,解吸率达80%以上。但继续增加乙醇体积分数,大孔树脂对花色苷的解吸率增大很不明显,这是因为低体积分数的乙醇溶液极性偏大,不能将大孔树脂中的花色苷充分解吸,因此解吸效果差。但是继续增加乙醇体积分数,大孔树脂对花色苷的解吸率增大很不明显,这可能是因为浓度过大会造成醇溶现象,不利于解吸[19-20],再加上从成本和环境综合因素考虑,选择60%乙醇作为美洲合欢花花色苷的洗脱溶剂。
2.3.6 解吸液pH对解吸率的影响
由图7可知,解吸液pH对D101吸附花色苷的解吸影响较大,pH 1.0~2.0时,解吸率有所增加,但pH继续增加后,解吸率反而降低,pH 2.0时,解吸率最好,可能是因为pH小于2.0时,被解吸出来花色苷结构遭到破坏,而pH大于2.0时,花色苷不能完全充分解吸,使解吸率有所下降[19]。因此选择pH 2.0为最佳洗脱条件。

图6 乙醇体积分数对花色苷解吸率的影响

图7 解吸液pH对花色苷解吸效果的影响
2.4 大孔树脂D101动态吸附及解吸
2.4.1 上样流速对吸附效果的影响
一般认为流出液浓度为上样初始浓度的10%时为泄漏点,此时树脂对溶质吸附趋向饱和。由图8可知,随着花色苷粗提液流出体积增加,流出液的吸光度也逐渐增加,树脂吸附饱和,继续增加花色苷体积,花色苷出现泄漏。选择上样质量浓度1.5 mg/mL(吸光度A=1.414)的花色苷溶液进行进行试验,上样流速3 mL/min时,流出液体积310 mL时就开始出现泄漏,较早浪费花色苷溶液,这是因为流速过快,花色苷分子无法与树脂充分接触,而直接随上样液的流动而泄漏[20];上样流速1 mL/min时,流出液体积510 mL时才开始出现泄漏,但是考虑上样速度过慢影响吸附效率,最终确定流速2 mL/min为佳。

图8 上样流速对动态吸附效果的影响
2.4.2 洗脱流速对解吸效果的影响
由图9可知,收集洗脱液吸光度均为先增大后减小,洗脱流速1 mL/min时的吸光度峰值最大,洗脱峰相对集中,对称性好且无明显拖尾情况;流速3 mL/min时的吸光度峰值最小,最后降到最低值,且有拖尾现象,这是因为洗脱速度过快,洗脱剂来不及与树脂充分接触,就直接流出吸附柱。所以,洗脱流速1 mL/min时的解吸附效果最好。

图9 洗脱流速对解吸效果的影响
2.5 HPLC检测结果
通过使用液相色谱法对比纯化前后花色苷,结果如图10所示。结果表明,纯化后的花色苷经过高效液相色谱检测后,杂峰变少,峰值有显著提高,表明经过大孔吸附树脂纯化过的花色苷纯度明显有所提高。

图10 纯化前后花色苷液相色谱图
3 结论
通过静态吸附-解吸试验,对D101、AB-8、HPD-100、HPD-100A、HPD-200A、HPD-300、HPD-500和HPD-600这8种大孔树脂进行了筛选,得到D101树脂对美洲合欢花花色苷的吸附-解吸效果最佳。美洲合欢花花色苷吸附解吸的最优工艺条件为:上样质量浓度1.5 mg/mL、pH 2.0、洗脱液采用60%酸化乙醇、上样液流速2 mL/min、洗脱流速1 mL/min。HPLC检测发现,经过大孔吸附树脂纯化过的花色苷纯度明显有所提高。
