异时性双原发胃癌合并胃肠道间质瘤1例
2020-03-04郭成旺王永锦聂蓬王吉红
郭成旺 王永锦 聂蓬 王吉红
甘肃省武威肿瘤医院,甘肃 武威733000
1 临床资料
患者,男,54岁,主因“普查发现胃癌1周”入院。患者于2018年12月参加我院胃癌普查项目时电子胃镜诊断示:1.胃体病变性质待查;2.慢性萎缩性胃炎。病检示:(胃1体大弯)胃低分化腺癌,部分区为印戒细胞癌。2018年12月10日患者于外院复查电子胃镜诊断示:1.慢性萎缩性胃窦炎;2.胃体后壁溃疡型癌;3.食管炎。病检示:(胃体后壁)印戒细胞癌。2018年12月18日我院查全腹平扫+增强CT示:胃窦癌,影像学分期(T3N0M0),请结合胃镜病检。2018年12月20日在我院气管插管全麻+连硬外麻下行“胃癌根治术(腹腔镜辅助D2淋巴结清扫、根治性远端胃切除、残胃-空肠Roux-en-Y吻合)”,术后病检(见图1):胃体后壁近小弯侧浸润型低分化腺癌,部分区为印戒细胞癌及黏液腺癌(占30%),Lauren分型:弥漫型;肿瘤大小4cm×3cm,癌组织浸及浆膜层,神经受侵犯,淋巴管内癌栓形成,血管内未见明确癌栓;标本上、下切缘及另送检切缘未见癌组织,区域淋巴结(0/26)见癌转移;免疫组化:癌细胞免疫组化标记(见图2):P53(阳性率小于1%),P-gp(-)、GSTπ(+)、TopoII(++)、Ki-67(阳性率70%)、TS(-)、C-erbB-2(-)。术后愈合良好。术后给予FOLFOX方案辅助化疗3周期,因患者拒绝进一步化疗遂终止治疗。

图1 首次术后病检

图2 首次术后免疫组化

图3 残胃术前胃镜
2019年11月26日(术后11月)复查,电子胃镜检查(见图3):远端胃切除术后改变,吻合口未见异常;残胃体近端可见约2cm大小黏膜粗糙、充血,NBI+ME示:DL(+),边界线内部表面结构消失,表面血管经不一;超声内镜:变处黏膜层、黏膜下层后,黏膜下层及浅肌层界限不清;超声内镜(见图4)提示:T2-3;病检(图5):(残胃体)低分化腺癌。腹部CT(见图6):与前片(2019年4月3日)比较:胃癌术后,吻合口欠光整,残胃体近贲门胃壁黏膜略增厚,大致同前,请结合胃镜。因患者及家属拒绝手术治疗,给予XELOX方案化疗2周期。

图4 残胃超声胃镜

图5 残胃术前病检

图6 残胃术前增强CT
2020年2月24日在气管插管全麻下行残胃癌根治术。术后病检(见图7):1.残胃弥漫型低分化腺癌,Lauren分型:弥漫型;癌组织浸及浆膜面脂肪组织,神经受浸;食管、肠切缘及另送检切缘未见癌组织;淋巴结(0/7)未见癌转移;化疗反应Mandard评价标准:2级;癌细胞免疫组化标记(见图8):Ki-67(index≈70%)、P53(-)、C-erbB-2(-)、TopoIl(+)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、TS(-)、P-gp(+)、GSTπ(+)、MUC2(+)、MUC5AC(-)、MUC6(-)、CD10(-)、CgA(-)、Syn(-)、LCA(-)、CK8/18(+)、EBV(-);2.胃肠间质瘤(见图9):肿瘤直径0.8cm,核分裂象1/48HPF;极低度危险性;瘤细胞免疫组化标记:CD117(+)、Dog-1(+)、Desmin(-)。术后恢复良好,好转后进一步化疗控制病情。
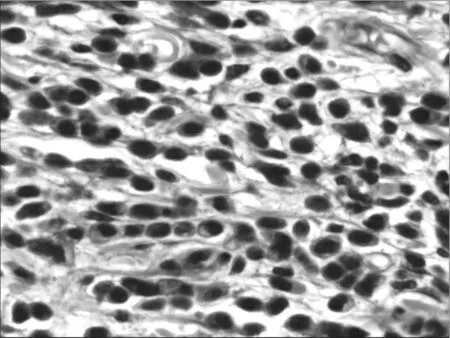
图7 双原发胃癌病检

图8 双原发胃癌免疫组化
2 讨论
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,其中主要是胃腺癌,占胃部恶性肿瘤的95%以上[1]。胃肠道间质瘤(gastrointestinal stromaltumors,GIST)是消化道最常见的间叶源性肿瘤,约占消化系统肿瘤的1%~3%,其中绝大部分见于胃,其次为小肠、结直肠,极少部分分布于食管等脏器[2]。多原发恶性肿瘤是指同一患者单个或多个器官同时或先后发生两种或两种以上原发恶性肿瘤。第二种癌发生在第一种癌确诊后小于6个月称为同时癌,大于6个月发生的称为异时双原发癌[3]。
胃GIST目前的诊断方式有:a.钡餐造影;b.胃镜(一般高度怀疑GIST患者应避免取检[4]);c.胸腹部CT、MRI;d.组织病检[5]。对于内镜医师而言,不能因已经明确一处病变而对其他可疑之处放松警惕,避免漏诊,可以提高多原发癌及合并其他疾病的诊断[6]。手术医师术中认真探查,确保足够的切缘及进一步明确有无多原发癌及其他病变[7]。术中探查有助于同时性重复癌及合并胃GIST疾病的规范化治疗及同期切除,其可以对内镜、CT、MRI等检查漏诊起到很好地补充作用;避免因再次手术导致的二次创伤,减轻患者经济负担。

图9 间质瘤(Dog-1)免疫组化
临床研究发现,胃癌合并胃GIST中通常以胃癌的临床症状为首诊原因,合并胃GIST病变一般较小、恶性程度低,绝大多数患者没有临床表现,或较轻的临床表现被胃癌的症状所掩盖。这也是胃癌并发胃GIST的术前诊断率较低的原因。基于日本胃癌筛查系统对GIST治疗的结果证实:通过鉴定无症状患者,日本胃癌筛查系统有助于早期发现胃GIST[8],对胃GIST诊断有很大帮助。
老年双原发癌患者的比例较高,尤其是60~70岁的患者[9]。同期发生胃癌的胃GIST预后差于原发单发胃GIST,但与原发单发胃癌相当[10,11]。另据刘秀丽等[5]报道,胃癌是影响胃GIST患者预后的独立因素之一,胃GIST合并胃癌患者5年生存率低于单纯胃GIST患者的。由此可判断多原发胃癌合并胃GIST患者预后并不乐观[12]。然而也有部分研究者认为胃癌合并胃GIST患者中腺癌的分期,胃肠道间质瘤的大小和有丝分裂方式是主要的预后因素,但该研究的病例数极少,在后期的研究中应加以补充 。
