流式细胞术检测细胞周期实验条件的影响因素分析
2020-03-02沈链链钟义红熊建平刘艳青
沈链链,钟义红,熊建平,刘艳青
(南京医科大学公共卫生学院,江苏 南京 211166)
流式细胞术(FCM)能够对单细胞进行定量分析与分选,通过对细胞内化学成分的检测获取细胞内各种生命物质的参数,为细胞生物学、生物医学提供全新的技术支持[1]。细胞周期是指以有丝分裂方式增殖的细胞从亲本分裂结束到子细胞分裂结束所经历的过程。FCM是检测细胞周期分布情况的最佳方法[2],可为细胞周期的动力学研究提供有力的分析手段。用FCM检测细胞周期的实验步骤虽然不多,但存在实验结果不稳定(平行性不好),固定效果不好,变异系数(CV)过大等一系列问题,尤其是处理过的、状态不佳的细胞。因此,本实验利用细胞周期阻滞剂秋水仙素处理结肠癌细胞株(HCT116),研究FCM检测过程的各个环节对结果的影响。
1 材料与方法
1.1 主要试剂与仪器
HCT116人结肠癌细胞株(中国科学院生物化学与细胞生物学研究所);1640培养基、胰酶(美国Gibco公司);胎牛血清(以色列BI公司);秋水仙素(爱必信上海生物科技有限公司);BD FACS Calibur流式细胞仪(美国BD公司);碘化丙啶PI染色液(含RNase)细胞周期试剂(美国BD公司)。
1.2 分组设置
1.2.1 固定方式对结果的影响 HCT116细胞于培养皿中过夜培养;待细胞贴壁后铺满60%~70%,更换为含有秋水仙素的培养液,细胞经终浓度为1.25 μmol/L的秋水仙素刺激16 h后,收集全部培养液(含贴壁不牢的细胞)。贴壁细胞经胰酶消化后,与培养液混合,1 000 r/min离心5 min,加入适当培养液稀释,细胞计数后每份样本取1×106个细胞至离心管,PBS洗1次,1 000 r/min离心5 min,弃上清液后分别按下列3种方式固定:缓慢逐滴滴入预冷的70%乙醇2 mL;一边涡旋一边加预冷的70%乙醇2 mL;经0.6 mL PBS吹散细胞后再加1.4 mL预冷的纯乙醇(均为3个平行,共9个样本)。4℃固定过夜后,1 500 r/min离心5 min,PBS洗2次,1 500 r/min离心5 min,加0.5 mL细胞周期试剂,避光15 min后300目滤网过滤,上机。
1.2.2 细胞数量对结果的影响 细胞加药处理同“1.2.1”。细胞计数后每份样本分别取1×106、0.33×106、0.5×106、2×106和5×106个细胞至离心管(均为3个平行,共15个样本),PBS洗1次,1 000 r/min离心5 min后按“1.2.1”中的第3种方式固定,4℃过夜后,PBS洗、染色步骤同“1.2.1”。
1.2.3 固定温度对结果的影响 细胞加药处理同“1.2.1”。细胞计数后每份样本取1×106个细胞至离心管,PBS洗1次,1 000 r/min离心5 min后按“1.2.1”中的第3种方式固定,分别放置于4℃过夜、-20℃过夜、4℃放置6 h后于-20℃过夜和常温过夜(均为3个平行,共12个样本)。第2天,PBS洗、染色步骤同“1.2.1”。
1.2.4 固定时间对结果的影响 细胞加药处理同“1.2.1”。细胞计数后每份样本取1×106个细胞至离心管,PBS洗1次,1 000 r/min离心5 min后按“1.2.1”中的第3种方式固定,分别放置于-20 ℃ 1 d(过夜),28 d,56 d,70 d(均为3个平行,共12个样本)。固定后,PBS洗、染色步骤同“1.2.1”。
1.2.5 染色时间对结果的影响 细胞加药处理同“1.2.1”。细胞计数后每份样本取1×106个细胞至离心管,PBS洗1次,1 000 r/min离心5 min后按“1.2.1”中的第3种方式固定,4℃过夜,PBS 洗,加0.5 mL细胞周期试剂染色,分别于染色15 min后放置0、1、2、4、8 h检测(均为3个平行,共15个样本)。
1.3 上机检测
用流式细胞仪检测样本,以FSC-H为横坐标,SSC-H为纵坐标,设置门R1,以FL2-A为横坐标,FL2-W为纵坐标,设置门R2,总共收集R2门内20 000个细胞。
1.4 细胞周期结果分析
Modfit 软件分析,得出各个期细胞百分比及CV值。
1.5 数据统计
2 结果
2.1 固定方式的影响
3种固定方式的检测结果见表1。“70%冷乙醇在涡旋仪上加入”组的CV值大于“70%冷乙醇逐滴加入”组,且差异有统计学意义,而 “PBS和纯乙醇(3 ∶7)”组与“70% 冷乙醇逐滴加入” 组的差异无统计学意义。但从散点图(图1)看,“PBS和纯乙醇(3 ∶7)”组的固定效果最好,表现为细胞群最集中。因此在后续的实验中,均采取PBS和纯冷乙醇(3 ∶7)的方法固定。

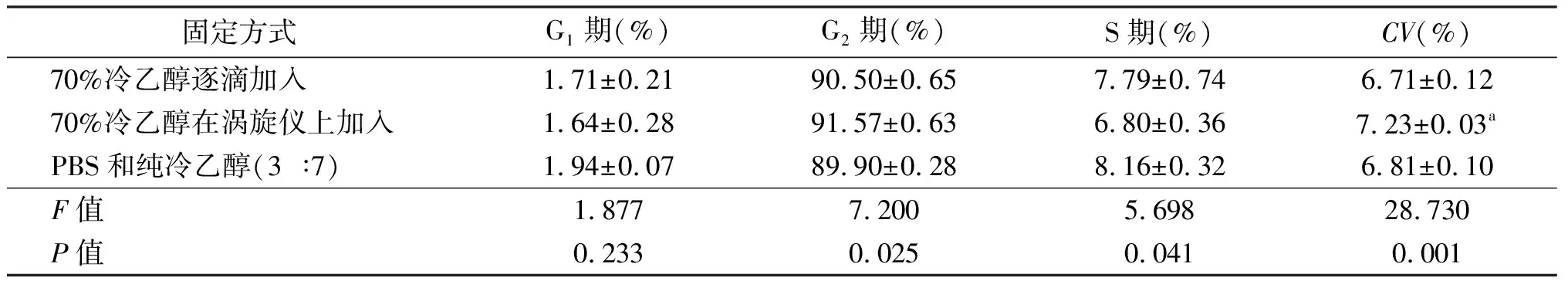
固定方式G1期(%)G2期(%)S期(%)CV(%) 70%冷乙醇逐滴加入1.71±0.2190.50±0.657.79±0.746.71±0.12 70%冷乙醇在涡旋仪上加入1.64±0.2891.57±0.636.80±0.367.23±0.03a PBS和纯冷乙醇(3 ∶7)1.94±0.0789.90±0.288.16±0.326.81±0.10 F值1.8777.2005.69828.730 P值0.2330.0250.0410.001
a:P<0.05,与“70%冷乙醇逐滴加入”组相比

A:70%冷乙醇逐滴加入;B:70%冷乙醇在涡旋仪上加入;C:PBS 和纯冷乙醇(3 ∶7)
图1 3种固定方式的样本Modfit分析图
2.2 细胞数量的影响
见表2。细胞数量不同会在一定程度上影响结果,当细胞数为标准数量的1/3时,CV值比标准数量组大,且差异有统计学意义,可能影响数据的可信度。当细胞数为标准数量的1/2时,G2期的比例较标准数量组大,且CV值增大,差异有统计学意义。当细胞数达到标准数量的2倍时,G2、S期的比例改变(P<0.05),且CV值明显增大(P<0.05)。当细胞数达到标准数量的5倍时,虽然各期值的变化无明显差异,但CV值明显增大,可能与试剂量相对于细胞数量而言不够、染色不充分有关。从图2可见,细胞数太多或太少时,曲线极不平滑或G2峰出现了双峰,数据可信度降低。因此,取细胞数为1×106进行后续实验。
2.3 固定温度的影响
与4℃组相比,-20℃组、“4℃~-20℃”组的检测结果及CV值差异无统计学意义。常温组G2期、S期的比例与4℃组相比,差异有统计学意义,见表3。因此固定后的样本不能放置于常温。
2.4 固定时间对结果的影响
由表4可见,28 d组,56 d组,70 d组的各期比例与1 d组相比,差异均无统计学意义;CV值明显增大(P<0.05),但并无随固定时间逐渐增大的趋势。


细胞数G1期(%)G2期(%)S期(%)CV(%) 1×1065.60±0.1179.90±0.9014.50±0.997.19±0.16 0.33×1065.23±0.2881.29±0.9713.48±1.248.95±0.62a 0.5×1064.65±0.2281.46±0.34a13.89±0.528.00±0.21a 2×1066.05±0.1983.43±0.33a10.52±0.52a8.67±0.12a 5×1066.48±1.3380.57±0.4212.95±0.959.33±0.16a F值3.89312.2878.90321.897 P值0.0370.0010.0020.000
a:P<0.05,与1×106细胞数组相比
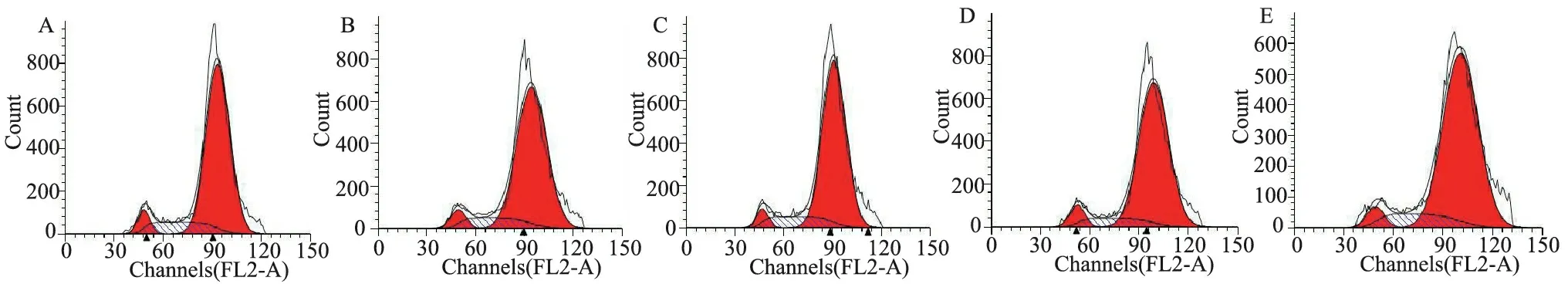
A:1×106;B:0.33×106;C:0.5×106;D:2×106;E:5×106

表3 不同固定温度的检测结果
a:P<0.05,与4℃组相比

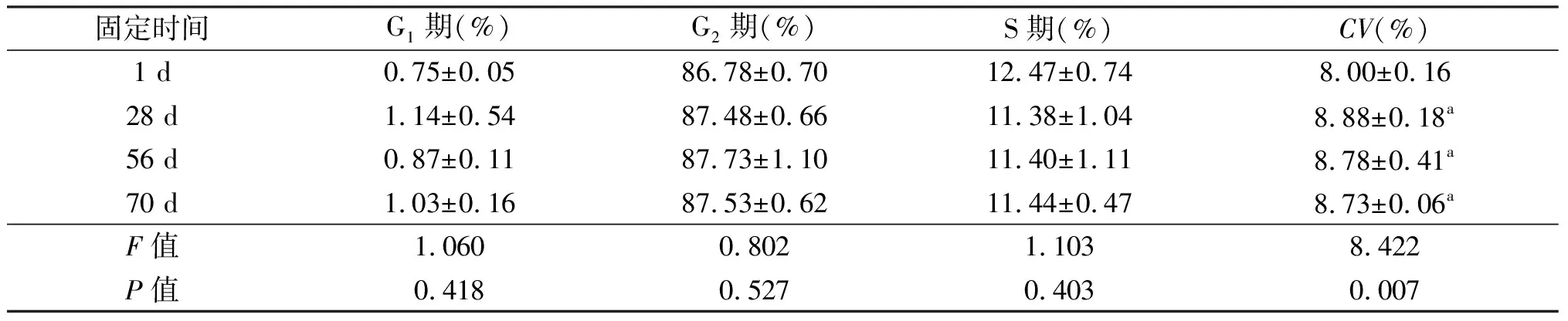
固定时间G1期(%)G2期(%)S期(%)CV(%)1 d0.75±0.0586.78±0.7012.47±0.748.00±0.1628 d1.14±0.5487.48±0.6611.38±1.048.88±0.18a56 d0.87±0.1187.73±1.1011.40±1.118.78±0.41a70 d1.03±0.1687.53±0.6211.44±0.478.73±0.06aF值1.0600.8021.1038.422P值0.4180.5270.4030.007
a:P<0.05,与1 d组相比
2.5 染色时间对结果的影响
由表5可见,1 h、2 h组与0 h相比,各期比例及CV值无有统计学意义的改变。4 h组G2期的比例比0 h明显降低(P<0.05)。8 h组G1期的比例较0 h明显升高,CV值明显增大,差异有统计学意义(P<0.05)。因此,染色完成后需在2 h之内完成检测。


染色时间G1期(%)G2期(%)S期(%)CV(%)0 h0.98±0.0590.39±0.188.63±0.237.87±0.101 h1.36±0.2690.48±0.198.16±0.448.23±0.432 h1.12±0.0890.22±0.498.66±0.568.19±0.154 h1.34±0.2289.01±0.73a9.65±0.808.36±0.25
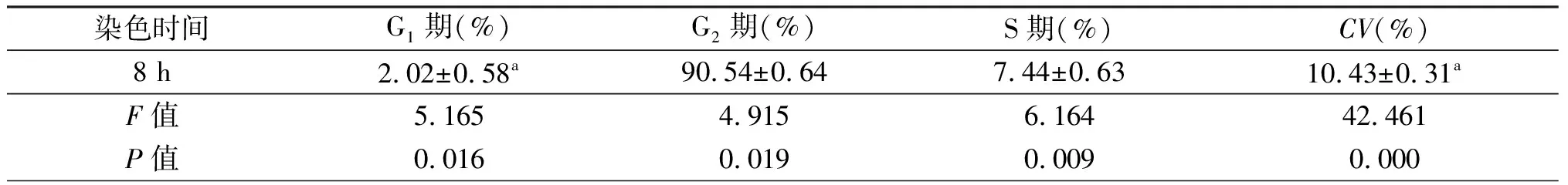
(续表5)
a:P<0.05,与0 h相比
3 讨论
细胞周期检测看似简单,但是要获得可信和稳定的结果却并不容易。本实验从固定方法、细胞数量、固定后存放温度,固定后存放于-20℃的时间,以及染色时间等多方面探讨其可能的影响因素。
最常用、简单的固定方式是在细胞沉淀中直接加入70%冷乙醇固定,但从本实验结果来看,用PBS吹成单细胞悬液后再加预冷纯乙醇的方法能获得更好的效果,该方法也曾有文献报道[3]。PBS吹散细胞沉淀后加入纯乙醇(两者比例为3 ∶7)是笔者推荐的方法,其原因可能是PBS吹散后形成单细胞悬液,从而使单细胞更加快速地与乙醇接触,所以固定效果更好。该方法对于状态不佳的细胞样本(如转染后的细胞等)的实验结果有很好的改善作用。另外,董波等[4]认为,固定细胞的过程中加入终浓度为 3%的小牛血清是一种简单的、能有效地保护细胞膜使细胞不易粘连的技术措施。
按照试剂盒说明书的要求,每份样本应含有1×106细胞,而在实际工作中,由于每个样本计数太耗时而未做计数或者一份样本的全部细胞都不够1×106等原因,导致样本间的细胞数量差异很大。从我们的实验结果来看,细胞数的差异影响检测结果以及CV值。因此,每份样本均应计数,与试剂盒要求一致,避免由此引起的误差。胡梦裳等[5]的实验结果表明,碘化丙啶浓度在一定范围内的变化并不影响检测的各期百分比的数值。而本实验结果表明,同样剂量的试剂,不同的细胞数,对各期的百分比有一定的影响,但影响最大的还是CV值。唐国华等[6]报道,每秒进样细胞数影响各期的百分比。在我们的实验中,虽然都使用低速上样,但由于样本的细胞浓度不同,导致每个样本的每秒上样细胞数目不同,也可能是导致结果差异的原因之一。
由于固定后短期存放于4℃或-20℃无差异,因此建议可以直接将样本放入-20℃,过夜后检测或长期存放均可。-20℃存放70 d之内检测仅对CV值稍有影响,对各周期的细胞百分比无明显影响。有学者认为固定20 min[7]或30 min[3]即可,且结果与固定较长时间(18 d)的结果类似。这也说明,只要固定所使用的试剂以及操作正确,固定后的细胞状态非常稳定,固定时间对结果的影响并不明显。
染色完成后2 h检测对结果影响不大,若样本太多,而且样本细胞数太少,应进行分批染色,减少染色后的等待上机时间。
总的来说,用流式细胞术检测细胞周期时,细胞数应遵照试剂盒要求,推荐用PBS吹散加入预冷的纯乙醇固定,固定后置于-20℃,70 d内用周期试剂染色,染完后2 h内上机检测。
