调节性T细胞在小鼠放射性肺纤维化进程中的动态变化
2020-03-02王彩虹潘晓娴陈金梅黄菲吴建东洪金省
王彩虹,潘晓娴,陈金梅,黄菲,吴建东,洪金省
(1.福建医科大学第一临床医学院,福建 福州 350005;2.福建医科大学附属第一医院放疗科,福建 福州 350005;3.放射生物福建省高等学校重点实验室,福建 福州 350005;4.福建省个体化主动免疫治疗重点实验室,福建 福州 350005;5.福建医科大学附属第一医院中心实验室,福建 福州 350005)
随着恶性肿瘤综合治疗的广泛应用和精确放射治疗技术的日益发展,放射治疗已成为胸部肿瘤(如肺癌、食管癌、乳腺癌等)治疗的重要手段。放射性肺损伤是胸部放射治疗的常见并发症[1-4],早期表现为急性和亚急性放射性肺炎,后期发展为肺纤维化。放射性肺纤维化(radiation-induced pulmonary fibrosis, RIPF)是胸部肿瘤放疗的主要剂量限制性毒性反应,其发生率可高达86%[5]。RIPF一旦发生就难以逆转,严重影响着放疗效果及生活质量,甚至可能导致死亡。然而,目前RIPF的确切机制尚未明确,临床上缺乏有效的治疗方法。
放射性免疫功能紊乱是放射性损伤的驱动因素[6]。大量研究已证实放射性肺损伤过程中伴随着多种免疫细胞、免疫因子的动态变化及相互作用[7]。其中,调节性T淋巴细胞(regulatory T cells, Tregs)作为一种重要的免疫调节细胞,能够识别自身和外来的抗原,抑制炎症反应并减少炎症对组织带来的损伤,维持机体耐受和自身免疫的平衡。近些年来,Treg细胞在肺纤维化中的作用备受关注。研究表明,Treg细胞在特发性纤维化[8-9]、矽肺[10-12]和博莱霉素[13]等不同因素所致肺纤维化中表现出不同的变化规律、发挥着不同的作用。Xiong等[14]研究显示,小鼠胸部照射后,外周血和肺组织中Treg细胞均明显增多,Treg细胞具有促进RIPF的作用。脾脏作为机体最大的免疫器官和免疫调节反应的中心,拥有全身循环T淋巴细胞的25%,直接参与细胞免疫,并对外周血中T淋巴细胞亚群的分布具有重要的调节作用。本研究分析了小鼠RIPF过程中脾脏、外周血和肺组织中Treg细胞的动态变化,以期为深入研究Treg细胞在RIPF的作用机制提供依据。
1 材料与方法
1.1 动物与分组
80只8周龄SPF级雌性C57BL/6小鼠,体重19~22克,购于上海斯莱克动物有限公司,许可证号:SCXK(沪)2007-0005。本研究采用2×4析因设计方法,随机方式分成对照组和照射组,每组又随机分为4个小组(分别于照射后2天、17天、3个月和5个月进行研究观察)。每组每个时间点10只小鼠。
1.2 照射方法
将小鼠用4%水合氯醛(10 mL/kg)腹腔注射麻醉后,分别置于自制的有机玻璃鼠笼内,用凹形卡槽固定小鼠的颈部,充分拉伸小鼠身体后用胶布固定其尾部。将照射组小鼠分批进行照射,每批8只排列于治疗床上,经电子射野影像系统验证体位以确保小鼠肺部于照射野内后,予直线加速器(Varian,Clinac600C/D)的6 MV X线全肺单次照射15 Gy(照射角度0°,射野38 cm × 1.2 cm,剂量率300 cGy/min,源皮距为100 cm),具体摆位方法参考已发表的论文[15]。
1.3 标本取材
分别于照射后2天(急性炎症期)、17天(亚急性炎症期)、3个月(纤维化前期)和5个月(纤维化期),各组取10只小鼠,先用眼球取血法取外周血约1 mL置抗凝管中备用,再将小鼠用颈椎脱臼法处死取肺组织和脾脏。其中,左肺用于病理检测,外周血、右肺和脾脏用于Treg细胞的检测。
1.4 RIPF模型的病理验证
将小鼠左肺以10%福尔马林固定、乙醇脱水、石蜡包埋,连续3.5 μm的厚度切片,行HE染色和Masson染色后通过光学显微镜观察。采用Image J软件对Masson染色结果中所示的肺间质纤维化程度进行分析,用胶原容积分数(collagen volume fraction ,CVF)代表肺纤维化程度,CVF=胶原面积/(图像总面积-空白区域面积)。
1.5 Treg细胞的检测
1.5.1 样品的制备 ① 外周血:将外周血2 000 r/min离心8 min,取血细胞100 μL,加入5 mL红细胞裂解液吹打混匀,2 000 r/min离心5 min,弃去上清液,重复2次;再用5 mL PBS吹打混匀,2 000 r/min离心5 min,弃去上清液;用100 μL PBS重悬。② 肺组织:将右肺组织置于50 mL离心管中,研磨过滤,2 000 r/min离心5 min,弃去上清液;加入5 mL红细胞裂解液吹打混匀,2 000 r/min离心5 min,弃去上清液;再用5 mL PBS吹打混匀,2 000 r/min离心5 min,弃去上清液;用100 μL PBS重悬。③ 脾脏:将脾脏置于50 mL离心管中,研磨过滤,2 000 r/min离心5 min,弃去上清液;加入5 mL红细胞裂解液吹打混匀,2 000 r/min离心5 min,弃去上清液;再用5 mL PBS吹打混匀,2 000 r/min离心5 min,弃去上清液;用500 μL PBS重悬,每管取20 μL,并用100 μL PBS稀释。
1.5.2 抗体染色与流式细胞仪检测 将以上制备好的外周血、肺组织和脾脏的单细胞悬液,按小鼠Treg细胞染色试剂盒(杭州联科生物技术股份有限公司)说明书的步骤进行染色后,用FACSCalibur型流式细胞仪(BD Accuri C6)检测CD4+CD25+FoxP3+Treg细胞占CD4+T细胞的比例。
1.6 统计分析

2 结果
2.1 小鼠RIPF模型的病理验证
2.1.1 HE染色 照射后第2天、17天,C57BL/6小鼠的肺泡腔及肺泡间隔可见大量炎症细胞浸润;照射后3个月、5个月,肺泡间隔进一步增厚,肺泡结构出现萎陷、融合、变形(图1)。对照组小鼠的肺泡结构正常,未见炎症细胞浸润。

图1 小鼠胸部照射后不同时间点肺组织的HE染色(×100)
2.1.2 Masson 染色 对照组小鼠肺组织结构清晰,肺泡间隔无明显胶原纤维沉积。照射后5个月,照射组小鼠的肺泡间隔可见大量胶原沉积(图2)。照射后5个月照射组小鼠肺组织的CVF(65.67%±9.53%)较对照组(13.28% ± 2.27%)明显增高(t=16.044,P<0.01)。

图2 小鼠胸部照射后5个月肺组织的Masson染色(×100)
2.2 Treg细胞的变化情况
2.2.1 外周血 经两因素析因设计的方差分析显示,小鼠外周血中Treg/CD4+T细胞比例在是否照射(F=42.78,P<0.01)和照射后不同时间点(F=143.5,P<0.01)间的差异均有统计学意义。照射后2天(t=6.854,P<0.01),17天(t=12.96,P<0.01)小鼠外周血中Treg/CD4+T细胞比例均较对照组升高,而照射后3个月和5个月时较对照组无显著差异(P>0.05)。照射组从照射后2天开始Treg/CD4+T细胞比例明显升高,在17天达高峰(t=6.978,P<0.01),3个月则较17天时明显下降(t=12.21,P<0.01)并恢复至对照组水平,5个月时则维持稳定。对照组各时间点间无显著差异(F=0.475,P>0.05)。见图3。
2.2.2 肺组织 经两因素析因设计的方差分析显示,小鼠肺组织中Treg/CD4+T细胞的比例在是否照射(F=100.7,P<0.01)和照射后不同时间点(F=234.4,P<0.01)间的差异均有统计学意义。照射后2天(t=18.56,P<0.01),17天(t=21.08,P<0.01)小鼠肺组织中Treg/CD4+T细胞比例均较对照组升高,而照射后3个月和5个月时较对照组无明显差异(P>0.05)。照射组从照射后2天开始Treg细胞比例明显升高,17天达高峰,3个月则明显下降(t=17.92,P<0.01),5个月时则维持稳定并恢复至对照组水平。对照组各时间点间则无显著差异(F=0.232,P>0.05)。见图4。
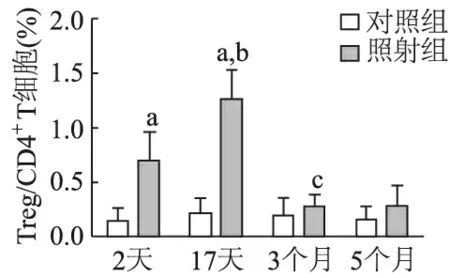
a:与对照组比较,P<0.01;b:与照射后2天比较,P<0.01;c:与照射后17天比较,P<0.01
图3 小鼠胸部照射后不同时间点外周血中Treg/CD4+T细胞的比例
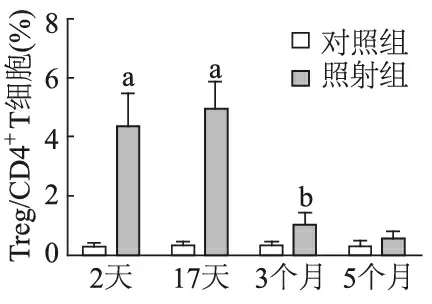
a:与对照组比较,P<0.01;b:与照射后17天比较,P<0.01
图4 小鼠胸部照射后不同时间点肺组织中Treg/CD4+T细胞的比例
2.2.3 脾脏 经两因素析因设计的方差分析显示,小鼠脾脏中Treg/CD4+T细胞的比例在是否照射(F=63.98,P<0.01)和照射后各时间点(F=132.8,P<0.01)间的差异均有统计学意义。照射后2天(t=10.09,P<0.01),17天(t=13.87,P<0.01)和3个月(t=8.493,P<0.01)小鼠脾脏中Treg/CD4+T细胞的比例均较对照组明显升高,照射后5个月较对照组明显下降(t=6.003,P<0.01)。从照射后2天开始Treg细胞比例明显升高,17天达高峰,3个月较17天明显下降(t=5.203,P<0.01),5个月时进一步下降且明显低于3个月水平(t=14.19,P<0.01)。对照组各时间点间无显著差异(F=0.526,P>0.05)。见图5。

a:与对照组比较,P<0.01;b:与照射后17天比较,P<0.01;c:与照射后3个月比较,P<0.01
图5 小鼠胸部照射后不同时间点脾脏中Treg/CD4+T细胞的比例
3 讨论
RIPF的发生机制目前尚未明确,研究表明Treg细胞在RIPF中发挥着重要的作用[16]。本研究将C57BL/6小鼠胸部单次照射15 Gy成功构建了RIPF模型,并分析了Treg细胞在纤维化进程的动态变化,结果表明小鼠在照射后2天外周血、肺组织和脾脏中的Treg比例均明显上升,17天仍明显升高,照射后3个月逐渐下降;照射后5个月外周血和肺组织中的比例下降至对照组水平,脾脏则下降至明显低于对照组水平。
CD4+CD25+Foxp3+Treg细胞是来源于胸腺的CD4+T细胞亚群,持续性表达CD25和Foxp3,它可通过下调机体对抗原的免疫应答来维持免疫耐受[17]。Treg细胞在肺纤维化中的作用是近些年来的研究热点,越来越多的研究表明Treg细胞在肺纤维化中发挥着重要作用[8, 18-20]。虽然导致肺纤维化的原因众多,如病毒或细菌感染、药物、辐射、吸烟、粉尘等,但它们存在着相同的病理过程,即病因导致的细胞损伤启动了机体与免疫相关的损伤修复,导致成纤维细胞异常激活、不断增殖。关于Treg细胞在不同因素导致肺纤维化中的数量变化的研究结果不尽相同:在特发性肺纤维化患者中,外周血和肺泡灌洗液的Treg细胞数均低于正常人群[8];矽肺患者中,Treg细胞数量却增多[21];在博莱霉素诱导的肺纤维化小鼠模型中,Treg细胞减少[22];而在小鼠RIPF模型中,外周血中Treg/CD4+T细胞比例在第14天时短暂升高后恢复正常水平,而肺组织中Treg细胞从第14天到6个月内持续升高[16]。本研究结果表明,在早期放射性肺炎阶段,外周血、肺组织和脾脏中Treg/CD4+T细胞的比例均明显上升;在纤维化前期或纤维化阶段,外周血和肺组织中其比例逐渐下降并恢复至正常水平,而脾脏中则逐渐下降至低于正常水平。其中Treg细胞在照射后早期升高的现象与Xiong等[16]的研究结果相同,但肺组织在纤维化阶段则表现出不同的变化规律。这可能与RIPF模型构建的照射设备和剂量不同有关,本研究采用的是目前临床中普及的直线加速器的6 MV X线及多叶光栅给予肺部照射和危及器官的保护,这与当前治疗条件下患者肺部照射后导致RIPF的情况更接近。
目前对于Treg细胞在RIPF中的作用是抑制或促进尚未达成共识。一方面,Treg细胞可能通过抑制成纤维细胞的增殖直接抑制纤维化,通过抗炎和降低辅助性T细胞的反应间接抑制纤维化。另一方面,它也可能通过分泌促纤维化细胞因子如血小板源性生长因子 B 和转化生长因子-β促进纤维化。较普遍的观点认为,在早期放射性肺炎阶段损伤是可逆的,一旦导致肺纤维化的微环境已形成,肺纤维化的进程则难以纠正[23]。有研究表明,通过抗 CD25 单抗在肺纤维化早期去除Treg 细胞可减轻纤维化,而肺纤维化晚期去除Treg 细胞则加重纤维化,因此认为Treg 细胞在小鼠肺纤维化的早期起促进纤维化作用,但在肺纤维化的晚期起抑制纤维化作用[24]。这可解释本研究中Treg细胞数在早期放射性肺炎阶段明显升高而后期纤维化阶段下降这一现象。同时也提示,在肺炎阶段对Treg细胞的干预可能是治疗RIPF的一种可选思路。
综上所述,小鼠外周血、肺组织和脾脏中Treg细胞比例在早期放射性肺炎阶段明显升高而后期纤维化阶段下降。Treg细胞在RIPF过程中的具体调节作用尚未明确,需进一步研究,以期为阐明RIPF的发病机制和干预措施提供参考。
