高糖通过抑制Bmal1调控的自噬加重细胞缺氧复氧损伤
2020-03-02高文蔚
高文蔚,袁 泉,江 梦,刘 恋,赵 博*
(1武汉大学人民医院重症医学科,武汉 430060;2武汉大学人民医院麻醉科;*通讯作者,E-mail:zb14526@163.com)
生物钟是由各种具有调控作用的信号分子和自动调节反馈生理活动的回路共同组成[1]。在哺乳动物昼夜节律核心反馈环中,时钟基因Bmal1对于昼夜节律的生成必不可少。Bmal1是参与能量代谢、细胞自噬、氧化应激、细胞凋亡等各种重要生理功能的关键基因[2,3]。更重要的是当Bmal1表达异常时,可导致诸如睡眠剥夺、糖代谢障碍、胰岛素抵抗等病理状态的发生[4,5]。
自噬作为维护细胞结构功能完整、氧化系统平衡的重要内源性保护机制,通过排除机体内有害分子,清除活性氧簇进而减轻损伤[6,7]。正常情况下神经元IR期间,自噬激活以对抗氧化应激,产生神经保护作用[8]。而在糖尿病状态下神经元IR损伤加重,自噬在糖尿病状态下发挥了怎样的功能?目前尚未有相关研究报道。本研究拟采用PC-12细胞通过建立高糖缺氧复氧模型观察高糖状态下时钟基因Bmal1调控的自噬在细胞缺氧复氧损伤中的作用。
1 材料与方法
1.1 材料
PC-12细胞(ATCC,美国),DMEM低糖培养基(Hyclone,美国),RIPA裂解液,乳酸脱氢酶(LDH)试剂盒,活性氧(ROS)测试盒,超氧化物歧化酶(SOD)试剂盒,丙二醛(MDA)试剂盒(南京建成,中国),兔抗鼠Bmal1,Beclin-1抗体(CST,美国)。
1.2 细胞培养及分组
PC-12细胞用10%马血清、5%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM低糖培养基(葡萄糖浓度5.5 mmol/L),置于37 ℃、5%CO2,饱和湿度培养箱中培养。当细胞生长到70%-80%满瓶时传代,继续培养。取第5-8代对数生长期细胞用于后续研究。采用随机数字表法将PC-12细胞分为:低糖组(NG组),低糖缺氧复氧组(NH/R组),高糖组(HG组),高糖缺氧复氧组(HH/R组)。高糖模型的建立:PC-12细胞铺板用无血清低糖DMEM培养基同步化24 h后加入高糖(葡萄糖终质量浓度25 mmol/L)培养24 h。缺氧复氧模型的建立:NH/R组与HH/R组置于缺氧(1%O2、5% CO2、94%N2)环境中培养3 h后;置于正常条件下继续培养复氧6 h。
1.3 指标检测
1.3.1 检测细胞活性与氧化应激水平 收集细胞培养上清液,按照试剂盒说明书操作,在450-525 nm波长的酶标仪下测定LDH,ROS,SOD和MDA水平。
1.3.2 流式细胞仪检测细胞凋亡 细胞收集并1 000 r/min离心5 min,弃上清。沉淀用500 μl缓冲液重悬,加入5 μl Annexin Ⅴ-异硫氰酸荧光素(FITC)和10 μl碘化丙锭(PI),室温避光孵育5 min后用流式细胞仪上机检测。
1.3.3 免疫蛋白印迹法检测Bmal1、Beclin-1 收集细胞进行蛋白抽提,采用聚丙烯酞胺凝胶电泳分离目的蛋白,冰浴转膜,脱脂奶粉室温封闭。加入兔抗鼠Bmal1(1 ∶1 000),Beclin-1(1 ∶500)一抗4 ℃孵育过夜,加入羊抗兔二抗(1 ∶10 000)室温避光孵育1 h,用红外成像系统扫膜并分析测定条带灰度值。
1.3.4 透射电镜检测自噬小体 将6孔板弃上清,加入2.5%戊二醛1 ml,收集细胞,离心后弃上清,1%四氧化锇后固定后,采用醋酸双氧铀-枸橼酸铅双重染色,透射电镜下计数自噬小体数量。
1.4 统计学方法

2 结果
2.1 氧化应激相关指标结果
与NG组相比,HG组和NH/R组SOD降低,LDH、ROS、MDA升高(P<0.05);与NH/R组相比,HH/R组SOD降低,LDH、ROS、MDA升高(P<0.05);与HG组相比,HH/R组SOD降低,LDH、ROS、MDA升高(P<0.05,见表1)。
表1 PC-12细胞活性变化及氧化应激指标的变化
Table 1 Changes of cell activity and oxidative stress in PC-12 cells

LDH(U/L)ROS(AU)SOD(U/mg)MDA(nmol/mg)NG组133±123384±263187.9±14.62.26±0.32NH/R组204±17a6583±337a146.2±10.7a3.75±0.57aHG组231±26a6427±351a137.2±11.3a4.28±0.49aHH/R组422±32bc9822±462bc 95.7±8.4bc6.73±0.53bc
与NG组相比,aP<0.05;与NH/R组相比,bP<0.05;与HG组相比,cP<0.05
2.2 细胞凋亡指标检测
与NG组相比,HG组和NH/R组凋亡率升高(P<0.05);与NH/R组相比,HH/R组凋亡率升高(P<0.05);与HG组相比,HH/R组凋亡率升高(P<0.05,见图1,表2)。
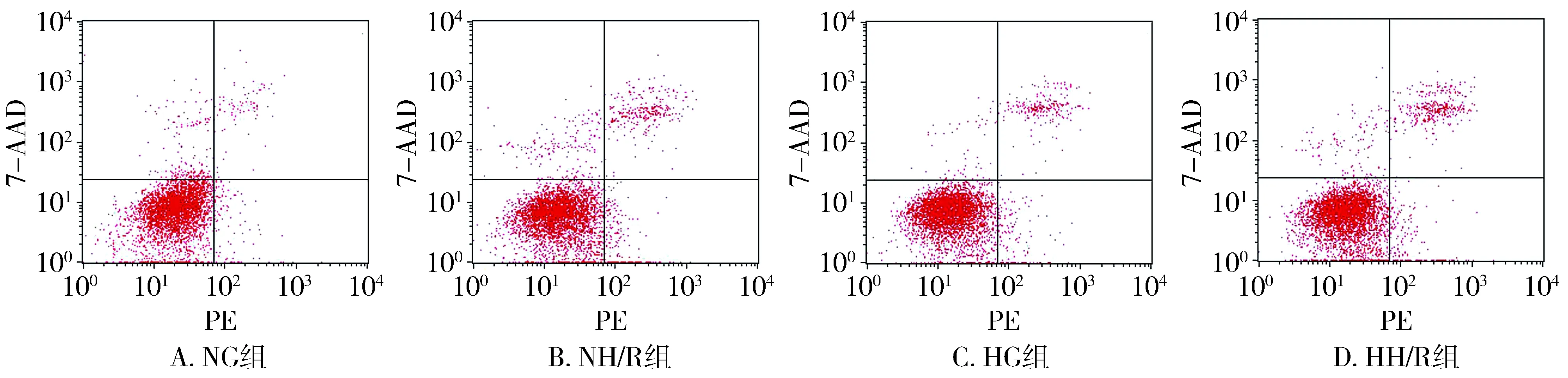
图1 四组流式细胞凋亡率的比较Figure 1 Comparison of apoptotic rates by flow cytometry in four groups
2.3 Bmal1及自噬指标检测
与NG组相比,NH/R组Bmal1降低,Beclin-1升高,自噬小体增多(P<0.05);与NG组相比,HG组Bmal1、Beclin-1降低,自噬小体减少(P<0.05);与NH/R组相比,HH/R组Bmal1、Beclin-1降低,自噬小体减少(P<0.05);与HG组相比,HH/R组Bmal1降低(P<0.05),Beclin-1、自噬小体无统计学差异(P>0.05,见表2,图2)。
表2 四组细胞凋亡率及时钟基因Bmal1和自噬相关蛋白的比较
Table 2 Cell apoptosis rate and Bmal1 and autophagy related protein expression in different groups
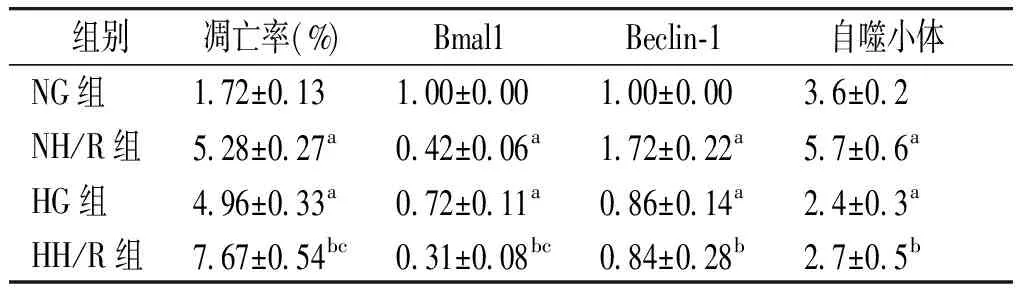
组别凋亡率(%) Bmal1 Beclin-1自噬小体NG组1.72±0.131.00±0.001.00±0.003.6±0.2NH/R组5.28±0.27a0.42±0.06a1.72±0.22a5.7±0.6aHG组4.96±0.33a0.72±0.11a0.86±0.14a2.4±0.3aHH/R组7.67±0.54bc0.31±0.08bc0.84±0.28b2.7±0.5b
与NG组相比,aP<0.05;与NH/R组相比,bP<0.05;与HG组相比,cP<0.05
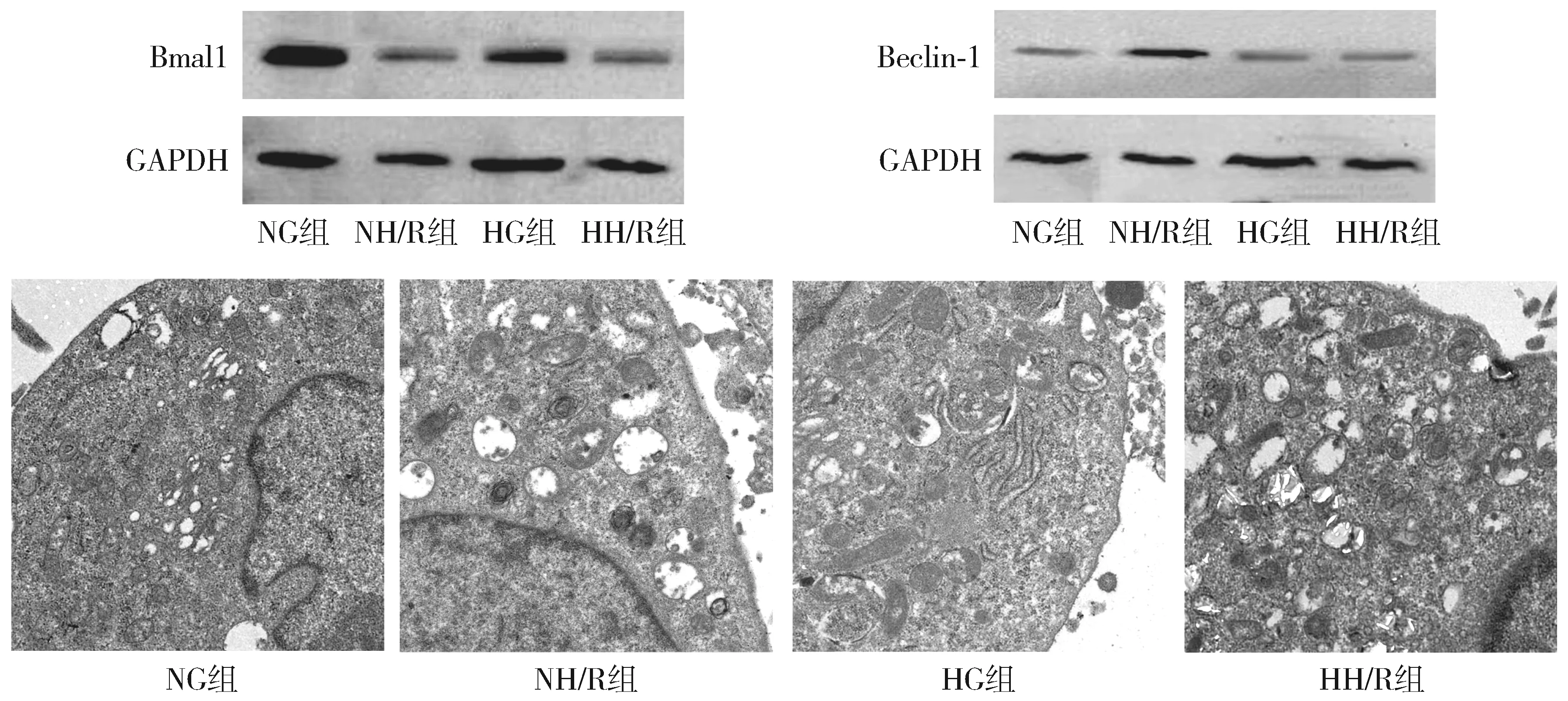
图2 四组间Bmal1、Beclin-1表达及自噬小体的变化Figure 2 Expression of Bmal1, Beclin-1 and autophagosome under TEM in four groups
3 讨论
生物钟是广泛存在于生物体内重要的内源性调节机制,生物钟节律及其稳定性是维持机体糖代谢平衡的重要机制之一,生物钟节律紊乱可促发糖尿病,反之糖尿病亦可导致生物钟节律紊乱[9]。时钟基因Bmal1作为维持生物钟节律稳定的关键基因,其更是能量代谢、生物钟节律负反馈环的重要介质。当时钟基因Bmal1表达降低时可导致糖代谢异常、胰岛素抵抗等疾病的发生[4,10]。
Bmal1在脑组织中广泛表达,研究发现,Bmal1可通过调节大脑中氧化还原基因的表达,进而调控氧化应激[11]。Bmal1缺失则会导致突触末梢受损变性,进而皮层连接功能受损,神经元氧化应激损伤加重[12]。同时,Bmal1还参与了机体内血管功能障碍和重塑等功能,进而调控脑缺血再灌注损伤的发生、发展及预后[13]。
糖尿病作为加重缺血性脑卒中的重要危险因素,在持续高糖环境下,脑卒中患者受损程度更重,梗死面积更大,而脑卒中又会导致应激性高血糖,从而形成恶性循环[14]。研究表明,自噬在缺血再灌注病理进程中发挥重要作用。具体表现为再灌注阶段ROS通过自噬的氧化修饰直接刺激自噬小体的形成进一步增强自噬,有效清除受损的细胞器,进而抑制其内源性凋亡通路[8,15]。因此,我们认为自噬在糖尿病脑卒中的发生发展过程中亦扮演着重要的作用。
我们研究结果发现,在高糖环境中,HG组较NG组相比,LDH、ROS、MDA升高,SOD降低,细胞凋亡率升高,表明高糖环境下细胞氧化应激增加,损伤严重,缺氧复氧后,HH/G组较HG组细胞损伤更加严重。我们进一步研究发现,在高糖环境中,HH/G组较HG组相比,自噬相关蛋白Beclin-1和自噬小体并没有显著增加,同时时钟基因Bmal1表达降低。因此,我们推测:自噬功能降低是糖尿病脑卒中的重要病理生理特征。高糖环境会破坏细胞自噬,从而引发神经组织产生病理改变。通过恢复自噬,排除机体内的有害分子促进细胞内稳态恢复,可能是改善这一病理生理现象的关键所在。然而当细胞内应激持续存在时(例如:高糖导致的ROS持续增多),自噬功能无法恢复,则会导致损伤无法修复,持续加重[16]。
综上所述,高糖诱导的氧化应激抑制时钟基因Bmal1的表达,进而导致自噬功能降低,加重缺氧复氧损伤。
