SOX2抗原HLA-A*0201限制性CTL表位的预测及鉴定
2020-03-02袁竞妍张忆雯杨拴盈
王 宇,袁竞妍,张忆雯,杨拴盈*
(1西安交通大学第二附属医院心血管外科,西安 710004;2西安交通大学第二附属医院呼吸与危重症医学科;*通讯作者,E-mail:yangshuanying66@163.com)
肺癌是最常见的恶性肿瘤之一,死亡率居各类肿瘤之首。美国的一项统计数据[1]显示,2016年肺癌死亡患者占所有癌症死亡人数的24%(男性)和23%(女性),无论在男性或者女性中肺癌均是肿瘤的首要死因。在中国,针对2013年肺癌发病及死亡分析的一项研究显示[2],当年肺癌新发病例数达73.28万人,因肺癌死亡患者约53.07万人,发病例数及死亡例数在全国所有恶性肿瘤中占比分别为19.90%和26.20%,均居恶性肿瘤的首位。以上数据说明肺癌将为全球人口健康和世界经济发展带来沉重负担。
传统的肺癌治疗方法效果不佳,肺癌患者死亡率高,5年生存率仅为4%-17%[3],免疫治疗近年来蓬勃发展。肺癌疫苗是免疫治疗的一种,适合肿瘤负荷较小、复发危险性较大的患者,尤其是完全手术切除后和临床放化疗后达到完全(或部分)缓解的患者[4],如TG4010、MAGE-A3等在临床试验中已体现出一定的积极疗效[5,6]。MAGE多肽疫苗已被证明对黑色素瘤疗效确切[7]。多肽疫苗已在消除人类肿瘤转移灶和预防肿瘤复发方面显示出了一定的疗效。筛选免疫原性较强的多肽表位是多肽疫苗研发的重点。
SOX2是一种包含HMG DNA结构域的SRY相关性基因,在肺癌的发生、发展中扮演重要角色,是肺癌诊断、治疗的重要指标和靶点。本研究应用生物信息学软件对SOX2蛋白进行HLA-A*0201限制性CTL抗原表位的初步预测,选取3条优势表位肽,分别对其进行体外实验以检测其引起免疫效应的能力,筛选出免疫原性较强的多肽片段,为治疗性肺癌多肽疫苗的制备奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞株 T2细胞(TAP缺陷,HLA-A0201限制性),购于上海复祥生物科技有限公司,细胞悬浮生长,用含10%胎牛血清、1%青链霉素的RPMI1640培养基培养。人外周血单个核细胞(human peripheral blood mononuclear cells,PBMCs),供血者签署科学研究知情同意书后,抽取其外周血并从中分离而得,用混合培养基培养。
1.1.2 生物信息学软件 本次研究采用以下生物信息学软件:NCBI NP-00309(http://www.ncbi.nlm.nih.gov/protein/NP-003097.1);SYFPEITHI(http://www.syfpeithi.de);BIMAS(http://www-bimas.cit.nih.gov/molbio/hla-bind/);ProPred-I(http://imtech.res.in/raghava/propred1/)。
1.1.3 主要试剂 所用各种合成肽冻干粉,由郑州派和泰德医药科技有限公司合成。人β2微球蛋白(β2m),购自美国Sigma公司。APC标记的鼠抗人HLA-A2抗体,购自美国eBioscience公司。预包被IFN-γ ELISPOT检测试剂盒,购自深圳达科为生物技术有限公司。LDH检测试剂盒,购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 SOX2抗原的HLA-A*0201限制性CTL表位的生物信息学预测 在NCBI上进行SOX2蛋白氨基酸序列的查询,将得到的氨基酸序列分别输入SYFPEITHI、BIMAS和ProPred-1软件中,限定条件为:“长度为9个氨基酸残基的肽段”和“HLA-A*0201限制性表位”,选取3条评分高的9肽片段,现按评分由高到低依次用P1、P2、P3指代。
1.2.2 T2细胞结合实验 将密度为4×106/ml的T2细胞悬液以50 μl/孔的密度种在96孔板中,调整每孔内含3 μg/ml的人β2微球蛋白。每个实验肽均设100,50,25,12,6,3,1 μmol/L不同浓度组,设阳性表位肽(FLPSDFFPSV)组和阴性表位肽(AHTKDGFNF)组,设空白对照组(仅加溶剂和3 μg/ml人β2微球蛋白)。将上述孔板放入37 ℃ 5%CO2孵箱中孵育18 h,将孔板取出,洗涤细胞后用100 μl 0.01 mol/L PBS溶液重悬,加入5 μl APC标记的鼠抗人HLA-A2抗体,4 ℃冰箱孵育30 min,从冰箱取出后洗涤细胞,再用300 μl 1%多聚甲醛重悬固定至少20 min,随后流式细胞仪检测APC荧光强度。用HLA-A2分子平均荧光强度增加的百分数(%MFI increase)来衡量各实验肽的抗原性,计算公式:%MFI increase=[(实验肽MFI-空白对照组的MFI)/空白对照组的MFI]×100%。
1.2.3 人PBMCs的分离和鉴定 本研究招募健康志愿者5名,按照操作说明用淋巴细胞分离液进行PBMCs的分离,制备细胞悬液,采用流式细胞仪检测别藻青蛋白(allophycocyanin,APC,一种染料)的荧光强度,选取荧光强度较强的健康人作为后续实验的供血者。
1.2.4 效应细胞的诱导 用不含肽的混合培养基和含10 μmol/L合成肽(P1、P2、P3、阳性肽、阴性肽分别培养,每种溶液仅含一种肽)的混合培养基分别重悬PBMCs细胞,在96孔板中按照每孔2×105个细胞的密度进行细胞接种,每孔总体积200 μl,37 ℃ 5%CO2孵箱中培养,每隔2 d分别用不含肽的混合培养基和含20 μmol/L相对应合成肽的混合培养基给细胞进行换液。
1.2.5 靶细胞的诱导 各实验肽诱导的靶细胞制备:用混合培养基将T2细胞重悬为1×106个/ml密度的细胞悬液,取5 ml分为5管,每管中加入5 μl 0.4 mmol/L的不同肽(P1、P2、P3、阳性肽、阴性肽)溶液,混匀。
总而言之,现阶段房屋建筑工程数量及规模已然呈现出逐年增长的发展态势,因此为更好的保障房屋建筑工程质量,实现工程稳定有序建设目标,相关管理部门就应从认清建筑土建施工中质量监督管理重要性入手,结合工程具体建设需求,构建科学且长效土质量管理机制,及时发现工程施工中存在的风险因素,更好的降低工程事故发生几率。
抗体封闭的T2细胞制备:用混合培养基将T2细胞重悬为1×106个/ml密度的细胞悬液,取5 ml加入250 μl APC标记的鼠抗人HLA-A2抗体,4 ℃冰箱孵育30 min,洗涤3遍,用5 ml混合培养基重悬后分为5管,每管中加入5 μl 0.4 mmol/L的不同肽(P1、P2、P3、阳性肽、阴性肽)溶液,混匀。
1.2.6 hIFN-γ ELISPOT实验 收集诱导第15天的效应细胞,将未经肽刺激的PBMCs和不同肽诱导的效应细胞按5×104个/孔的密度接种于96孔板上,同时设只含培养基的空白对照组。将孔板分为三部分:第一部分为参照组,将10 μl 25 μg/ml的有丝分裂原PHA溶液分别加入不同肽诱导的效应细胞及一组未经肽刺激的PBMCs细胞中制备而得,使得各种合成肽诱导的PBMCs与有丝分裂原PHA反应;第二部分为实验组,将50 μl各实验肽诱导的T2细胞悬液分别加入不同肽诱导的效应细胞及一组未经肽刺激的PBMCs细胞中制备而得,使得各种合成肽诱导的PBMCs与相应肽诱导的T2细胞反应;第三部分为抗体封闭组,将50 μl结合对应肽抗体封闭的T2细胞悬液分别加入不同肽诱导的效应细胞及一组未经肽刺激的PBMCs细胞中制备而得,使得各种合成肽诱导的PBMCs与HLA-A2抗体封闭的相应肽所诱导的T2细胞反应。每个孔设2个复孔。置于37 ℃ 5% CO2孵箱中培养18 h,取出孔板,按照试剂盒操作说明进行显色后寄回深圳达科为生物技术有限公司进行读板。
1.2.7 LDH释放实验 在96孔板中分别加入100 μl密度为1×105个/ml的各种靶细胞悬液,再相应地加入100 μl对应合成肽诱导的PBMCs细胞,效靶比为5 ∶1-20 ∶1。每组预留出不加效应细胞的靶细胞自然释放组(加100 μl培养液)和最大释放组(加入100 μl 2%Triton X-100),每孔设2个复孔。置于37 ℃ 5%CO2孵箱中培养4 h后取出孔板,离心后每孔吸出20 μl上清加入到另一块96孔板,按照试剂盒操作说明进行显色,在波长450 nm处酶标仪检测各孔OD值。杀伤活性的计算公式:杀伤活性(%)=[(实验组OD值-自然释放组OD值)/(最大释放组OD值-自然释放组OD值)]×100%。
1.3 统计学方法

2 结果
2.1 HLA-A*0201限制性CTL表位的生物信息学预测
在NCBI上查询SOX2蛋白氨基酸序列,可得到317个氨基酸残基序列,如下:
1 MYNMMETELKPPGPQQTSGGGGGNSTAAAAGG NQKNSPDRVKRPMNAFMVWSRGQRRKMA
61 QENPKMHNSEISKRLGAEWKLLSETEKRPFIDE AKRLRALHMKEHPDYKYRPRRKTKTLM
121 KKDKYTLPGGLLAPGGNSMASGVGVGAGLGAG VNQRMDSYAHMNGWSNGSYSMMQDQLGY
181 PQHPGLNAHGAAQMQPMHRYDVSALQYNSMT SSQTYMNGSPTYSMSYSQQGTPGMALGSM
241 GSVVKSEASSSPPVVTSSSHSRAPCQAGDLRDM ISMYLPGAEVPEPAAPSRLHMSQHYQS
301 GPVPGTAINGTLPLSHM
用SYFPEITHI软件预测得到评分较高的前5条多肽:SMYLPGAEV、LLAPGGNSM、LMKKDKYTL、ALGSMGSVV、TAINGTLPL(见表1)。
用BIMAS软件预测得到评分较高的前5条多肽:SMYLPGAEV、TLMKKDKYT、RLGAEWKLL、ALGSMGSVV、SMTSSQTYM(见表2)。
用ProPred-1软件预测得到评分较高的前5条多肽:SMYLPGAEV、TLMKKDKYT、RLGAEWKLL、ALGSMGSVV、SMTSSQTYM(见表3)。
综合分析上述结果,选取3条九肽:SMYLPGAEV、TLMKKDKYT、ALGSMGSVV,依次用P1、P2、P3指代。
2.2 T2细胞结合实验
经流式细胞术检测,不同肽处理后,T2细胞表面的HLA-A2分子表达出现变化,体现在平均荧光强度增长百分数的改变上。肽浓度为100 μmol/L和50 μmol/L时,与其他组相比P1组%MFI increase明显增高,差异有统计学意义(P<0.05,见图1)。
表1 SYFPEITHI软件预测HLA-A*0201限制性CTL表位得分表
Table 1 Prediction score of HLA-A *0201 restricted CTL epitope by SYFPEITHI software
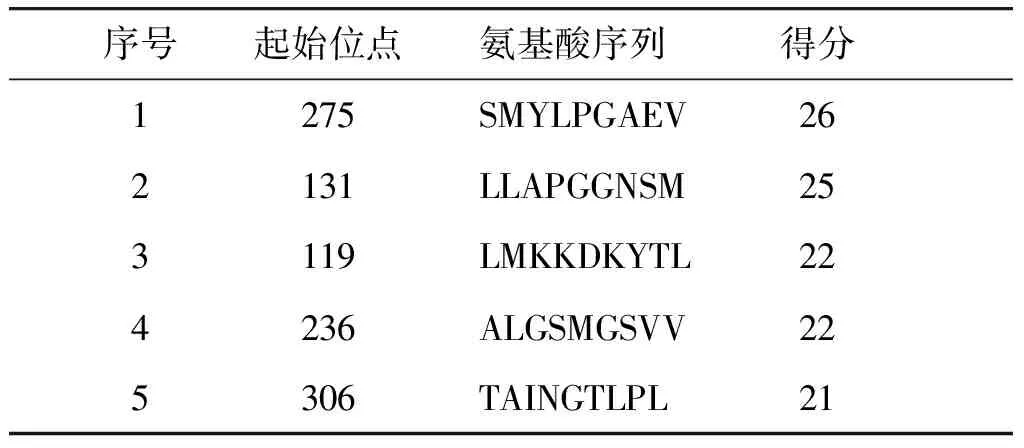
序号起始位点氨基酸序列得分1275SMYLPGAEV262131LLAPGGNSM253119LMKKDKYTL224236ALGSMGSVV225306TAINGTLPL21
表2 BIMAS软件预测HLA-A*0201限制性CTL表位得分表
Table 2 Prediction score of HLA-A *0201 restricted CTL epitope by BIMAS software
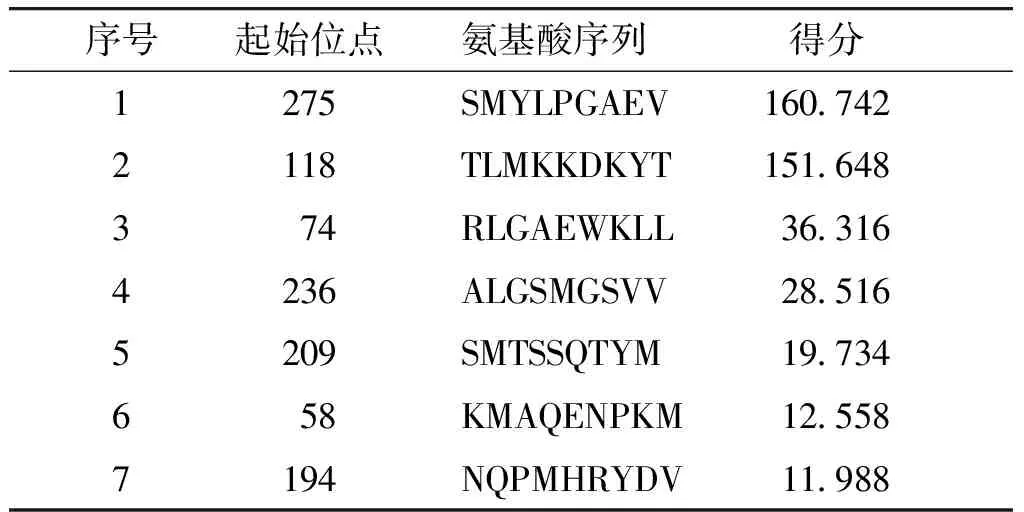
序号起始位点氨基酸序列得分1275SMYLPGAEV160.7422118TLMKKDKYT151.648374RLGAEWKLL36.3164236ALGSMGSVV28.5165209SMTSSQTYM19.734658KMAQENPKM12.5587194NQPMHRYDV11.988
表3 ProPred-1软件预测HLA-A*0201限制性CTL表位得分表
Table 3 Prediction score of HLA-A*0201 restricted CTL epitope by ProPred-1 software
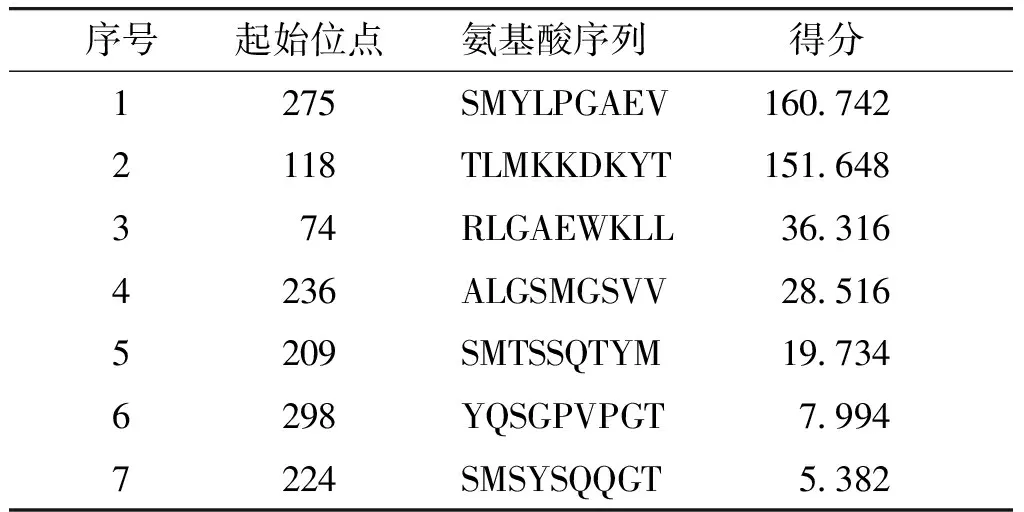
序号起始位点氨基酸序列得分1275SMYLPGAEV160.7422118TLMKKDKYT151.648374RLGAEWKLL36.3164236ALGSMGSVV28.5165209SMTSSQTYM19.7346298YQSGPVPGT7.9947224SMSYSQQGT5.382
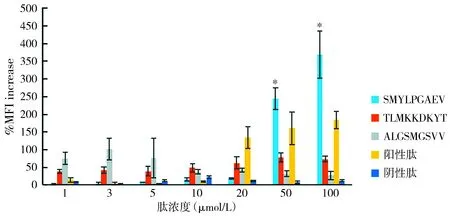
与其他肽组相比,*P<0.05图1 不同浓度各合成肽诱导T2细胞后%MFI increase的改变Figure 1 The changes of %median fluorescence intensity increase in T2 cells induced by different concentrations of different synthetic peptides
2.3 hIFN-γ ELISPOT实验
第一部分各组之间斑点数目有肉眼可辨的差异(见图2)。P1组斑点数目[(359.5±6.36)个]明显多于P2组[(279.5±9.19)个]和P3组[(278.5±13.44)个],差异有统计学意义(P<0.05);阳性肽组斑点数目[(413±11.31)个]明显多于阴性肽组[(291.5±19.09)个],差异有统计学意义(P<0.05)。
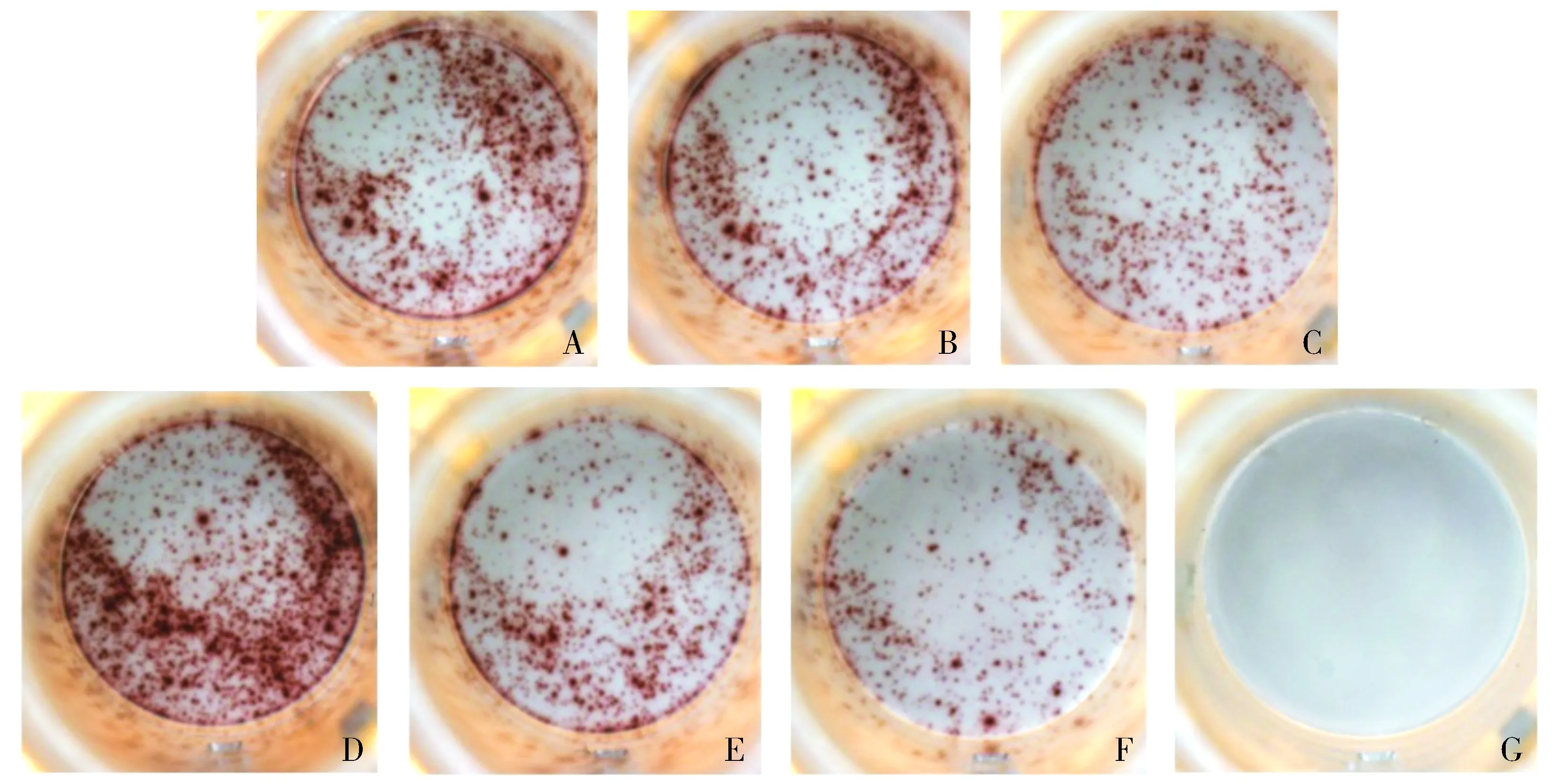
A.SMYLPGAEV诱导组;B.TLMKKDKYT诱导组;C.ALGSMGSVV诱导组;D.阳性肽诱导组;E.阴性肽诱导组;F.无肽诱导组;G.无细胞组图2 效应细胞与PHA反应的hIFN-γ ELISPOT实验斑点Figure 2 The spots of reaction between effector cells and PHA in hIFN-γ ELISPOT test
第二、三部分斑点肉眼难以分辨,在读板仪上读板后得到相应数据。阳性肽组第二部分斑点数大于第三部分,且此组斑点数明显多于其他各组,差异有统计学意义(P<0.05,见表4)。
表4 不同肽诱导的效应细胞与PHA组、诱导T2组、抗体封闭组的相应靶细胞相互反应产生的hIFN-γ ELISPOT实验斑点数(个)
Table 4 The number of spots of reaction between effector cells induced by different peptides and target cells in PHA group, induced T2 group, antibody-blocking group in hIFN-γ ELISPOT test
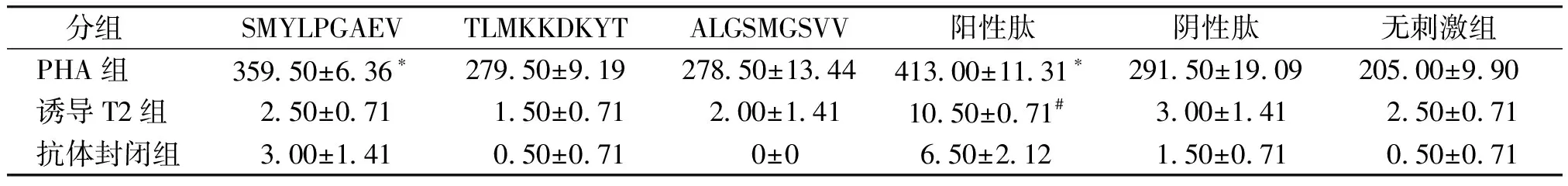
分组 SMYLPGAEVTLMKKDKYTALGSMGSVV阳性肽阴性肽无刺激组 PHA组359.50±6.36∗279.50±9.19278.50±13.44413.00±11.31∗291.50±19.09205.00±9.90 诱导T2组2.50±0.711.50±0.71 2.00±1.4110.50±0.71# 3.00±1.412.50±0.71 抗体封闭组3.00±1.410.50±0.71 0±06.50±2.12 1.50±0.710.50±0.71
与TLMKKDKYT组、ALGSMGSVV组和阴性肽组相比,*P<0.05;与抗体封闭组相比,#P<0.05
2.4 LDH释放实验
各合成肽诱导的PBMCs作为效应细胞,杀伤相应肽诱导的T2细胞(靶细胞),通过检测LDH的释放量的改变来评估杀伤效果,趋势见图3。各组效靶比P1组杀伤率明显高于阴性肽组,差异有统计学意义(P<0.05);效靶比20 ∶1和10 ∶1时,P2组杀伤率明显高于阴性肽组,差异有统计学意义(P<0.05)。P1、P2、阳性肽及阴性肽组,随着效靶比的增高,杀伤率逐渐增高。
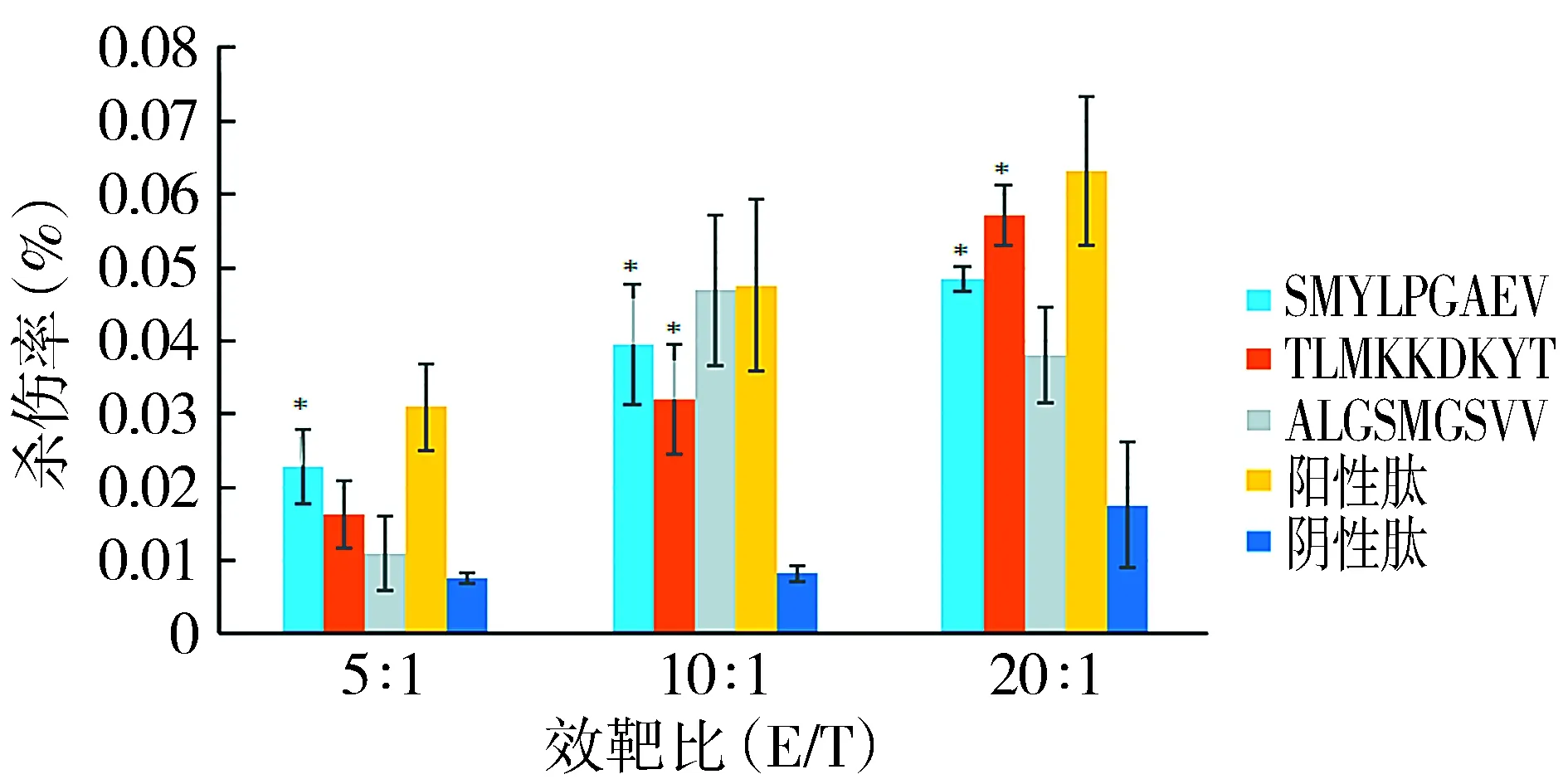
与阴性肽组相比,*P<0.05图3 各种肽诱导的效应细胞在不同效靶比时对靶细胞的杀伤率Figure 3 The killing rate of effector cells induced by various peptides at different E/T ratios
3 讨论
目前肿瘤疫苗的主要成分是肽、蛋白、重组载体及肿瘤细胞等具有免疫原性的肿瘤相关抗原,通过抗原提呈细胞的提呈和免疫佐剂辅助,达到增强疫苗免疫原性的目的。肿瘤通常通过降低肿瘤抗原处理相关转运蛋白(即肿瘤异常蛋白,tumor abnormal protein,TAP)的表达来逃脱CD8 T细胞免疫。在肿瘤免疫逃逸过程中出现的与损伤肽处理相关的T细胞表位是具有免疫原性的非突变新抗原。HLA-A2限制性表位属于上述表位,而且在已发生免疫逃逸的肿瘤治疗中很有前景[8]。SOX家族是一组转录因子,在胚胎发育和干细胞生物学中有举足轻重的作用。在多种类型肿瘤中均发现了SOX2基因的扩增,如胶质母细胞瘤以及许多鳞状细胞癌[9,10]。SOX2是多种肿瘤干细胞的标志物,并参与了干细胞自我更新的过程,且在非小细胞肺癌(non-small cell lung cancer,NSCLC)中已被证实[11]。因此,SOX2在肺癌的发生、发展中扮演重要角色,成为肺癌诊断、治疗的重要指标和靶点。本研究应用BIMAS、SYFPEITHI、ProPred-1软件对SOX2蛋白进行HLA-A*0201限制性CTL抗原表位的初步预测,选取3条优势表位肽:位点为275-283的表位肽SMYLPGAEV,在SYFPEITHI中评分为26分,在SYFPEITHI、ProPred-1中评分为160.742,处于第一;位点为118-126的表位肽TLMKKDKYT,在SYFPEITHI、ProPred-1中评分为151.648,处于第二;位点为74-82的表位肽RLGAEWKLL,在SYFPEITHI、ProPred-1中评分为36.316,处于第三,但并不在BIMAS软件所预测的前五名中;位点为236-244的表位肽ALGSMGSVV,在SYFPEITHI中评分为22,处于第四,在SYFPEITHI、ProPred-1中评分为28.516,处于第四。综合以上3个软件的结果,选取3个表位肽进入下一步实验:SMYLPGAEV、TLMKKDKYT和ALGSMGSVV。
CTL表位需经抗原提呈细胞处理加工与MHC Ⅰ类分子结合,进而呈递给T细胞受体,才可引起T细胞的免疫应答。较强的结合力是较高免疫原性的必要条件[12]。T2细胞缺失MHC Ⅱ基因大部分区域,细胞表面仅表达不含内源性抗原的MHC Ⅰ类分子,使得其合成的大部分MHC Ⅰ类分子在细胞表面不稳定,当温度为37 ℃左右时极其不稳定,但在特定条件下可以在细胞表面暂时稳定存在,如低温或添加外源抗原肽、单克隆抗体等[13]。基于以上观点,可知若外源抗原肽免疫原性较强,与MHC Ⅰ类分子有较强结合力,可使细胞表面的MHC Ⅰ类分子表达量暂时升高。通过检测MHC Ⅰ类分子在T2细胞表面表达量的多少,可以说明该外源性抗原肽的免疫原性强弱。本研究在经表位肽冲击诱导的T2细胞与HLA-A2的结合实验中,阳性肽与MHC Ⅰ类分子之间亲和力高,而阴性肽与MHC Ⅰ类分子之间亲和力低,与文献报道一致[14,15];在3条预测的SOX2表位肽中,SMYLPGAEV与MHC Ⅰ类分子结合力随着肽浓度的升高而升高,在肽浓度为50 μmol/L、100 μmol/L时%MFI increase数值分别为244.75±30.53和369.03±66.75,显著高于阳性肽数值160.48±46.31和183.93±24.15(P<0.05),说明该表位肽有较强免疫原性。
健康人PBMCs通过在体外经抗原冲击可获得抗原特异的T细胞。辅助T淋巴细胞1(Th1)能合成IFN-γ、IL-2等细胞因子,以促进CTL、NK细胞和巨噬细胞的活化和增殖,介导细胞毒效应的发生。细胞毒性T细胞(Tc)具有对靶细胞的直接破坏能力。因此,T细胞的免疫效应可通过体外细胞因子分析、细胞毒性分析等来验证。本实验中表位肽诱导出的CTLs的杀伤能力主要通过LDH释放实验和ELISPOT实验评价。在本研究的hIFN-γ ELISPOT实验中,SMYLPGAEV组显著多于TLMKKDKYT组、ALGSMGSVV组,后两组无明显差异。直接杀伤实验(LDH释放实验)结果显示,表位肽SMYLPGAEV诱导的效应细胞对靶细胞的杀伤率在效靶比为5 ∶1,10 ∶1,20 ∶1时分别为22.90±5.00,39.50±8.29,48.44±1.74,表位肽TLMKKDKYT诱导的效应细胞对靶细胞的杀伤率在效靶比为10 ∶1,20 ∶1时分别为32.10±7.43,57.18±4.16,阴性肽诱导的效应细胞对靶细胞的杀伤率在效靶比为5 ∶1,10 ∶1,20 ∶1时分别为7.76±0.70,8.29±1.17,17.60±8.56,表位肽SMYLPGAEV组和TLMKKDKYT组均高于阴性肽组,且差异具有统计学意义(P<0.05)。
综合本实验研究结果分析可得以下结论:表位肽SMYLPGAEV具有更优的免疫学效应,可用于肺癌疫苗的制备。本研究结果为肺癌疫苗的研发奠定了基础。
