n-3多不饱和脂肪酸对注意缺陷多动障碍小鼠脑组织炎症的影响
2020-03-02申文雯戚小红
申文雯,戚小红
(首都医科大学宣武医院儿科,北京 100053;*通讯作者,E-mail:meiwenqi@yeah.net)
注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)是目前儿童中最常见的一种神经发育障碍性疾病,以注意力缺损、多动、冲动行为为主要症状,在我国的发病率呈逐年上升趋势。基因、家庭教育、环境及饮食因素均参与了ADHD发生,此外有研究报道还指出ADHD是一种高炎症及免疫相关性疾病[1]。至今,关于儿童ADHD的发病机制仍不十分清楚,其中神经系统免疫及炎症改变可能在ADHD发生发展中发挥着十分重要作用[2]。
脑组织中炎性反应相关因子除了可由单核巨噬细胞、淋巴细胞、成纤维细胞和血管内皮细胞等免疫细胞合成外,激活的星形胶质细胞也具有吞噬功能,并能分泌多种炎性因子。激活的单核细胞、胶质细胞可分化为2种明显不同的极化状态:M1和M2。M1型具有细胞毒性作用,可引起组织炎性损伤,M1型表面标志物包括iNOS、CD11b、CD16、CD32;M2型可抑制免疫反应,促进组织修复,M2型表面标志物包括CD206、Agr-1、CCL22等[3]。
n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3PUFAs)不仅在调节脂代谢、免疫、炎症反应等方面起着重要作用,而且对脑发育及其功能也至关重要[4]。已有研究表明膳食补充n-3 PUFAs可减少炎症介质的产生,减轻炎症反应,调节免疫功能[5]。那么对于ADHD小鼠模型来说,给予n-3 PUFAs喂养是否能有效减轻脑组织的炎症状态,对于临床辅助治疗ADHD有明显的指导意义。
1 材料与方法
1.1 动物分组与模型建立
自斯贝福(北京)生物技术有限公司(生产许可证:SCXK(京)2012-0006)购买30只12周龄雄性C57BL/6 J小鼠,体质量30-32 g。饲养于军事医学科学院实验动物中心。小鼠随机分为3组:ADHD组(n=10),ADHD+n-3 PUFAs组(n=10)及对照组(n=10)。
ADHD组小鼠称重后腹腔注射东莨菪碱(3 mg/kg,Sigma公司,美国),每天上午9:00-11:00统一给药,每日1次,连续给药14 d。由于东莨菪碱可与乙酰胆碱竞争M受体,从而抑制胆碱能神经突触的信息传递,特异性感觉传入受阻,小鼠活动次数显著增加,大脑出现精神不集中,注意力涣散,建立ADHD小鼠模型。ADHD+n-3 PUFAs组在构建ADHD小鼠模型后,给予鱼油(100 mg/kg)(汤臣倍健公司提供)剂量给予灌胃,连续灌胃14 d[6]。鱼油的成分为EPA和DHA,即n-3 PUFAs,不含有其他成分,直接喂养鱼油即是对小鼠给予n-3 PUFAs干预。对照组小鼠腹腔注射给予相应剂量的生理盐水。
1.2 脑炎症因子表达的测定
实验结束后,颈椎脱臼法处死小鼠,快速摘除脑组织,投入液氮中保存。取右侧半脑,称重,加9倍预冷PBS于电动匀浆器中匀浆,4 ℃离心10 min,取上清液。酶标仪测量上清液中IL-1β及TNF-α(由Ebioscience公司提供,货号分别为:BMS6002和BMS607-3)的OD值。
1.3 脑皮质M1和M2型巨噬细胞相关标记基因的测定
检测脑组织中M1和M2巨噬细胞相关标记基因iNOS、CD11b、CD16、CD32和CD206、Agr-1、CCL22的mRNA表达。选取左侧半脑,使用Trizol试剂盒(Cat.No.15596-026,Invitrogen公司,美国)对脑组织中的总RNA进行抽提,然后应用SuperScript TM II逆转录试剂盒(Cat.No.18080-051,Invitrogen公司,美国)将RNA逆转录成cDNA。采用SYBRGreen染料法对目的基因进行扩增。PCR反应条件为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸15 s和7 min,进行40个循环。小鼠M1及M2型巨噬细胞相关标记基因扩增引物见表1。
表1 荧光定量PCR所用引物序列
Table 1 Primer sequences used in fluorescence quantitative PCR
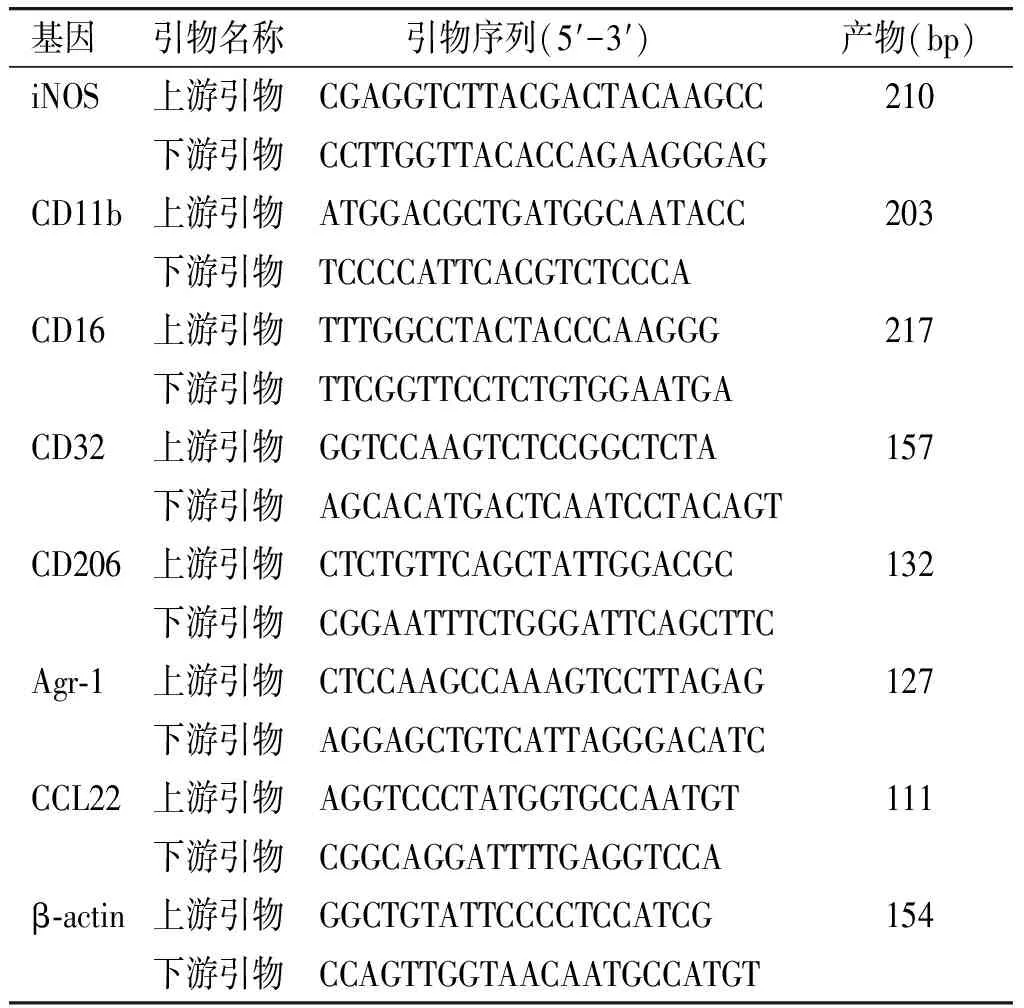
基因引物名称引物序列(5′-3′) 产物(bp)iNOS上游引物CGAGGTCTTACGACTACAAGCC210下游引物CCTTGGTTACACCAGAAGGGAGCD11b上游引物ATGGACGCTGATGGCAATACC203下游引物TCCCCATTCACGTCTCCCACD16上游引物TTTGGCCTACTACCCAAGGG217下游引物TTCGGTTCCTCTGTGGAATGACD32上游引物GGTCCAAGTCTCCGGCTCTA157下游引物AGCACATGACTCAATCCTACAGTCD206上游引物CTCTGTTCAGCTATTGGACGC132下游引物CGGAATTTCTGGGATTCAGCTTCAgr-1上游引物CTCCAAGCCAAAGTCCTTAGAG127下游引物AGGAGCTGTCATTAGGGACATCCCL22上游引物AGGTCCCTATGGTGCCAATGT111下游引物CGGCAGGATTTTGAGGTCCAβ-actin上游引物GGCTGTATTCCCCTCCATCG154下游引物CCAGTTGGTAACAATGCCATGT
1.4 统计学方法

2 结果
2.1 ADHD小鼠脑炎症因子表达变化及n-3 PUFAs的影响
与对照组相比,ADHD组脑组织IL-1β及TNF-α表达升高,差异有统计学意义(P<0.05)。ADHD+n-3 PUFAs组小鼠脑组织中IL-1β及TNF-α表达明显降低(P<0.05),但接近对照组水平(见图1,2)。

与对照组相比,*P<0.05;与ADHD组相比,#P<0.05图1 小鼠脑组织IL-1β的表达量Figure 1 The expression of IL-1β in brain of mice
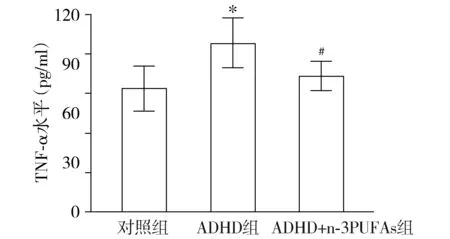
与对照组相比,*P<0.05;与ADHD组相比,#P<0.05图2 小鼠脑组织TNF-α的表达量Figure 2 The expression of TNF-α in brain of mice
2.2 ADHD小鼠脑组织M1和M2型巨噬细胞相关标记基因mRNA的表达及n-3 PUFAs影响
与对照组相比,ADHD组小鼠脑组织中M1型单核巨噬细胞相关标记基因mRNA表达量均明显升高,而ADHD+n-3 PUFAs组M1型单核巨噬细胞相关标记基因mRNA的表达量明显降低,其中以iNOS和CD32表达改变最为明显(见图3,4)。
与对照组相比,ADHD组小鼠M2型单核巨噬细胞相关标记基因中Agr-1 mRNA表达量明显降低,ADHD+n-3 PUFAs组M2型单核巨噬细胞相关标记基因的mRNA表达量并未明显提升(见图3,4)。
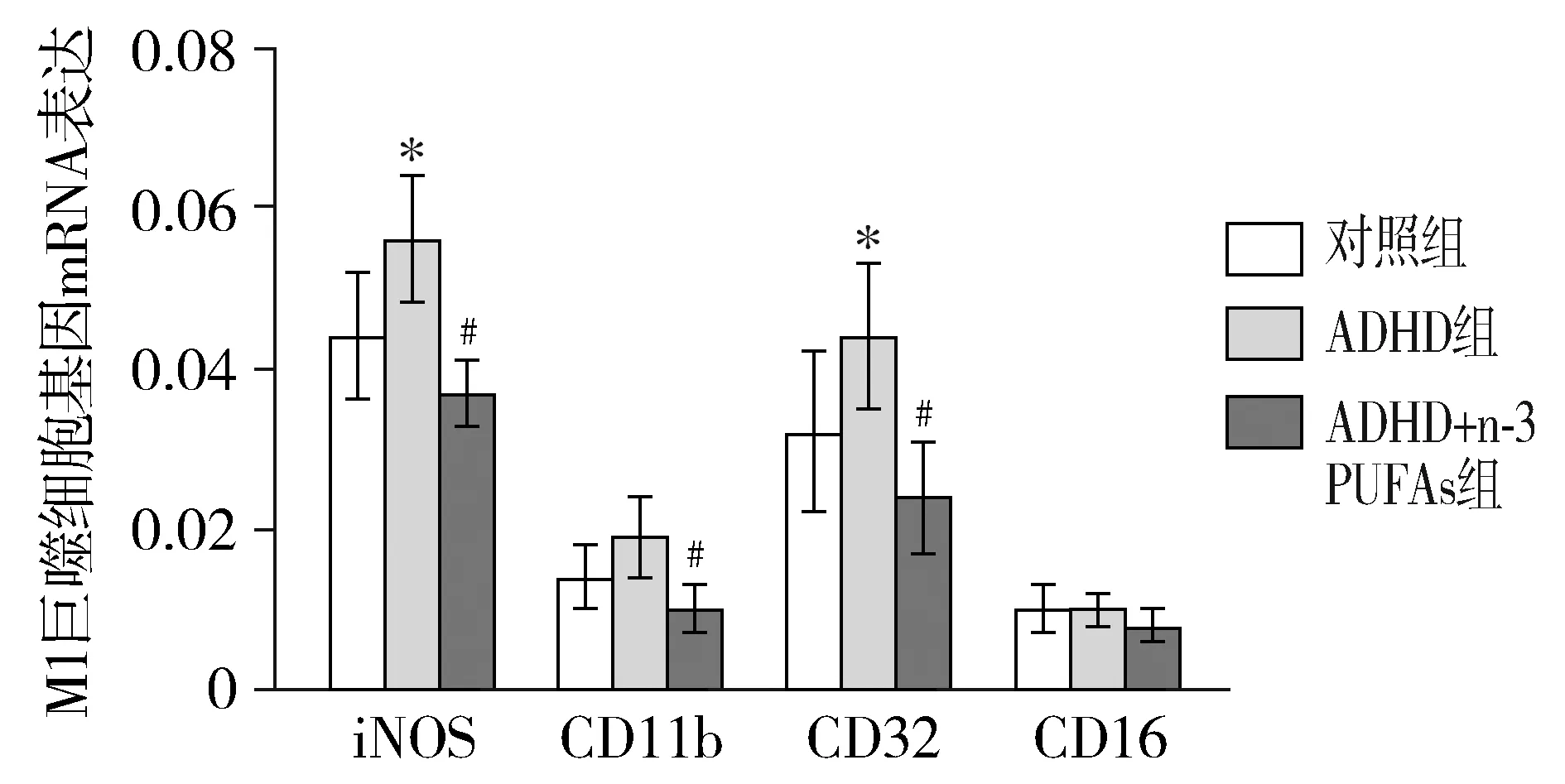
与对照组相比,*P<0.05;与ADHD组相比,#P<0.05图3 小鼠脑组织M1巨噬细胞相关标记基因mRNA的相对表达Figure 3 The expression of M1 macrophage related marker genes in brain of mice
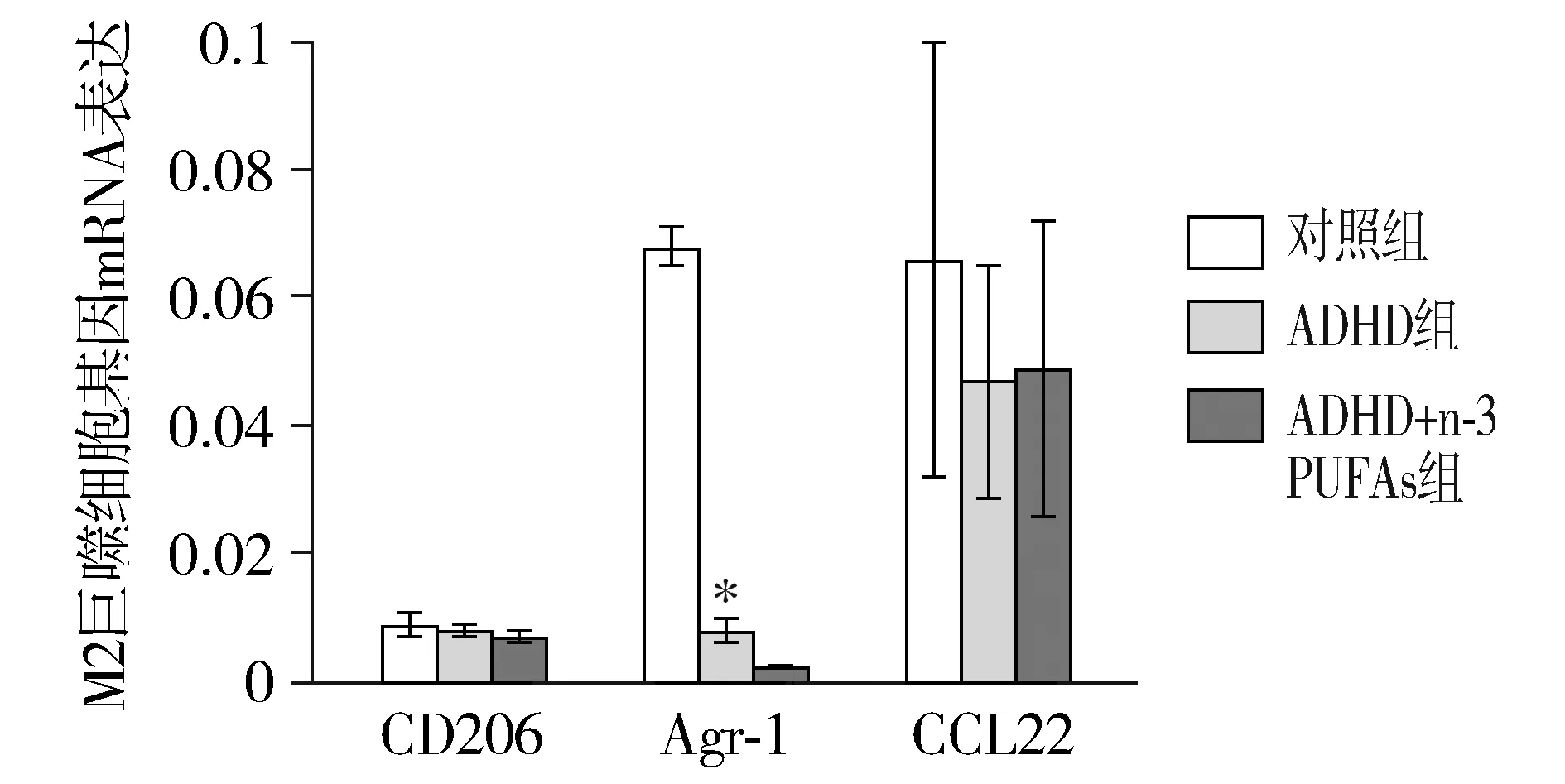
与对照组相比,*P<0.05;与ADHD组相比,#P<0.05图4 小鼠脑组织M2型巨噬细胞相关标记基因mRNA的相对表达Figure 4 The expression of M2 macrophage related marker genes in brain of mice
3 讨论
炎症在儿童ADHD发生中发挥十分重要的作用,ADHD儿童机体中炎症标记物,如中性粒细胞/淋巴细胞比值、可溶性细胞间黏附分子、IL-6、TNF-α、IL-1β等表达明显升高[7]。尤其是发育期炎症环境暴露是ADHD发生的高危因素,已有研究指出伴有免疫性疾病及处于高炎症状态的母亲其子代ADHD发病率明显升高[8]。ADHD动物模型也显示脑组织的炎症不仅可以影响脑结构发育,还可以改变神经递质系统(多巴胺能、五羟色胺能、谷氨酸能神经系统)功能,常伴有胶质细胞激活及神经免疫激活[3]。本研究应用腹腔注射东莨菪碱构建ADHD小鼠模型,观测其脑组织炎症因子IL-1β及TNF-α表达,结果同样显示这些炎症标记物表达明显升高。
脑组织的高炎症状态可能与单核细胞、胶质细胞活化有关。胶质/单核细胞在不同炎症阶段可活化为促炎M1型,分泌多种炎症因子,也可以活化为抗炎M2型,抑制促炎表型,有助于神经保护。动物实验表明胶质/单核细胞向M1型激活增多,可导致神经元及认知功能长久异常[9]。本研究显示ADHD小鼠脑组织中M1型巨噬细胞相关标记基因iNOS和CD32 mRNA表达明显增多,而M2型巨噬细胞相关标记基因Agr-1 mRNA表达明显减少。M1型巨噬细胞的过度激活可能是ADHD小鼠脑组织高炎症状态的原因之一。
随着对n-3 PUFAs研究的深入,人们发现ADHD等神经精神类疾病的发生与n-3 PUFAs缺乏密切相关[10],同时n-3 PUFAs的饮食摄入量及其红细胞膜中含量与疾病的严重度成负相关关系。而且应用EPA和DHA治疗能明显缓解ADHD患儿的临床症状[4]。我们的研究也显示,给予ADHD小鼠灌胃n-3 PUFAs,可以明显降低脑组织IL-1β及TNF-α炎性因子表达。究其原因,除了EPA和DHA可分别衍生为脂类活性分子E-resolvins(RvEs)和D-resolvins(RvDs)、protectin D1(PD1)而发挥较强的抗炎作用外,还可能与调控M1、M2激活改变有关[11]。本研究也显示给予n-3 PUFAs灌胃处理后能明显降低脑组织中M1型单核巨噬细胞相关标记基因iNOS、CD11b和CD32的mRNA表达,但未显示有助于提升M2型单核巨噬细胞相关标记基因的mRNA表达。
