GSPE对自发性蛛网膜下隙出血大鼠的脑保护作用
2020-03-02邓青山陶裕川周世军
邓青山,王 东,邱 俊,陶裕川,周世军,易 勇
(四川省宜宾市第二人民医院神经外科,宜宾 644000;*通讯作者,E-mail:taoqi748989489@163.com)
蛛网膜下隙出血(subarachnoid hemorrhage,SAH)是导致患者残疾和死亡的一种重要临床综合征,动脉瘤破裂为SAH的最主要原因。40%-80%的SAH患者发生迟发性脑血管痉挛及不同程度的脑缺血,从而导致患者神经功能损害,甚至死亡。尽管治疗措施不断改进和完善,目前仍缺乏有效手段来控制SAH后继发的病理机制。越来越多的研究表明SAH后急性脑损伤是导致SAH患者预后差的关键因素。而SAH后急性脑损伤的机制主要包括血脑屏障破坏、炎症反应、氧化应激、细胞凋亡等。诸多研究表明氧化应激和炎症反应在急性脑损伤的过程中发挥着至关重要的作用[1-3]。因此,发病早期通过各种治疗手段以减轻急性脑损伤,保护脑组织,或许能有效改善SAH导致的神经功能损害,防止后续严重并发症的发生。葡萄籽多酚提取物(grape seed polyphenol extract,GSPE)具有极强的抗氧化作用及自由基清除作用,体内及体外实验均证明GSPE可以有效改善氧化应激反应[4,5]。而且,GSPE比目前已知的主要抗氧化剂如Vit-C、Vit-E等,有更强的抗氧化活性[6]。研究表明GSPE具有显著的神经保护作用,能有效改善阿尔茨海默病[7]、缺血再灌注性脑损伤[8]、神经毒性损伤[9,10]等疾病的神经损伤,改善疾病进展。尽管GSPE在中枢神经系统多种疾病中有明确的作用,但GSPE对SAH后脑功能是否有相应保护作用,目前无相关研究。本研究通过GSPE对SAH模型大鼠的脑缺血面积、氧化应激、炎症指标的研究,以明确GSPE对SAH后神经功能的相关作用,以期为临床研究提供理论支持。
1 材料与方法
1.1 实验动物与分组
雄性SD大鼠,体质量约340-360 g,购自西南医科大学动物实验中心,实验动物生产许可证号:SCXK(川)2013-17。大鼠按随机表法分为以下三组:假手术组、对照剂组、GSPE组[经管胃饲GSPE 200 mg/(kg·d)],每组20只。10%的DMSO被用作GSPE的对照剂;药物管喂一日一次。
1.2 主要试剂
葡萄籽多酚提取物(GSPE),纯度>99%,购自北京艾泰思生物科技有限公司。DMSO购自美国Sigma公司。MDA检测试剂盒及SOD活性检测试剂盒购自江苏碧云天生物技术公司。Trizol试剂购自美国Sigma公司。FastQuant RT Kit试剂盒购自北京天根生物科技有限公司。Taq DNA聚合酶购自大连Takara公司。
1.3 蛛网膜下隙出血大鼠模型制备
对照剂组和GSPE组采用线刺法制备蛛网膜下隙出血(SAH)大鼠模型。用3.6%水合氯醛腹腔注射麻醉大鼠。常规消毒铺巾,颈正中切开皮肤,依次分离左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。将ECA结扎并剪断,拉直,使其与ICA成一直线。将直径为0.126 mm的尼龙线经ECA置入ICA内,并送至大脑前动脉(ACA)和大脑中动脉(MCA)的分叉点,当感觉有阻力时继续置入2 mm,造成SAH,然后迅速将尼龙线拔出。整个置线过程不超过30 s。拔出尼龙线后常规缝合手术切口。术毕将大鼠放回笼中复苏。手术成功后3 d,颈椎脱臼处死大鼠,断头取脑,蛛网膜下隙见血液或血凝块为模型成功。假手术组的操作步骤同模型组,但置线后不刺破血管。
1.4 脑缺血面积的评估
为了定量分析蛛网膜下隙出血后脑血管痉挛引起的继发性脑缺血,取手术后3 d大鼠用生理盐水心脏灌注,取脑组织进行冠状切片,切片用TTC染色,4%多聚甲醛固定24 h后,拍照。图片用Image J软件处理,计算脑缺血灶所占同侧大脑面积的百分比。
1.5 MDA和SOD的测定
断头处死大鼠后立即收集了大鼠大脑皮层标本。组织标本在冰RIPA裂解液中进行超声匀浆,4 ℃,12 000g离心10 min,收集上清液。上清液蛋白浓度用BCA法测定。取上清根据MDA试剂盒厂商提供的方法测量MDA水平,MDA浓度用nmol/mg蛋白质表示。SOD活性根据Total Superoxide Dismutase Assay试剂盒说明书测定,SOD活性用U/mg蛋白质表示。
1.6 RNA提取及qRT-PCR检测
采用Trizol试剂提取大脑皮层组织总RNA,通过FastQuant RT Kit试剂盒及其方法将RNA逆转录成cDNA。PCR反应由Taq DNA聚合酶及底物在qPCR仪中完成。反应体系总体积为20 μl,其中Rtaq Premix 10 μl,ddH2O 8 μl,25 nmol/L Forward Primer 0.5 μl,25 nmol/L Reverse Primer 0.5 μl;样本DNA 1 μl;扩增条件:所有受测基因均采用相同的扩增条件参数,95 ℃预变性1 min(1个循环);94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸1 min(35个循环);72 ℃延伸2 min(1个循环);4 ℃保持。使用的基因引物见表1。
1.7 统计学分析
表1 基因引物序列
Table 1 Primer sequences of genes

基因正义链 反义链 TNF-α5′-CGTCAGCCGATTTGCTATCT-3′5′-CGGACTCCGCAAAGTCTAAG-3′ICAM-15′-TTCACACTGAATGCCAGCTC-3′5′-GTCTGCTGAGACCCCTCTTG-3′IL-1β5′-GCCCATCCTCTGTGACTCAT-3′5′-AGGCCACAGGTATTTTGTCG-3′IL-65′-AGTTGCCTTCTTGGGACTGA-3′5′-TCCACGATTTCCCAGAGAAC-3′IL-105′-GCCTTGTCAGAAATGATCAAGTTTT-3′5′-TTTCTGGGCCATGGTTCTCT-3′β-actin5′-AGCCCCCTCTGAACCCTAAG-3′5′-CAACACAGCCTGGATGGCTAC-3′
2 结果
2.1 GSPE改善SAH大鼠脑缺血状况
通过评估脑缺血面积可以间接反映脑血管痉挛的严重程度。SAH模型鼠经GSPE或对照剂处理3 d后,取鼠脑标本测量脑缺血面积,结果显示,对照剂组大鼠脑缺血面积平均达31.6%,而GSPE处理后大鼠脑缺血面积显著减少(14.58%),组间差异有显著统计学意义(t=9.876,P<0.001,见图1)。
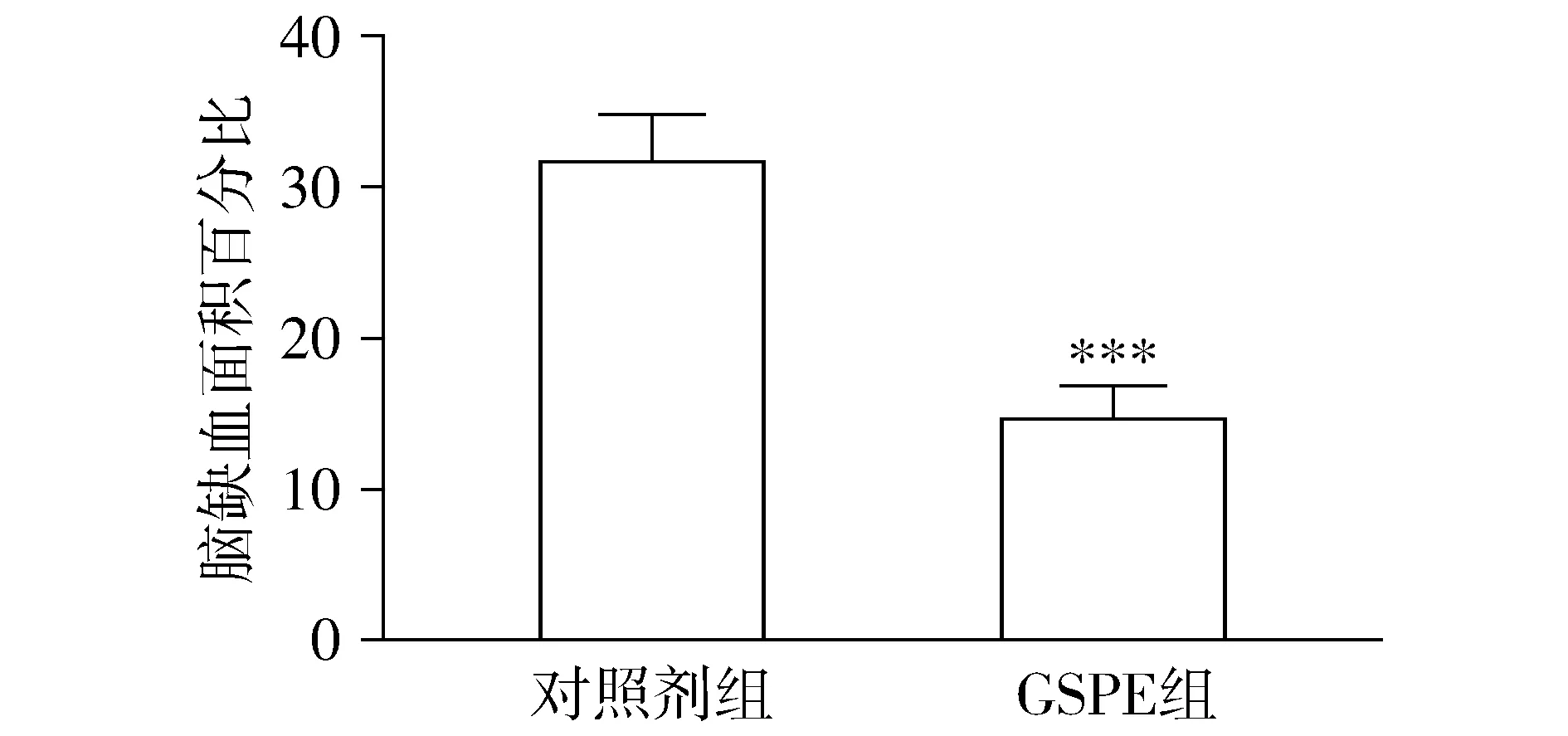
与对照剂组比较,***P<0.001图1 GSPE处理SAH模型鼠能改善脑血管痉挛致脑缺血面积Figure 1 GSPE treatment reduces the area of cerebral ischemia in SAH rats
2.2 GSPE改善SAH大鼠过氧化反应
本实验对MDA进行检测显示,假手术组MDA水平为(2.50±0.04)nmol/mg,对照剂组为(6.46±0.11)nmol/mg,而GSPE组为(3.48±0.12)nmol/mg。三组间MDA水平具有显著差异(F=403.44,P=0.000)。说明SAH会显著提高脑组织中MDA水平,而GSPE处理可以显著降低SAH模型鼠脑组织中MDA的水平,但GSPE处理仍无法将MDA降至正常水平(GSPE组与对照剂组比较,P<0.001,见图2)。
本实验对SOD进行检测显示,假手术组SOD平均水平为(0.40±0.01)U/mg,对照剂组SOD平均水平为(0.19±0.02)U/mg,而GSPE组SOD平均水平为(0.32±0.02)U/mg。各组大鼠整体分组效应具有显著差异(F=92.86,P=0.000),说明分组处理对各组大鼠的SOD水平有显著影响。SAH会显著降低脑组织中SOD的水平,而GSPE处理可以显著提高SAH模型鼠脑组织中SOD的水平(GSPE组与对照剂组比较,P<0.001,见图2),但仍然达不到假手术组脑组织中SOD的水平。
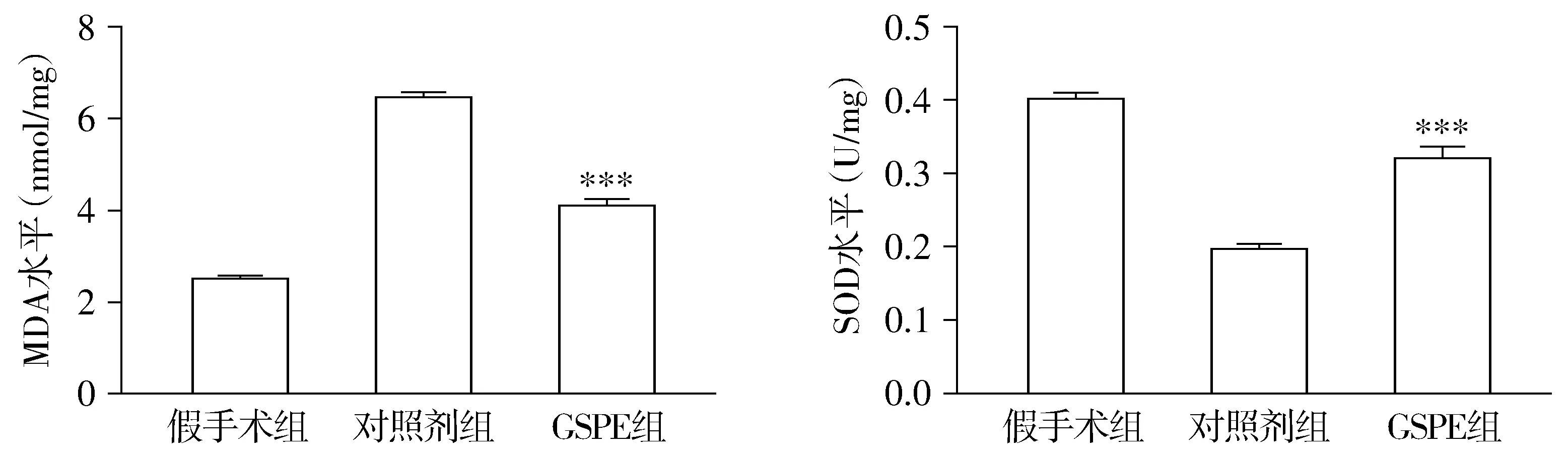
与对照剂组比较,***P<0.001图2 各组鼠脑中MDA与SOD检测结果Figure 2 The levels of MDA and SOD in brain tissues of different groups
2.3 GSPE处理改善SAH大鼠炎症反应
取鼠脑皮层标本提取RNA进行qPCR检测以研究相关炎症因子表达情况。各因子三组间检测结果比较差异均有统计学意义:TNF-α(F=89.44,P=0.000)、IL-1β(F=111.12,P=0.000)、IL-6(F=140.47,P=0.000)、ICAM-1(F=79.76,P=0.000)、IL-10(F=120.07,P=0.000)。与假手术组比较,对照剂组大脑皮层中TNF-α、ICAM-1、IL-1β、IL-6的RNA表达水平显著升高(均P<0.001);而经GSPE处理,可以使上述指标的RNA水平明显下降(均P<0.001),但仍然高于假手术组大脑皮层中这些炎症因子的表达水平(均P<0.01,见图3)。IL-10作为重要的抗炎细胞因子,对照剂组大脑皮层中IL-10水平轻微升高,而经GSPE处理后IL-10的水平有更显著的升高。
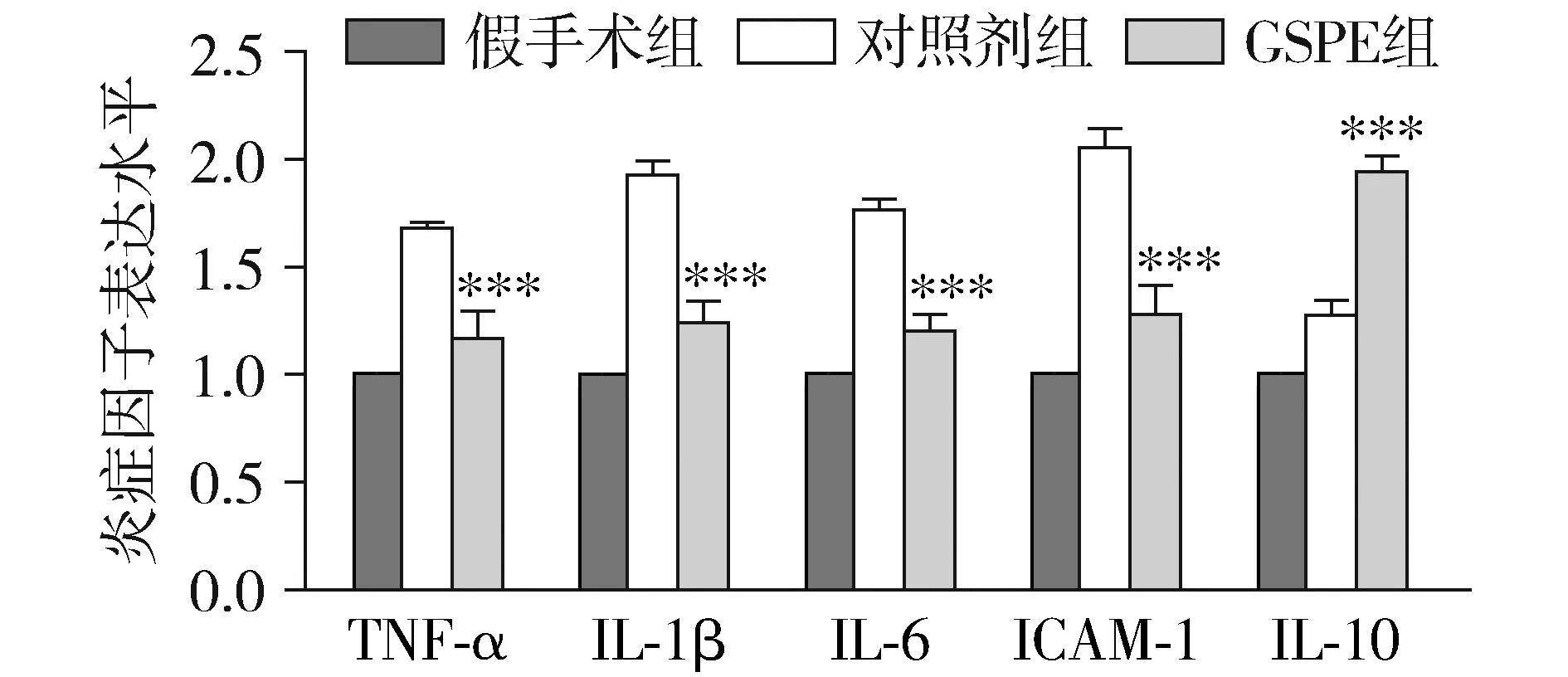
与对照剂组比较,***P<0.001图3 各组鼠脑皮层中TNF-α、ICAM-1、IL-1β、IL-6、IL-10 RNA表达水平检测结果Figure 3 The RNA expression levels of TNF-α,ICAM-1,IL-1β,IL-6,IL-10 in cortex of rats in different groups
3 讨论
蛛网膜下隙出血(subarachnoid hemorrhage,SAH)是严重威胁人类健康的神经血管性疾病,其发病率、致残率、致死率均非常高[11]。其发生与年龄、性别、种族等没有显著关系,且占所有卒中的7%左右[12]。SAH后因颅内压升高、脑血管痉挛等因素导致脑内灌注压及脑血流量降低,从而造成神经细胞的不可逆损伤。目前已经明确早期炎症反应在SAH后的急性脑损伤、脑血管痉挛过程中发挥着重要作用。且临床研究表明SAH后的血管痉挛及炎症反应主要与IL-1β、IL-6、IL-10、ICAM-1、TNF-α等炎症因子的水平密切相关[13,14]。其中IL-10是重要的抗炎细胞因子,在SAH后的炎症过程中发挥着改善炎症反应的保护性作用,而其余几个因子是重要的促炎细胞因子,在SAH后起着增强炎症反应、加重脑损伤的作用。尤其以IL-6在SAH后早期即高水平表达,是预测脑血管痉挛进展的早期标志[2]。这些事实表明抗炎治疗在SAH的治疗中至关重要。本实验经提取各实验组大鼠脑皮层的RNA对以上炎症基因进行检测,证实对照剂组中促炎因子的RNA水平均显著升高,抗炎因子的RNA水平均轻微升高;但经GSPE处理后促炎基因的转录水平显著减低,而抗炎因子IL-10的表达水平则进一步提高,说明GSPE具有明显的抗炎活性。这与GSPE在其他系统疾病,如哮喘[15]、关节炎[16]中的抗炎特性一致。另外,炎症反应在SAH后的血管痉挛中发挥着重要作用,抑制炎症因子的表达可以有效改善脑血管痉挛的程度[13]。本研究表明GSPE处理改善了SAH后炎症反应,同时显著减轻了SAH后脑缺血的面积。说明GSPE具有明确的抗炎活性,可调节炎症因子的转录水平,改善SAH后炎症损伤及脑缺血的发生。
SAH后由于脑组织供血不足,可生成大量自由基,从而诱发氧化应激反应的发生。氧化应激在诸多中枢神经系统疾病中起着免疫反应的应答器作用。氧化应激和抗氧化之间的平衡协调促进SAH后神经损伤的恢复。本研究结果表明SAH后皮层中脂质过氧化反应明显增强,导致SAH后氧化应激性损伤。GSPE处理明显逆转了这一病理性改变,显著降低了SAH后脑皮层中MDA水平,而明显上调了SOD水平,说明GSPE对脂质过氧化反应及氧化应激损伤有明显抑制作用,GSPE可有效保护SAH后氧化应激损伤。而氧化应激损伤作为SAH后急性脑损伤的重要机制之一,有效抑制氧化应激则可以在一定程度上避免急性脑损伤的发作,对脑组织起保护作用。
本文通过SAH模型鼠的研究证实GSPE对SAH具有神经保护性作用。具体机制如下:①GSPE通过抑制炎症反应,改善脑血管痉挛,增加脑供血,从而减少SAH后脑缺血区范围;②GSPE通过抑制脂质过氧化,增加自由基清除,从而抑制氧化应激反应,起到脑保护作用。本实验为GSPE在中枢神经系统疾病中的应用提供了新的理论依据,为SAH后急性脑损伤的治疗提供了一定的理论支持。
