FBXO11蛋白在透明细胞性肾细胞癌中表达的意义
2020-03-02刘天卿王红龙
温 爽,刘天卿,王红龙
(大连市友谊医院 病理科,辽宁 大连 116001)
透明细胞性肾细胞癌(clear cell renal cell carcinoma,CCRCC)是肾细胞癌的常见类型,其发病率逐年增加[1-2]。伴随影像技术的进步,小的CCRCC病灶在确诊病例比例中高达60%~80%,然而数据显示,病灶小的局限性CCRCC中仍然有20%~30%的肿瘤复发和远隔转移。因此,预测CCRCC患者的预后,实施针对性的术后治疗,才能延长患者的生存时间。目前尚无有效判断CCRCC患者预后的分子,寻找影响CCRCC预后相关的分子标记物有助于我们评估患者预后[3]。
泛素-蛋白酶系统是人体蛋白质降解的主要途径,可以选择性降解细胞内错误折叠的蛋白,调节细胞凋亡、转录及增殖。该系统降解蛋白的过程是多步骤的反应,需要包括泛素、泛素连接酶等多种蛋白质的参与,其中的泛素连接酶以F-box蛋白为亚基识别靶蛋白。在F-box蛋白家族中,FBXO11蛋白是重要成员之一,可选择性识别靶蛋白并对其进行泛素化和蛋白酶水解,FBXO11蛋白表达异常与一些疾病的发生相关[4-6]。有研究显示,在一些恶性肿瘤中FBXO11蛋白表达下调,无法降解诱导肿瘤细胞上皮间质转化(epithelial-mesenchymal transition, EMT)的Snail蛋白,致使肿瘤细胞向间质方向分化,肿瘤进展并转移[7]。也有学者认为FBXO11作为肿瘤抑制基因TP53的NEDD8连接酶可以介导P53蛋白[8]的内磷酸化和转录失活,致使P53失去抑制肿瘤生长的能力,促进乳腺癌的复发和转移,与患者预后较差相关。FBXO11在CCRCC中的表达与CCRCC患者临床病理特征和患者预后的关系尚不清楚。本研究检测了77例CCRCC组织和35例癌旁正常肾组织FBXO11蛋白的表达情况,分析FBXO11蛋白表达与CCRCC临床病理特征,特别是患者总生存期的关系,探讨FBXO11蛋白表达在判断CCRCC进展及患者预后中的作用。
1 材料和方法
1.1 临床资料
所有CCRCC标本均来自2003—2015年大连市友谊医院确诊的病例,共77例,其中男53例,女24例,平均年龄61岁(26~86岁);肿瘤直径1.3~17.0 cm,≤7 cm者55例,>7 cm者22例。所有患者术前、术后均未接受过放疗或化疗。肿瘤分级由两名有经验的病理医生根据2016版WHO分类标准独立完成[9]。其中G1和G2级59例,G3和G4级18例;T1和T2期64例,T3和T4期13例;无静脉癌栓者66例,有静脉癌栓者11例;无转移者60例,有转移者17例。电话随访所有病例,计算患者的总生存时间,起点为手术日期,终点为患者死亡日期和随访截止日期,以月为单位计算,最后随访日期为2015年12月。平均所有患者随访27.1个月(3~72个月)。癌旁正常肾组织35例,其中女性患者11例,男性患者24例,平均年龄60岁(45~84岁)。
1.2 方 法
标本经10%中性福尔马林固定后常规石蜡包埋,行4 μm连续切片,免疫组化专用过胶片捞片,60 ℃烤片1 h。免疫组化采用Max Vision法。一抗FBXO11(克隆号:ab110965),购自英国Abcam公司。PBS、过氧化物酶、二抗、DAB显色剂试剂盒均购自福州迈新生物技术有限公司。染色方法按说明书操作。
1.3 免疫组化染色结果判定
显微镜下观察肿瘤细胞浆出现棕黄色颗粒记为阳性细胞,当阳性细胞数与肿瘤细胞总数的比值≥40%为阳性表达,否则为阴性表达。
1.4 统计学方法
将临床资料及所得结果建立数据库,采用SPSS 19.0统计软件进行分析。应用chi-Square检验评估FBXO11蛋白表达与患者临床病理特征的关系。应用COX单因素分析判断CCRCC患者性别、年龄,肿瘤大小、组织学分级、肿瘤分期、有无静脉内癌栓、有无远处转移及FBXO11蛋白表达8项因素中影响CCRCC患者总生存期(overall survival,OS)缩短的因素。将单因素分析中有统计学意义的因素引入COX多因素模型,分析影响CCRCC患者OS缩短的独立危险因素。P<0.05为差异显著。
2 结 果
2.1 FBXO11蛋白在CCRCC及癌旁正常组织中的表达
FBXO11蛋白在CCRCC细胞浆内表达。FBXO11蛋白阳性表达率在CCRCC与癌旁正常组织中分别为48.1%与25.7%,在癌组织中的表达明显高于癌旁正常组织(P<0.05)。见图1。
2.2 FBXO11蛋白表达与CCRCC患者临床病理特征的关系
FBXO11蛋白阳性表达率在无静脉内癌栓与有静脉内癌栓组分别为39.4%与72.7%,无静脉内癌栓组明显低于有静脉内癌栓组(P<0.05);在不同性别、年龄、肿瘤最大径间无显著性差异(P均>0.05);在组织学分级G1~G2与G3~G4组分别为47.5%与50.0%,两组间无显著性差异(P>0.05);在肿瘤分期T1~T2与T3~T4组分别为46.9%与53.8%,两组间无显著性差异(P>0.05);在无远处转移与有远处转移组分别为46.7%与52.9%,两组间亦无显著性差异(P>0.05)。见表1。

A:正常肾小管中FBXO11蛋白阴性表达;B、C: CCRCC中FBXO11蛋白阳性表达图1 正常肾小管及CCRCC中FBXO11蛋白的免疫组化染色结果(×400) Fig 1 Results of immunohistochemical staining of FBXO11 protein in renal tubule and CCRCC(×400)
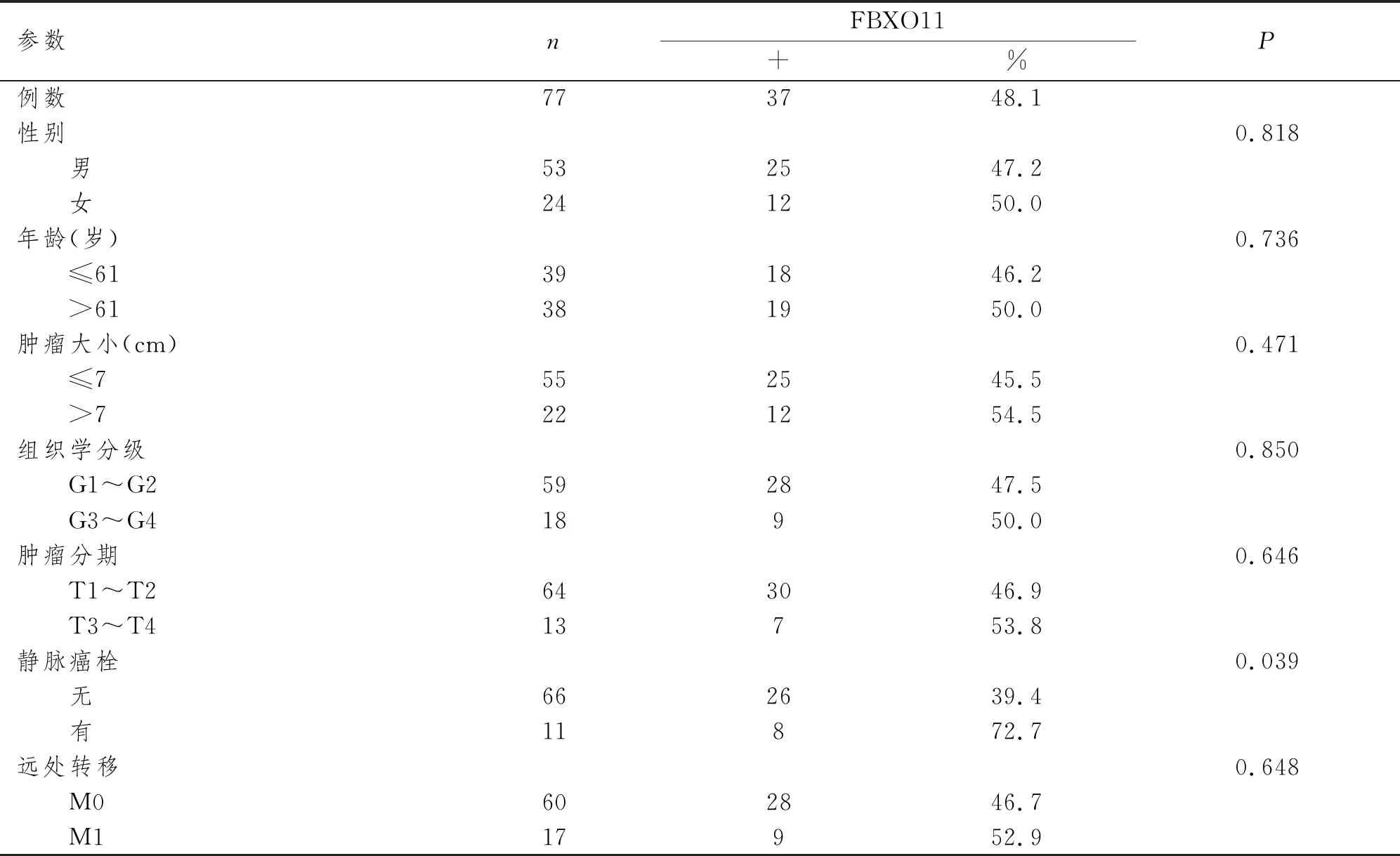
表1 CCRCC中FBXO11蛋白表达与患者临床病理特征的关系
2.3 患者临床病理特征及FBXO11蛋白表达与CCRCC患者OS的关系
2.3.1 COX单因素分析
将CCRCC患者性别、年龄,肿瘤大小、组织学分级、肿瘤分期、有无静脉内癌栓、有无远处转移及FBXO11蛋白表达8项因素进行COX单因素分析。分析结果显示,高组织学分级、远处转移和高表达FBXO11蛋白是影响CCRCC患者OS缩短的危险因素(P<0.05)。CCRCC患者生存分析函数图见图2。
2.3.2 COX多因素分析
将单因素分析中有统计学意义的3个因素即CCRCC高组织学分级、远处转移和高表达FBXO11蛋白引入COX多因素模型分析,结果显示高表达FBXO11是影响CCRCC患者OS缩短的独立危险因素(P<0.05)。见表2。
3 讨 论
尽管大部分CCRCC经外科手术能够获得较好的预后,但仍然有30%的患者术后复发或转移,而且临床研究显示少部分CCRCC尽管肿瘤病灶很小,也可能具有高度恶性的生物学行为,会在手术后短期内复发和转移。因此评估肿瘤进展情况对CCRCC患者的治疗及判断预后很有必要。目前仍未发现能够灵敏且特异地提示CCRCC侵袭转移的肿瘤标志物。近年来,越来越多的学者关注FBXO11蛋白在肿瘤进展中的作用及其对患者预后判断的潜力。目前有关FBXO11与CCRCC侵袭、转移能力的研究很少。

A:组织学分级。1:高级别;2:低级别;B:有无远处转移。1:无;2:有;C:FBXO11蛋白表达。1:低表达;2:高表达图2 CCRCC患者生存分析函数图Fig 2 Survival analysis in CCRCC patients

表2 COX多因素分析
FBXO11基因最初被定义为白癜风基因(VIT1),它在白癜风中表达下调[10]。FBXO11基因位于染色体2p21,编码由843个氨基酸组成的蛋白质,该蛋白的分子量为94 kDa。FBXO11是E3泛素连接酶复合物(也称为SCF复合物或CRL1FBXO11泛素连接酶),可以特异性识别底物,在泛素-蛋白酶系统中介导蛋白酶降解特定的底物,是调节细胞周期与基因组稳定性的主要因子[11-12]。有学者发现FBXO11在CCRCC中的表达高于正常肾组织,并且发现其在转移灶中的表达高于原发灶[13]。本研究显示在CCRCC组织中的阳性表达率为48.1%,明显高于癌旁正常肾组织中的25.7%,这提示FBXO11可能在CCRCC的发生中有一定的作用。本研究中FBXO11蛋白表达在有静脉癌栓的肿瘤明显高于无癌栓的,说明该蛋白可能参与并促进CCRCC的进展和演进。FBXO11可通过多种方法调节肿瘤形成及进展,例如抑制凋亡、促进EMT和抑制血管生成。研究发现FBXO11能介导抗凋亡蛋白Bcl-6的泛素化,使Bcl-6在泛素-蛋白酶系统的作用下被降解。在弥漫大B细胞淋巴瘤中,FBXO11基因一般是缺失或突变的,它无法降解Bcl-6蛋白,导致Bcl-6蛋白聚集,细胞凋亡减少,肿瘤发生并进展[14]。免疫印迹和免疫荧光结果显示,在胃癌中FBXO11通过PI3K/AKT通路介导肿瘤细胞发生EMT,促进胃癌细胞增殖、侵袭及迁移[15]。当FBXO11的泛素连接酶活性不稳定时,能够抑制缺氧诱导因子-1α(hypoxia inducible factor-1, HIF-1α)合成,抑制血管生成,从而促进胶质母细胞瘤细胞对缺氧的耐受[16-17]。CCRCC中高表达的FBXO11蛋白是否也通过上述一种或几种方式促进肿瘤发生和发展有待进一步研究。
目前的研究发现在一些癌症中FBXO11蛋白高表达的患者预后差。在骨肉瘤中FBXO11介导具有抑癌作用miR-376a的酶解,促进肿瘤细胞增殖、侵袭和凋亡,与患者OS缩短相关,FBXO11可能成为骨肉瘤患者判断预后的预测因子及靶向治疗的靶点[18]。在胃癌中FBXO11的过度表达与肿瘤体积大、淋巴结转移和TNM分期高有关,而且FBXO11高表达的胃癌患者的OS显著缩短[15]。在一项肺腺癌细胞研究中,敲除FBXO11基因后,其蛋白表达水平降低,而EMT转录因子Snail蛋白表达却随之升高,肿瘤细胞的迁移力显著增加,这可能由于增加的Snail蛋白通过抑制 E-cadherin 的转录与表达,改变癌细胞的表型和降低细胞间的黏附,使肿瘤细胞获得更大的迁移能力,并且诱导基底膜屏障破坏和EMT发生,从而促进肿瘤细胞的迁移、侵袭[19]。然而也有学者认为,FBXO11蛋白也可以发挥抑癌的作用。在乳腺癌和肺癌中FBXO11能介导泛素-蛋白酶系统泛素化并酶解EMT转录因子Snail,使癌细胞内的Snail蛋白水平下降,抑制肿瘤细胞发生EMT,抑制肿瘤细胞的迁徙和转移[6,8]。FBXO11不仅可以直接泛素化并酶解靶蛋白,同时也能间接地抑制靶蛋白的功能。比如,FBXO11能促进NEDD8与P53的结合,抑制P53的转录,从而抑制P53的功能[20]。本研究的单因素分析显示高表达FBXO11蛋白与患者OS缩短相关,且多因素分析提示高表达FBXO11蛋白是CCRCCC患者OS缩短的独立预后因素。以上结果提示高表达FBXO11与CCRCCC患者预后不良有关。本研究认为FBXO11可能参与了CCRCC的进展和演进。因此,FBXO11对判断CCRCC患者预后可能有一定临床意义。
FBXO11蛋白高表达是CCRCC患者预后不良的独立预测因子,提示其作为不良预后因子和潜在的治疗靶点可行性。然而要将其应用于临床还需多中心、大规模的研究及长期随访来证明其可行性及有效性。
