应用重组酶介导逆转录扩增技术快速登革病毒血清型鉴定
2020-02-22通信作者王永亮曹晓婉郑州海关河南郑州450003
张 勤(通信作者) 王永亮 曹晓婉 郑州海关(河南,郑州,450003)
左 锋 天津海关(天津,300450)
邱英华 付玉和 杭州众测生物科技有限公司(浙江,杭州,310000)
登革热是由4 种血清型的登革病毒(denguevirus,DVI~Ⅳ)引起的、经伊蚊传播的急性传染病。登革病毒感染除引起登革热外, 严重的还会导致登革出血热或登革休克综合征。 登革热广泛流行于全球热带及亚热带的100 多个国家和地区,据世界卫生组织统计, 全球大约有25 亿人口受到该病的威胁,每年约有5100 万人感染登革热病毒,造成25000 人死亡[1,2]。四种登革病毒在抗原上是密切相关的,一种登革病毒诱导机体产生的抗体可与其他型别的登革病毒结合,非但不能中和异形病毒,反而导致感染后病情的加重, 发展为登革出血热或登革休克综合征[3]。监测与防控登革热已成为国际公共卫生亟待解决的问题, 对登革病毒进行快速检测和分型,具有重要意义。 本研究采用RAA 技术,以DV NS1 基因区段分别设计DVⅠ、DVⅡ、DVⅢ和DV Ⅳ特异性引物和探针, 建立快速、 准确DENV 分型鉴定体系, 为口岸登革病毒防控提供技术支持。
1 材料与方法
1.1 材料
登革病毒阳性血清、黄热病毒阳性血清、基孔肯雅病毒阳性血清、寨卡病毒阳性血清、乙型脑炎病毒阳性血清均为本实验室保存的确诊血清样本。
1.2 主要试剂及仪器
QIAamp Viral RNA Mini Kit 购自德国Qiagen公司,RT-RAA 核酸扩增试剂盒购自杭州众测生物科技有限公司,QIACUBE 全自动核酸提取仪购自Qiagen 公司,核酸蛋白检测仪购自BioDrop DUO 公司,Genchek-2 荧光检测仪购自杭州众测生物科技有限公司。
1.3 方法
1.3.1 样品RNA 提取
取140μL 血清样本,采用Qiagen RNA Mini Kit按试剂盒说明书及QIACUBE 全自动核酸提取仪使用要求提取样本总RNA。 BioDrop DUO 核酸蛋白检测仪测定核酸浓度,分装后保存于-80℃冰箱。
1.3.2 I 型、Ⅱ型、Ⅲ型、Ⅳ型登革病毒RT-RAA 引物、探针的设计合成与筛选
根据GenBank 公布的登革病毒序列号,进行多序列比对, 应用Oligo 7.0 软件分别设计引物和探针。RT-RAA 引物长度一般为28~33bp,探针长度为48~52bp,设计多条正向引物和反向引物,将上游引物和下游引物分别进行组合,分别对不同的引物组合进行实验,来对引物组合进行筛选。 引物探针由擎科生物技术有限公司合成。 所对比的登革病毒序列号:DV I 所对比的登革病毒序列号为:
KT751350.1,KT751349.1,KT751348.1,KT751347.1,KT751346.1,KF385907.1,KF385907.1,KF385906.1,KF385905.1,KF385904.1,KF385903.1,KF385902.1,KF385901.1,KF385900.1,KF385891.1,KF385890.1,KF385889.1,KF385888.1,KF385887.1,KM925074.1,KM925073.1,KR057905.1,KR057904.1,KR057903.1,AY089980.1,AY089979.1,X69396.1,X69395.1,KJ418180.1,KU509249.1,KU509250.1,KU509251.1,KU509252.1,KU509253.1,KU509254.1,KU509255.1,KU509256.1,KU509257.1,KU509258.1,KU509259.1,KU509260.1,KU509261.1,KU509262.1,KU509263.1,KU509264.1,KU509265.1,KU509266.1,KX225483.1,KX225484.1,KX225490.1,KX225489.1,KX225488.1,KX225487.1,KX225491.1,KX225492.1,KX225493.1,KX452051.1,KX452052.1,KX452053.1,KX452054.1,KX452055.1,KX452056.1,KX452057.1,KX452058.1,KX452059.1,KX452060.1,KX452061.1。 DV Ⅱ所对比的登革病毒序列号为:
Z17213.1,U51930.1,U51929.1,U51928.1,M58493.1,M58492.1,M58491.1,M58490.1,M58489.1,M58488.1,M58487.1,M58486.1,U19778.1,AF457574.1,X69191.1,KT751363.1,KT751362.1,KT751361.1,KT751360.1,KT751359.1,KT751358.1,AY422469.1,AY871815.1,KF385913.1,KF385912.1,KF385911.1,KF385910.1,KF385909.1,KX452031.1,KX452046.1,KR779786.2,KX452015.1,KX452016.1,KX452017.1,KX452018.1,KX452019.1,KX452020.1,KX452021.1,KX452022.1,KX452024.1,KX452025.1,KX452026.1,KX452027.1,KX452028.1,KX452029.1,KX452030.1,KX452032.1,KX452037.1,KX452038.1,KX452039.1,KX452040.1,KX452041.1,KX452042.1,KX452043.1,KX452045.1,KX621245.1,KX621246.1,KY427084.1,KY427085.1,KY627762.1,KY627763.1,KY921904.1,KY921905.1,KY923048.1,LC129169.1,LC129170.1。 DV Ⅲ所对比的登革病毒序列号为:U93298.2,U93295.2,U93294.2,U93302.2,U93301.2,U93303.1,U93300.1,U93299.1,U93297.1,U93296.1,AY422470.1,KF385930.1,KF385929.1,KF385928.1,KF385927.1,KF385926.1,KF385925.1,KF385924.1,KF385923.1,KF385922.1,KF385921.1,KF385920.1,KF385919.1,KF385918.1,KF385917.1,KF385916.1,KF385915.1,KF385914.1,KC261634.1,GU189648.1,GU370053.1,GU370052.1,KX380842.1,KX380841.1,KX380840.1,KX380839.1,JQ920489.1,JQ920488.1,JQ920487.1,JQ920486.1,JQ920485.1,JQ920484.1,JQ920483.1,JQ920479.1,JQ920480.1,JQ045695.1,JQ045693.1,JQ045691.1,JQ045692.1,JQ045689.1,JQ045687.1,AB214881.1,M93130.1,AB214881.1,KU216208.1,MF370226.1。DV Ⅳ所对比的登革病毒序列号为:KR011349.2,KP140942.1,KR922405.1,JQ915090.1,JQ915089.1,JQ915088.1,JQ915087.1,JQ915086.1,JQ915085.1,JQ915084.1,JQ915083.1,JQ915082.1,JQ915081.1,FJ196850.1,FJ196849.1,KU523872.1,KU523871.1,KT794007.1,KP406806.1,JF262780.1,KC333651.1,JX024758.1,JX024757.1,JQ822247.1,JF741967.1,JN983813.1,KY920910.1,KY920909.1,KU745648.1,KU745647.1,KU745641.1,KU745640.1,KU745639.1,KU745645.1,KU745644.1,KU745643.1,KU745642.1。
1.3.3 反应体系和反应程序
采用Genchek-2 荧光检测仪进行实时荧光RAA 检测,参照试剂盒说明书配制RAA 反应体系,总体积50μL :A buffer 12.5μL,上下游引物各2μL,探 针0.6μL, 模 板2μL, 灭 菌ddH2O 28.4μL,B buffer2.5μL。 扩增条件设定在39℃,25min。
1.3.4 灵敏度检测
分别合成含有待检测DV I、DV Ⅱ、DV Ⅲ、DVⅣ基因序列的质粒, 将质粒梯度稀释为103、102、101copies/μl,检测方法的灵敏度。
1.3.5 特异性检测
用建立的方法分别检测黄热病毒阳性血清、基孔肯雅病毒阳性血清、寨卡病毒阳性血清、乙型脑炎病毒阳性血清、 四种登革病毒阳性血清进行检测,评价方法的特异性。
1.3.6 稳定性检测
用建立的方法重复检测黄热病毒阳性血清、基孔肯雅病毒阳性血清、寨卡病毒阳性血清、乙型脑炎病毒阳性血清、 四种登革病毒阳性血清4~6 次,评价方法的稳定性。
2 结果
2.1 引物的筛选及反应体系的建立
分别提取DV I 阳性血清、DV Ⅱ阳性血清、DVⅢ阳性血清、DV Ⅳ阳性血清核酸, 分别对DV I 7对引物组合、DV Ⅱ13 对引物组合、DV Ⅲ9 对引物组合和DV Ⅳ的5 对引物组合进行RT-RAA 扩增,根据对阳性样本检测中荧光值的强弱优选出引物探针,如表1 所示。 测定在50μL 反应体系中,当上下游引物工作浓度为10μmol/L 加入2μL,探针工作浓度为10μmol/L 加入0.6μL, 扩增温度为39℃,能获得最佳荧光吸收信号(见表1)。
2.2 灵敏度检测试验

表1 DVⅠ、DVⅡ、DVⅢ和DV Ⅳ特异性引物探针序列
测 定DV I、DV Ⅱ、DV Ⅲ、DV Ⅳ4 种 质 粒 浓度,以10 倍梯度稀释,进行RT-RAA 反应,结果如图1~图4 所示,5 分钟左右开始扩增,20 分钟可以完成,随着样品质粒浓度的降低,扩增时间相应延长,102copies/μl 浓度的样品都能被有效扩增。
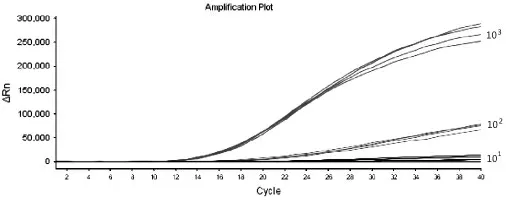
图1 DV I 阳性质粒灵敏度试验结果
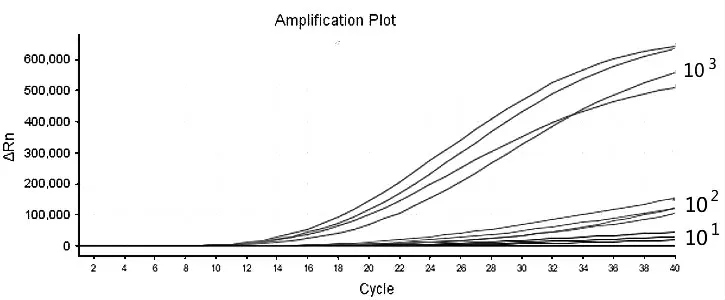
图2 DV Ⅱ阳性质粒灵敏度试验结果
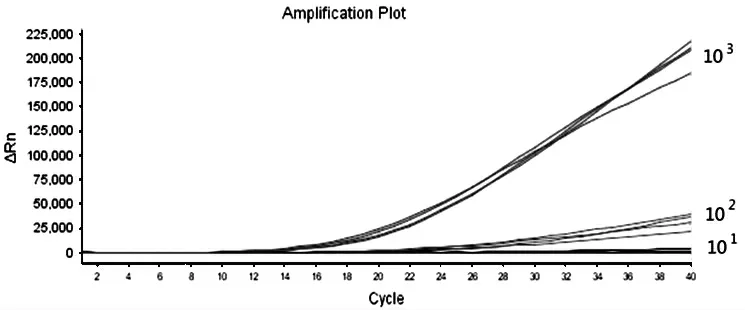
图3 DV Ⅲ阳性质粒灵敏度试验结果
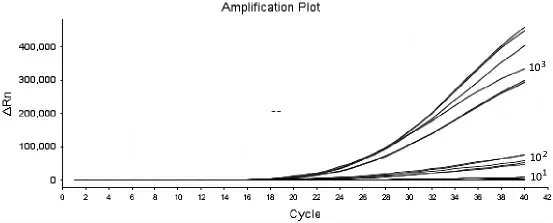
图4 DV Ⅳ阳性质粒灵敏度试验结果
2.3 特异性检测试验
提取基孔肯雅病毒阳性血清、黄热病毒阳性血清、寨卡病毒阳性血清、乙型脑炎病毒阳性血清、四种登革病毒阳性血清核酸,分别用DV I、DV Ⅱ、DVⅢ、DV Ⅳ引物探针及DV 通用型引物探针对上述样本进行RT-RAA 扩增, 每个试验设4~6 个重复,结果如图5~图8 显示, 使用DV I 特异性引物探针进行扩增, 则仅DV I 阳性血清出现特异性扩增曲线;使用DV Ⅱ特异性引物探针分别检测上述样本,则仅DV Ⅱ阳性血清出现特异性扩增曲线, 使用DV Ⅲ特异性引物探针分别检测上述样本,则仅DVⅢ阳性血清出现特异性扩增曲线, 使用DV Ⅳ特异性引物探针分别检测上述样本, 则仅DV Ⅳ阳性血清出现特异性扩增曲线,而四种登革病毒特异性引物探针扩增基孔肯亚病毒阳性血清、黄热病毒阳性血清、寨卡病毒阳性血清、乙型脑炎病毒阳性血清均为阴性,说明所建立的RT-RAA 方法具有良好的特异性。
1 为DVI 阳性血清的扩增曲线;2 为DV Ⅱ阳性血清、DV Ⅲ阳性血清、DV Ⅳ阳性血清、基孔肯雅病毒阳性血清、黄热病毒阳性血清、乙型脑炎病毒阳性血清、寨卡病毒阳性血清扩增曲线
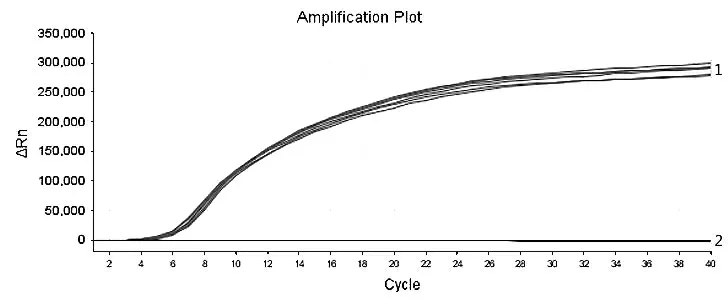
图5 DV I 特异性试验结果
1 为DVⅡ阳性血清的扩增曲线;2 为DV I 阳性血清、DV Ⅲ阳性血清、DV Ⅳ阳性血清、基孔肯雅病毒阳性血清、黄热病毒阳性血清、乙型脑炎病毒阳性血清、寨卡病毒阳性血清扩增曲线
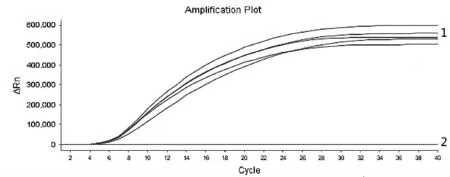
图6 DV Ⅱ特异性试验结果
1 为DVⅢ阳性血清的扩增曲线;2 为DV I 阳性血清、DV Ⅱ阳性血清、DV Ⅳ阳性血清、基孔肯雅病毒阳性血清、黄热病毒阳性血清、乙型脑炎病毒阳性血清、寨卡病毒阳性血清扩增曲线
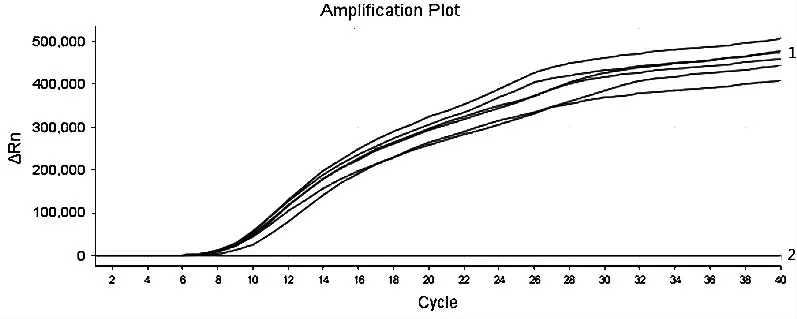
图7 DV Ⅲ特异性试验结果
1 为DVⅣ阳性血清的扩增曲线;2 为DV I 阳性血清、DV Ⅱ阳性血清、DV Ⅲ阳性血清、基孔肯雅病毒阳性血清、黄热病毒阳性血清、乙型脑炎病毒阳性血清、寨卡病毒阳性血清扩增曲线
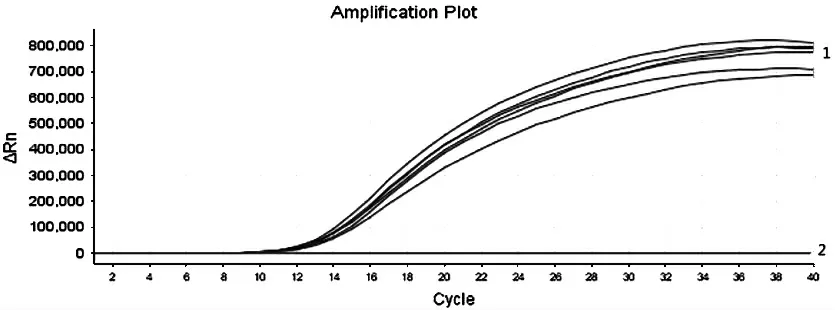
图8 DV Ⅳ特异性试验结果
2.4 重复性检测试验
如图5~图8 显示, 用建立的方法重复检测6次,荧光值相同,且扩增曲线走势差异较小,说明具有很好的重复性。
3 讨论
登革病毒的四种血清型在中国内陆均引起过登革热的暴发流行[4-8]。DV Ⅲ是早期(1978 年)报道的主要流行血清型病毒,随后则报道了DVⅠ和DVⅣ。郑夔等对在广东省四次暴发的登革热(1991 年、1995 年、1997 年和1999 年)中分离得到的DVⅠ病毒株序列进行了遗传分析,证实广东省的DVⅠ来源于菲律宾、 印尼和泰国等东南亚国家和西太平洋国家; 方美玉等对比分析了广东省1993 年和1998 年登革热暴发DVⅡ病毒株和1985 年海南省DVⅡ分离株NS1 序列, 表明它们来自于不同的传染源;姚海军等对1990 年和1978 年引起广东省登革热的DVⅣ毒株基因序列进行了分子溯源。 研究表明,基因组核苷酸序列分型和血清学分型法完全吻合[9]。
实时荧光RAA 技术是在普通RAA 的基础上,利用荧光染料在激发光作用下所释放荧光光能的变化来动态反映RAA 扩增产物量的新技术[10]。 本研究根据RAA 引物和探针设计原则, 分别设计了DVI~Ⅳ的引物和探针, 建立了实时荧光RT-RAA登革病毒血清型鉴定方法, 在39℃下等温反应20min,即可实现对靶基因的有效扩增,检测的灵敏度可达102copies/μl,试验的重复性好,又缩短了反应时间提高了工作效率。 此方法不但可以在实验室应用,还可以现场操作,有利于口岸登革病毒的准确、快速分型鉴定,该方法的建立为口岸登革热的筛查及溯源提供了技术保障。