长链非编码RNA HOTAIR靶向miR-138对脓毒症诱导的大鼠心肌炎症反应和氧化应激的影响及作用机制研究①
2020-02-20范腾阳高冬梅喻荣华
范腾阳 高冬梅 喻荣华 柯 迪 肖 雪
(遵义医学院附属医院全科医学科,遵义 563000)
脓毒症(Sepsis)是临床常见的严重并发症之一,是一种由微生物感染引起的全身性炎症反应(systemic inflammatory response syndrome,SIRS),包括呼吸急促、心跳过速、发热、白细胞数量异常等一系列症状,可导致脓毒性休克、多脏器功能障碍综合征[1]。脓毒性休克时,半数的患者伴随着脓毒性的心肌炎症[2]。炎症细胞因子在其中起着重要作用,其中肿瘤坏死因子α(tumor necrosis factor α,TNF-α)会抑制心肌的收缩功能,导致心脏功能紊乱[3]。
研究发现长链非编码RNA(long noncoding RNA,lncRNA)在许多疾病中扮演着重要角色,其中同源盒基因转录反义RNA(HOX transcript antisense RNA,HOTAIR)是由HOXC基因座转录得到的lncRNA,最早报道了该lncRNA的作用是调控HOXD基因的表达[4],后续研究发现,HOTAIR还参与到如癌症、心脏类疾病、类风湿性关节炎等不同的人类疾病中。HOTAIR可以通过激活NF-κB信号通路促进 TNF-α合成,在脂多糖(lipopolysaccharides,LPS)诱导的脓毒症引发心肌炎症中具有重要的作用[5]。研究表明,HOTAIR能够沉默体内多种microRNA(miRNA)[6],其中包括miR-138。而miRNA可以与目标mRNA 3′UTR区域结合引起转录本沉默[7],HOTAIR通过这种方式保护miR-138调控的蛋白表达。已有报道HOTAIR在肾细胞癌和LPS诱导的类风湿性关节炎中与miR-138相互作用的调控机制[6,8],并且已有报道HOTAIR、miR-138对心脏相关疾病的不同调控作用[5,9],HOTAIR与miR-138是否在脓毒症诱导的心肌炎症中存在相互作用及作用机制还未见报道,本研究通过构建大鼠脓毒症模型及培养大鼠H9c2心肌细胞,从体内体外两方面探究了HOTAIR与miR-138的相互作用及作用机制。
1 材料与方法
1.1材料 Lipofectamin2000转染试剂、siRNA阴性对照、si-HOTAIR、miR-138 inhibitor、miR-138 mimic购自上海吉玛公司。DMEM细胞培养液、牛胎血清(FBS)购自美国Hyclone公司。LPS购自美国sigma公司。Trizol试剂、MTT试剂盒、RIPA裂解液、ECL显色液、BCA试剂盒、Hoechst染色试剂盒购自北京索莱宝生物公司。反转录试剂盒和SsoFastTMEva-Green®Supermix试剂盒购自美国Bio-rad公司。HE染色试剂盒、心肌钙蛋白Ⅰ(cardiac troponinⅠ,cTnⅠ)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-1β、IL-6,心肌丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide Dismutase,SOD)检测试剂盒购自南京建成生物工程研究所。IκB激酶(ⅠkappaB kinase,IKK)、磷酸化核因子kappaB激酶抑制因子α(inhibitor of nuclear factor kappa-B kinase,p-IκBα)、核因子kappaB p65(nuclear factor-kappaB p65,NF-κB p65)和β-actin抗体购自英国Abcam生物公司。双荧光素酶报告检测系统购自美国Promega公司。试验所用到的引物采用Primer3 Input网站设计,由上海生工生物公司合成。
1.2方法
1.2.1动物模型制备及心脏功能检测 32只(体质量250~300 g)健康雄性SD大鼠购自上海杰思捷试验动物有限公司,于恒温恒湿、明暗交替(12 h)的环境中喂养48 h。32只大鼠随机分为Control组、CLP组、siRNA+CLP组、si-HOTAIR+CLP组,每组8只,采用盲肠结扎穿孔术(cecal ligation puncture,CLP)制备大鼠脓毒症模型。大鼠在乙醚吸入麻醉下无菌开腹手术,Control组开腹找出盲肠后再将其还纳腹腔并逐层关腹。除Control组外,其余各组在麻醉状态下开腹,在距离盲肠末端1 cm处用4~0丝线结扎盲肠,用18G针头在结扎处穿过3次并防止粪便污染,之后用生理盐水润湿肠管,还纳腹腔并逐层关腹,术后各组大鼠均使用生理盐水2 ml注射,12 h后再重复1次。在动物模型制备完毕后,采用10 μg/μl的siRNA阴性对照和si-HOTAIR,按照Lipofectamin2000转染试剂的操作说明制备siRNA/Lipofectamin复合物,分别对siRNA+CLP组和si-HOTAIR+CLP组大鼠进行左心室注射。在处理完成48 h后,使用小动物超声影像系统PanoView b1500检测大鼠心肌左心室收缩压(LVSP)和左心室舒张末期压(LVEDP)。处死大鼠,血清4℃ 3 000 g 离心10 min,收集血清并保存在-80℃冰箱中。收集心肌组织烘干后(80℃, 48 h),贮存于-80℃冰箱以备后续使用。
1.2.2大鼠心肌细胞脓毒症心肌损伤体外模型制备 大鼠心肌细胞株H9c2购自美国ATCC公司,使用含1.5 g/L NaHCO3、10%FBS、1%谷氨酰胺、1%青链霉素的DMEM细胞培养液培养于含有5% CO2的37℃恒温培养箱中,隔天换液1次,2~3 d根据细胞生长状态换液1次。将细胞分为Control组、LPS组、siRNA+LPS组、si-HOTAIR+LPS组,除Control组外,其余各组均使用LPS处理24 h,按照Lipofectamin2000转染试剂的操作说明分别制备siRNA阴性对照和si-HOTAIR的siRNA/Lipofectamin复合物,分别对siRNA+LPS组和si-HOTAIR+LPS组进行转染48 h后,1 000 r/min 离心5 min收集细胞,保存于-80℃冰箱中以备后续试验使用。
1.2.3RT-PCR检测mRNA表达水平 根据1.2.1、1.2.2描述的试验方法进行分组处理后(组织样品需要进一步通过液氮捣碎处理),用Trizol提取各组细胞RNA,根据反转录试剂盒合成cDNA,随后采用PCR仪进行PCR反应,循环条件为:预变性95℃ 10 min,变性95℃ 15 s,退火63℃ 1 min 40个循环。根据SsoFastTMEva-Green®Supermix试剂盒检测检测各组mRNA水平,结果采用2-ΔΔCt法进行计算。
1.2.4HE检测心肌组织病理变化 根据1.2.1描述的试验方法进行分组处理后,将心肌置于10%甲醛溶液中固定,石蜡包埋后切片,HE染色,显微镜下观察病理变化。
1.2.5si-HOTAIR、miR-138 inhibitor共转染细胞及MTT检测 将细胞分为Control组、LPS组、si-HOTAIR+LPS组、si-HOTAIR+LPS+inhibitor组,除si-HOTAIR+LPS+inhibitor组外,其余各组按1.2.2所描述的方法对细胞进行处理。si-HOTAIR+LPS+inhibitor组按照Lipofectamin2000转染试剂的操作说明共转染si-HOTAIR和miR-138 inhibitor。转染24 h后,各组取出部分细胞接种于96孔板中,每孔加入100 μl MTT溶液(5 mg/ml),混匀后于培养箱中继续培养4 h。4 h后每孔加入150 μl的二甲基亚砜,于摇床上低俗振荡10 min后,酶联免疫检测仪490 nm检测细胞吸光度。剩余细胞在转染48 h后,1 000 r/min 离心5 min收集细胞,保存于-80℃冰箱中以备后续试验使用。
1.2.6Hoechst染色检测细胞凋亡 按照1.2.5描述的方法将细胞进行分组处理,将细胞接种于6孔板中。用4%多聚甲醛于室温固定细胞30 min,用0.5%的TrintonX-100进行透膜处理,随后滴加Hoechst荧光染料对细胞进行染色,室温放置30 min。最后荧光显微镜观察细胞凋亡情况。以细胞核固缩,细胞核呈致密浓染或碎片状致密浓染视为细胞凋亡(细胞凋亡率=凋亡细胞/细胞总数×100%)。
1.2.7cTnⅠ、CK-MB检测 根据1.2.1描述的试验方法进行分组处理后,取心肌组织200 mg,4℃生理盐水清洗后研磨制成10%心肌组织匀浆,cTnⅠ、CK-MB检测通过酶联免疫吸附剂测定(ELISA)试剂盒完成。
1.2.8TNF-α、IL-1β、IL-6检测 根据1.2.1描述的试验方法进行分组处理后,按上所述的方法制备检测样品,按照试剂盒操作说明检测TNF-α、IL-1β、IL-6。
1.2.9MDA和SOD的检测 根据1.2.1、1.2.5描述的试验方法进行分组处理后,按1.2.1的方法制备检测样品,按照试剂盒操作说明检测MDA和 SOD。
1.2.10Western blot检测 按照1.2.1、1.2.5描述的方法对细胞或组织分组处理后(组织样品需要进一步通过液氮捣碎处理),用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒对各组细胞总蛋白浓度进行检测,调整各组蛋白浓度一致。每组取30 μg蛋白用10% SDS-PAGE分离,将分离后的蛋白采用半干转膜法转移到PVDF膜上,用5%的脱脂牛奶室温封闭2 h后,加入适宜浓度一抗,4℃孵育过夜。第2天用磷酸盐缓冲液(phosphate Buffer solution,PBS)清洗3次后,加入二抗室温孵育2 h后,滴加ECL显色液曝光显影。以β-actin为内参。
1.2.11荧光素酶报告试验检测 用生物信息学方法分析并预测了miR-138可能的结合位点位于LncRNA HOTAIR 2 142~2 163 bp区域。分别构建HOTAIR Lenti-reporter-Luciferase野生型载体和其突变型载体。将细胞分为HOTAIR wt、HOTAIR mut、HOTAIR wt+miR-138 mimic、HOTAIR mut+miR-138 mimic四组。加样到24孔板中,放置1 d。将上述野生型载体(200 ng)和pRL-CMV载体(20 ng)转染到HOTAIR wt、HOTAIR wt+miR-138 mimic组中,突变型载体(200 ng)和Prl-CMV载体(20 ng)分别转染到HOTAIR mut、HOTAIR mut+miR-138 mimic组中。同时,HOTAIR wt+miR-138 mimic和HOTAIR mut+miR-138 mimic组中转染miR-138 mimic。在转染48 h后,使用荧光素酶报告检测系统检测荧光素酶活性。

2 结果
2.1LncRNA HOTAIR在体内抑制miR-138的表达 如图1A所示,与Control组比较,CLP组HOTAIR表达水平显著升高(P<0.001),miR-138表达水平显著降低(P<0.001),差异有统计学意义。使用si-HOTAIR对HOTAIR进行沉默,如图1B所示,与Control组比较,CLP组HOTAIR表达水平显著升高(P<0.001),miR-138表达水平显著降低(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组HOTAIR表达水平显著降低(P<0.001),miR-138表达水平显著升高(P<0.001),差异有统计学意义。
2.2沉默 HOTAIR减轻CLP大鼠心肌组织的病理变化 如图2所示,Control组心肌纤维排列规则,细胞无变性坏死,CLP组心肌纤维结构改变,出现细胞皱缩,核固缩,细胞间隙变宽。si-HOTAIR+CLP组心肌组织无明显病理变化。
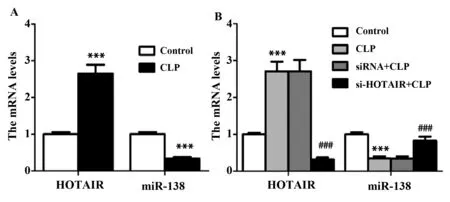
图1 HOTAIR及miR-138在大鼠体内的表达Fig.1 Expression of HOTAIR and miR-138 in ratsNote:n=8,***.P<0.001 versus Control group;###.P<0.001 versus CLP group.
2.3沉默 HOTAIR保护CLP大鼠心脏功能 如图3A、B所示,与Control组比较,CLP组LVSP显著降低(P<0.01),LVEDP显著升高(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组LVSP显著升高(P<0.01),LVEDP显著降低(P<0.001),差异有统计学意义。如图3C、图3D所示,与Control组比较,CLP组cTnⅠ表达水平、CK-MB活性显著升高(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组cTnⅠ表达水平、CK-MB活性显著降低(P<0.001,P<0.01),差异有统计学意义。
2.4沉默HOTAIR减轻心肌组织炎症 如图4所示,与Control组比较,CLP组TNF-α、IL-1β、IL-6浓度显著升高(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组TNF-α、IL-1β、IL-6浓度显著降低(P<0.001),差异有统计学意义。
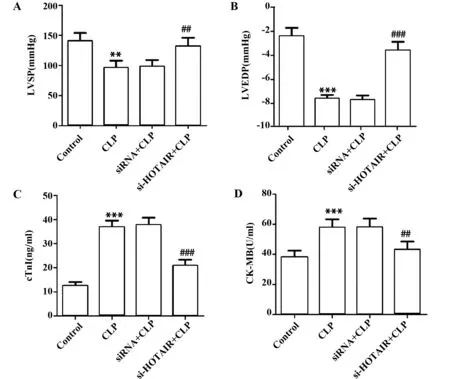
图3 沉默HOTAIR对大鼠心功能和心肌损伤的影响Fig.3 Effect of si-HOTAIR on cardiac function and myocardial injury in ratsNote:n=8,**.P<0.01,***.P<0.001 versus Control group;##.P<0.01,###.P<0.001 versus CLP group.
2.5沉默HOTAIR对降低大鼠血清的氧化应激 如图5A、B所示,与Control组比较,CLP组SOD活性显著降低(P<0.001),MDA浓度显著升高(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组SOD活性显著升高(P<0.001),MDA浓度显著降低(P<0.001),差异有统计学意义。
2.6沉默HOTAIR抑制大鼠心肌组织NF-κB的激活 如图6所示,与Control组比较,CLP组IKK、p-IκBα、NF-κB p65表达水平显著上升(P<0.001),差异有统计学意义;与CLP组比较,si-HOTAIR+CLP组IKK、p-IκBα、NF-κB p65表达水平显著降低(P<0.001),差异有统计学意义。
2.7HOTAIR在大鼠心肌细胞中抑制miR-138的表达 如图7A所示,与Control组比较,LPS组HOTAIR表达水平显著升高(P<0.001),miR-138表达水平显著降低(P<0.001),差异有统计学意义。
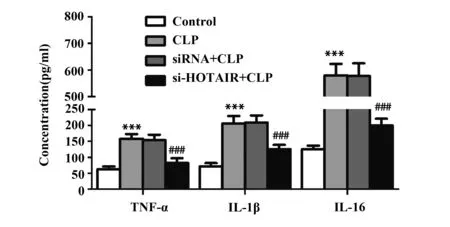
图4 沉默 HOTAIR对大鼠TNF-α、IL-1β、IL-6浓度影响Fig.4 Effect of si-HOTAIR on concentration of TNF-α,IL-1β,IL-6 in ratsNote:n=8,***.P<0.001 versus Control group;###.P<0.001 versus CLP group.

图5 沉默HOTAIR对大鼠血清氧化应激的影响Fig.5 Effect of si-HOTAIR on serum oxidative stress in ratsNote:n=8,***.P<0.001 versus Control group;###.P<0.001 versus CLP group.
使用si-HOTAIR对HOTAIR进行沉默,如图7B所示,与Control组比较,LPS组HOTAIR表达水平显著升高(P<0.001),miR-138表达水平显著降低(P<0.001),差异有统计学意义;与LPS组比较,si-HOTAIR+LPS组HOTAIR表达水平显著降低(P<0.001),miR-138表达水平显著升高(P<0.001),差异有统计学意义。
2.8miR-138靶向作用于HOTAIR 如图8所示,与HOTAIR wt组比较,HOTAIR wt+miR-138 mimic组的荧光素酶活性显著降低(P<0.001),差异有统计学意义;HOTAIR mut组、HOTAIR mut+miR-138 mimic组荧光素酶活性不存在显著差异。验证了miR-138靶向作用于HOTAIR。
2.9沉默HOTAIR抑制脓毒症诱导的心肌细胞凋亡 如图9B、C所示,与Control组比较,LPS组细胞活力显著降低,细胞凋亡率显著升高(P<0.01,P<0.001),差异有统计学意义;与LPS组比较,si-HOTAIR+LPS组细胞活力显著升高,细胞凋亡率显著降低(P<0.01,P<0.001),差异有统计学意义;与si-HOTAIR+LPS组比较,si-HOTAIR+LPS+inhibitor组细胞活力显著降低,细胞凋亡率显著升高(P<0.01),差异有统计学意义。
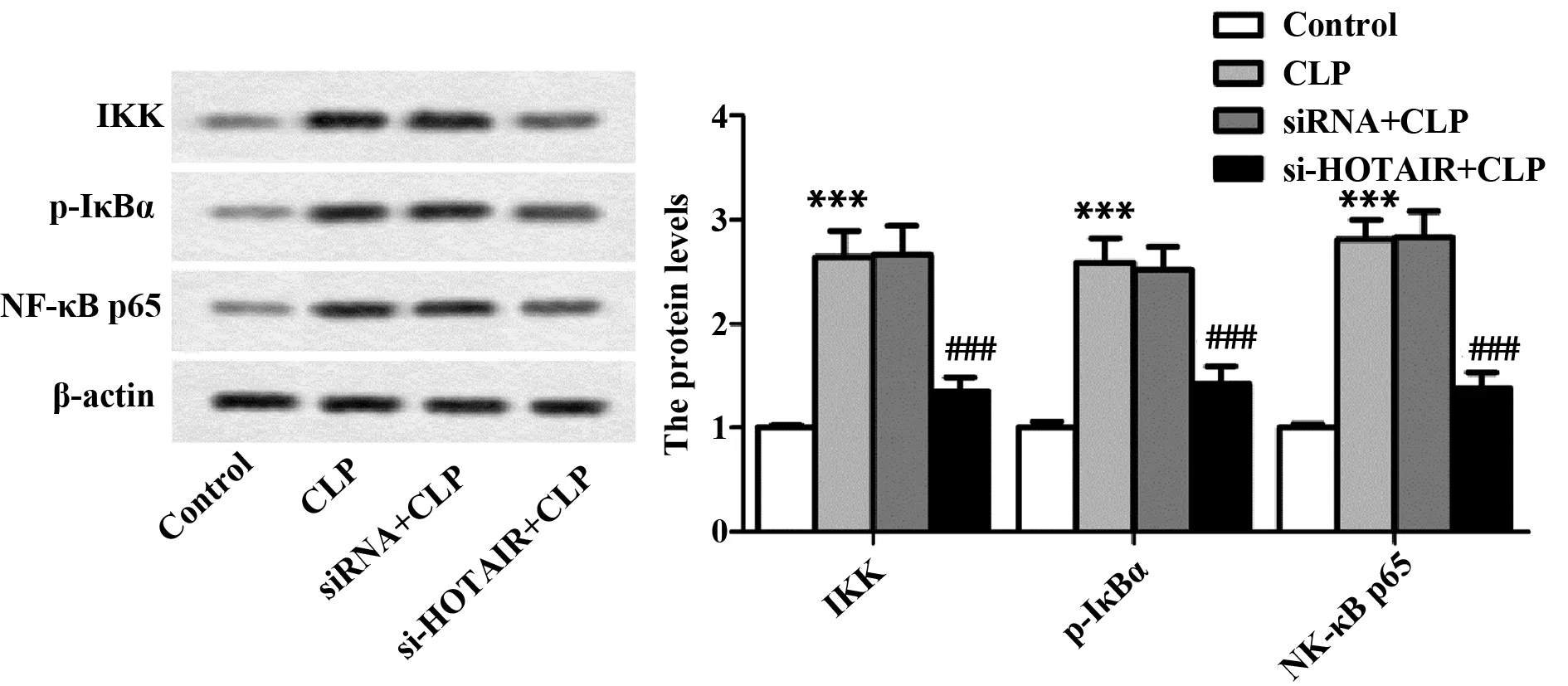
图6 沉默HOTAIR对大鼠心肌组织IKK、p-IκBα、NF-κB p65表达影响Fig.6 Effect of si-HOTAIR on expressions of IKK,p-IκBα,NF-κB p65 in rats myocardial tissueNote:n=8,***.P<0.001 versus Control group;###.P<0.001 versus CLP group.

图7 HOTAIR及miR-138在H9c2细胞内的表达Fig.7 Expression of HOTAIR and miR-138 in H9c2 cellsNote:n=6,***.P<0.001 versus Control group;###.P<0.001 versus LPS group.

图8 荧光素酶报告试验检测miR-138和HOTAIR的靶向关系Fig.8 Luciferase reporter assay was performed for measuring targeting relationship between miR-138 and HOTAIRNote:n=3,***.P<0.001 versus HOTAIR wt group.
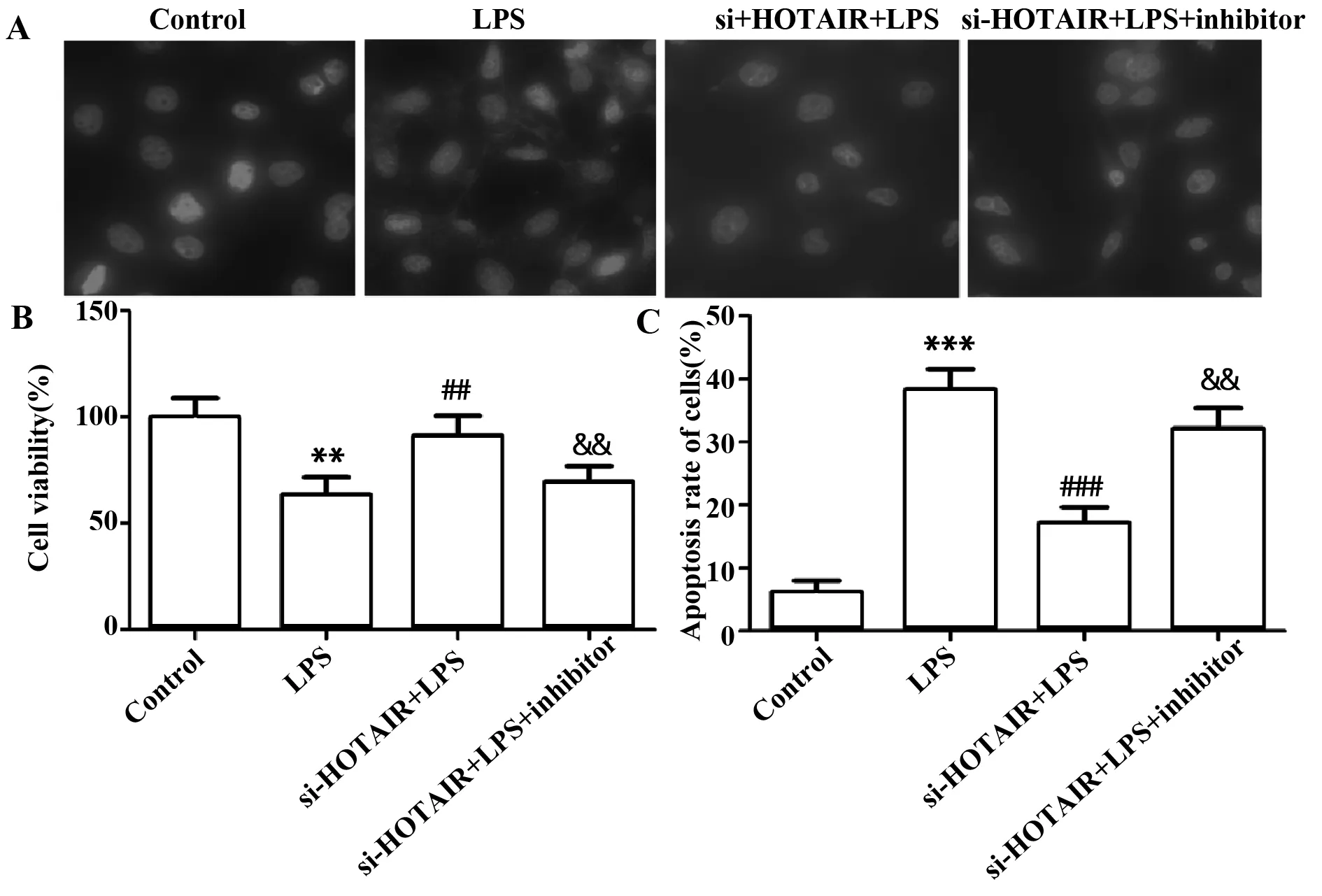
图9 沉默HOTAIR对H9c2细胞活性及细胞凋亡的影响Fig.9 Effect of si-HOTAIR on viability and apoptosis of H9c2Note:n=6,**.P<0.01,***.P<0.001 versus Control group;##.P<0.01,###.P<0.001 versus LPS group;&&.P<0.01 versus si-HOTAIR+LPS group.
2.10沉默 HOTAIR抑制大鼠心肌细胞的氧化应激 如图10A、B所示,与Control组比较,LPS组SOD活性显著降低,MDA浓度显著升高(P<0.001),差异有统计学意义;与LPS组比较,si-HOTAIR+LPS组SOD活性显著升高,MDA浓度显著降低(P<0.001),差异有统计学意义;与si-HOTAIR+LPS组比较,si-HOTAIR+LPS+inhibitor组SOD活性显著降低,MDA浓度显著升高(P<0.01),差异有统计学意义。

图10 沉默HOTAIR对H9c2细胞氧化应激的影响Fig.10 Effect of si-HOTAIR on oxidative stress of H9c2Note:n=6,***.P<0.001 versus Control group;###.P<0.001 versus LPS group;&&.P<0.01 versus si-HOTAIR+LPS group.

图11 沉默HOTAIR对H9c2细胞中IKK、p-IκBα、NF-κB p65表达影响Fig.11 Effect of si-HOTAIR on expression of IKK,p-IκBα,NF-κB p65 of H9c2Note:n=6,***.P<0.001 versus Control group;##.P<0.01 versus LPS group;&&.P<0.01 versus si-HOTAIR+LPS group.
2.11沉默HOTAIR抑制大鼠心肌细胞NF-κB通路的激活 如图11所示,与Control组比较,LPS组IKK、p-IκBα、NF-κB p65表达水平显著上升(P<0.001),差异有统计学意义;与LPS组比较,si-HOTAIR+LPS组IKK、p-IκBα、NF-κB p65表达水平显著降低(P<0.01),差异有统计学意义;与si-HOTAIR+LPS组比较,si-HOTAIR+LPS+inhibitor组IKK、p-IκBα、NF-κB p65表达水平显著升高(P<0.01),差异有统计学意义。
3 讨论
脓毒症是一种由感染引起的全身性炎症反应,会导致多器官衰竭,其中心脏是易损器官之一[1],目前的治疗方法仍停留在早期的抗菌药物治疗和支持疗法。非编码RNA的研究为治疗脓毒症引发的心肌炎症提供了新的思路[5,10]。之前的文献报道了HOTAIR可通过促进NF-κB p65亚基磷酸化,激活NF-κB信号途径,激活心肌炎症反应[5];miR-138可以通过MLK3/JNK/c-jun信号途径降低由缺氧引起的心肌细胞凋亡[9],并且有研究证实,HOTAIR和miR-138在体内可以通过相互作用影响肾细胞癌和LPS诱导的类风湿性关节炎[6,8]。本文首次探究了miR-138和HOTAIR在脓毒症引发的心肌炎症中的相互作用机制。本研究发现,HOTAIR在CLP模型大鼠体内的表达量显著升高,miR-138表达量显著降低,沉默HOTAIR表达后发现miR-138表达量显著升高,表明HOTAIR和miR-138在脓毒症大鼠心肌组织中确实存在相互作用关系。通过荧光素酶报告基因检测,发现HOTAIR可以直接作用于miR-138,证实了前人的研究。
心肌炎症会引起心肌组织一系列病理变化,对CLP大鼠心肌组织的HE染色观察发现,对HOTAIR的沉默,显著减轻了心肌组织的病理性变化。cTnⅠ和CK-MB是常用的心肌损伤标记物,心肌细胞损伤时会释放这些物质进入血液,导致血清cTnⅠ、CK-MB浓度与活性升高[11]。研究发现,对HOTAIR的沉默,显著减轻了心肌损伤,保护了心肌细胞功能。与之前的研究结果一致[5]。进一步对miR-138进行沉默后发现,对miR-138的沉默导致心肌细胞活力显著降低,凋亡率显著上升,表明miR-138对大鼠心肌细胞具有保护作用。
炎症细胞因子参与了脓毒症诱导的心肌损伤过程,研究表明,TNF-α和IL-1β共同启动炎症反应,对心肌有负性肌力作用,IL-6对心肌收缩性能的负调控作用则是通过蛋白激酶通路相互联系的[12-14]。本研究发现,对HOTAIR的沉默可以抑制CLP模型大鼠中炎症细胞因子TNF-α、IL-1β、IL-6的表达,表明HOTAIR参与了炎症细胞因子的表达过程。
氧化应激在脓毒症心肌损伤中发挥着关键作用[15],脓毒症会诱发线粒体过度产生活性氧,导致氧化/抗氧化失衡,活性氧破坏心肌细胞膜,导致脂质过氧化物MDA大量产生,SOD活性被消耗。本研究发现,通过沉默HOTAIR表达,SOD的活性恢复,MDA产量下降,表明HOTAIR参与了大鼠心肌的氧化应激。进一步对miR-138进行沉默发现,SOD的活性降低,MDA产量升高,表明miR-138对脓毒症大鼠心肌细胞中氧化应激具有抑制作用。
NF-κB信号途径在各类炎症反应中被广泛涉及。通常状态下,NF-κB家族蛋白以p50-p65的异二聚体形式存在,并与kappaB抑制蛋白(inhibitor kappaB,IκB)结合呈非活化状态,定位于细胞质当中[16,17]。当存在诱导物如TNF-α、IL-1、IL-6、LPS、紫外线等的条件下,IκB激酶被激活,磷酸化IκB,使其释放p50-p65,之后进一步多聚泛素化,最终被蛋白酶体降解。此时p50-p65暴露出核定位信号,转运入细胞核,作为转录因子与各种目标DNA序列结合。为了探究NF-κB信号通路是否在大鼠脓毒性心肌炎症中受HOTAIR和miR-138的调节,本研究从体内体外两方面对IKK、p-IκBα、NF-κB p65表达水平进行检测,发现HOTAIR沉默可以显著抑制IKK、p-IκBα、NF-κB p65的表达,表明HOTAIR参与了NF-κB的激活,促进炎症反应。体外进一步使用抑制剂对miR-138也进行沉默,发现IKK、p-IκBα、NF-κB p65表达量水平相比si-HOTAIR+LPS组显著升高,表明miR-138可以抑制NF-κB的激活,从而降低炎症反应。
综上所述,LncRNA HOTAIR参与了大鼠脓毒性心肌炎症的病理发展过程,参与了炎症细胞因子的表达及氧化应激的发生,对NF-κB有激活作用;miR-138可以提高细胞活力,抑制氧化应激,抑制NF-κB信号通路。HOTAIR可以在心肌组织中与miR-138发生相互作用,导致miR-138沉默。因此HOTAIR可以通过沉默miR-138达到对大鼠脓毒症心肌炎症和氧化应激的调控目的。结合之前已报道的文献,推测HOTAIR和miR-138在大鼠脓毒症心肌炎症中存在多种不同途径发挥调控作用。大鼠HOTAIR的沉默在脓毒症心肌炎症中保护了心肌细胞,为在脓毒症心肌炎症中维持心脏功能提供了新的治疗思路。后期将对HOTAIR与其他miRNA的作用和机制进一步研究。