荜茇酰胺逆转人小细胞肺癌H446/DDP细胞耐药性及机制的研究①
2020-02-20张华果牛朝霞杨红梅
肖 娟 张华果 陈 洁 牛朝霞 杨红梅
(河南医学高等专科学校,郑州 451191)
肺癌是对人类健康和生命威胁最大的恶性肿瘤之一,肺癌的发病率和死亡率一直位居恶性肿瘤谱第一位[1]。小细胞肺癌(small cell lung cancer,SCLC)约占肺癌发生率的20%,由于恶性程度高、侵袭性强、易转移、多数SCLC患者在确诊时已为晚期,失去了手术治疗的最佳时机,因此放疗和化疗成为主要的治疗手段。尽管大多数SCLC患者对初始化疗较敏感,但极易产生化疗耐药性,导致治疗失败[2]。因此,逆转化疗耐药性成为目前SCLC治疗中亟待解决的问题之一。荜茇酰胺(piperlongu-mine,PLM),又名荜茇明碱,是分离自荜茇的一种生物碱类化合物。近年研究表明,PLM对前列腺癌、结肠癌、肺腺癌、肝癌和黑色素瘤等恶性肿瘤具有显著的抑制作用[3-7]。Wang等[8]研究证实,PLM可逆转人视网膜母细胞瘤耐药株对长春新碱和卡铂的耐药性。但目前国内外尚未见PLM对SCLC顺铂(cisplatin,DDP)耐药性逆转作用的报道。本研究拟通过分子生物学方法探究PLM对人SCLC耐药株H446/DDP细胞的逆转作用及其分子机制。本研究有望为PLM治疗SCLC奠定基础。
1 材料与方法
1.1材料 人小细胞肺癌H446细胞购自中国科学院昆明细胞库;胎牛血清(fetal bovine serum,FBS)和RPMI1640培养基购自Hyclone公司;PLM和DDP购自美国Selleck公司;CCK-8试剂盒购自武汉博士德生物公司;AnnexinV-FITC凋亡检测试剂盒、RIPA裂解液和ECL化学发光试剂盒购自碧云天生物技术有限公司;兔抗人P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白1(multidrug resistance associated protein 1,MRP1)、谷胱甘肽S转移酶P1(glutathione S transferase P1,GSTP1)、Survivin、细胞周期蛋白A(cyclin A)、细胞周期依赖性蛋白激酶2(cyclin dependent kinase 1,CDK1)和β-actin单克隆抗体购自Abcam公司。
1.2方法
1.2.1细胞培养 A549细胞用含10%FBS的RPMI1640培养液培养,置于37℃、5%CO2的细胞培养箱内;每2 d换液1次,待细胞覆盖率达到80%时进行传代。
1.2.2建立耐药株H446/DDP细胞 取对数生长期的H446细胞,加入含0.1 mg/L DDP的培养液,培养48 h后,更换为不含DDP的培养液继续培养,待细胞恢复生长后重复上述处理,若细胞能在该浓度下稳定生长,则逐步提高DDP浓度,每次提高约50%,直至细胞可在含有1 mg/L DDP的培养液中稳定生长,将此耐药细胞株命名为H446/DDP。
1.2.3细胞活力检测与药物联合效用评价 将H446细胞和H446/DDP细胞以每孔5 000个接种于96孔板,常规培养24 h,分别加入不同剂量PLM和DDP,同时设空白组和对照组,每组设5个复孔,孵育24 h;每孔加入10 μl CCK-8溶液,孵育1 h,用酶标仪于450 nm波长处检测各孔吸光度A值;计算细胞活力(cell viability),细胞活力=(加药组A值-调零组A值)/(对照组A值-调零组A值)×100%;使用SPSS16.0软件计算药物的半数抑制浓度(half maximal inhibitory concentration,IC50),并计算出耐药倍数与逆转倍数,耐药倍数=耐药细胞IC50/敏感细胞IC50,逆转倍数=耐药细胞IC50/PLM作用下IC50;使用CompuSyn软件计算出在不同抑制效应(fraction affected,Fa)下的药物联合指数(combination index,CI),并绘制出Fa-CI曲线。
1.2.4细胞凋亡检测 取对数生长期H446/DDP细胞,将其分为对照组、DDP组、PLM组和DDP+PLM组,其中DDP和PLM的终浓度分别为6 mg/L和2 mg/L;药物处理24 h后,收集各组细胞,PBS洗涤2次,用结合缓冲液重悬细胞,调整细胞密度至5×105个/ml,取200 μl细胞悬液,加入5 μl AnnexinV-FITC和10 μl碘化丙啶(propidium iodide,PI)染色液,轻轻混匀,4℃避光孵育15 min,送流式细胞仪分析检测。
1.2.5细胞周期检测 细胞分组同1.2.4段,收集各组细胞,PBS洗涤2次,加入1 ml 冰预冷的75%乙醇,-20℃固定2 h,PBS洗涤2次,加入PI染色液,室温避光孵育15 min,使用流式细胞仪检测细胞周期。
1.2.6Western印迹法检测蛋白水平 用不同剂量 PLM(0、2、4 mg/L)处理H446/DDP细胞24 h后,收集各组细胞,加入RIPA裂解液,冰上孵育15 min,4℃下12 000 g离心30 min后取上清,用紫外分光光度法检测样品蛋白浓度,取25 μg蛋白样品进行SDS-PAGE电泳并转印到PVDF膜上,用5%脱脂奶粉封闭1 h,TBST洗膜2次,加入一抗(1∶1 000稀释),4℃孵育过夜,TBST洗膜3次,加入二抗(1∶2 000 稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行曝光反应,显影,拍照,使用ImageJ 1.45s软件分析目标蛋白的相对灰度值。

2 结果
2.1耐药前后相关蛋白表达水平的变化 如图1所示,与亲代H446细胞相比,耐药株H446/DDP细胞中P-gp、MRP1、GSTP1和Survivin蛋白的表达水平均显著升高(P<0.05)。这提示H446细胞顺铂耐药性的产生可能与P-gp、MRP1、GSTP1和Survivin蛋白的高表达有关。
2.2PLM与DDP对细胞活力的影响 如图2所示,与对照组相比,经不同剂量PLM和DDP处理24 h 后, H446和H446/DDP细胞活力均显著下降(P<0.05),且随药物剂量的增加呈下降趋势;DDP对H446和H446/DDP细胞的IC50分别为1.21 mg/L和13.76 mg/L,PLM对H446/DDP细胞的IC50为6.29 mg/L;当PLM与DDP按1∶3浓度比联用时,IC50为7.28 mg/L(其中DDP的浓度为5.46 mg/L);H446/DDP细胞的耐药倍数为11.37, PLM对H446/DDP细胞的逆转倍数为2.52。这表明PLM可增强DDP对H446/DDP细胞的抑制作用。

图1 H446和H446/DDP细胞中P-gp、MRP1、GSTP1和Survivin蛋白的表达Fig.1 Protein levels of P-gp,MRP1,GSTP1 and Survivin in H446 and H446/DDP cellsNote:A.Western blot analysis;B.Statistical analysis;*.P<0.05 versus H446 group.

图2 PLM与DDP对H446和H446/DDP细胞活力的影响Fig.2 Effect of PLM and DDP on cell viability in H446 and H446/DDP cellsNote:A.H446 cells;B.H446/DDP cells.*.P<0.05 versus control group;#.P<0.05 versus the same concentration DDP group.
2.3PLM与DDP联合效应分析 Chou-Talalay中效分析法结果显示,在不同抑制效应Fa值下,联合指数CI值均小于1,这说明PLM与DDP联用可产生协同效应,见图3。
2.4PLM与DDP对细胞凋亡的影响 如图4所示,与对照组相比,PLM组、DDP组和DDP+PLM组细胞凋亡率均显著升高(P<0.05);同时,DDP+PLM组细胞凋亡率显著高于DDP组(P<0.05)。这表明PLM可协同增强DDP诱导的H446/DDP细胞凋亡。
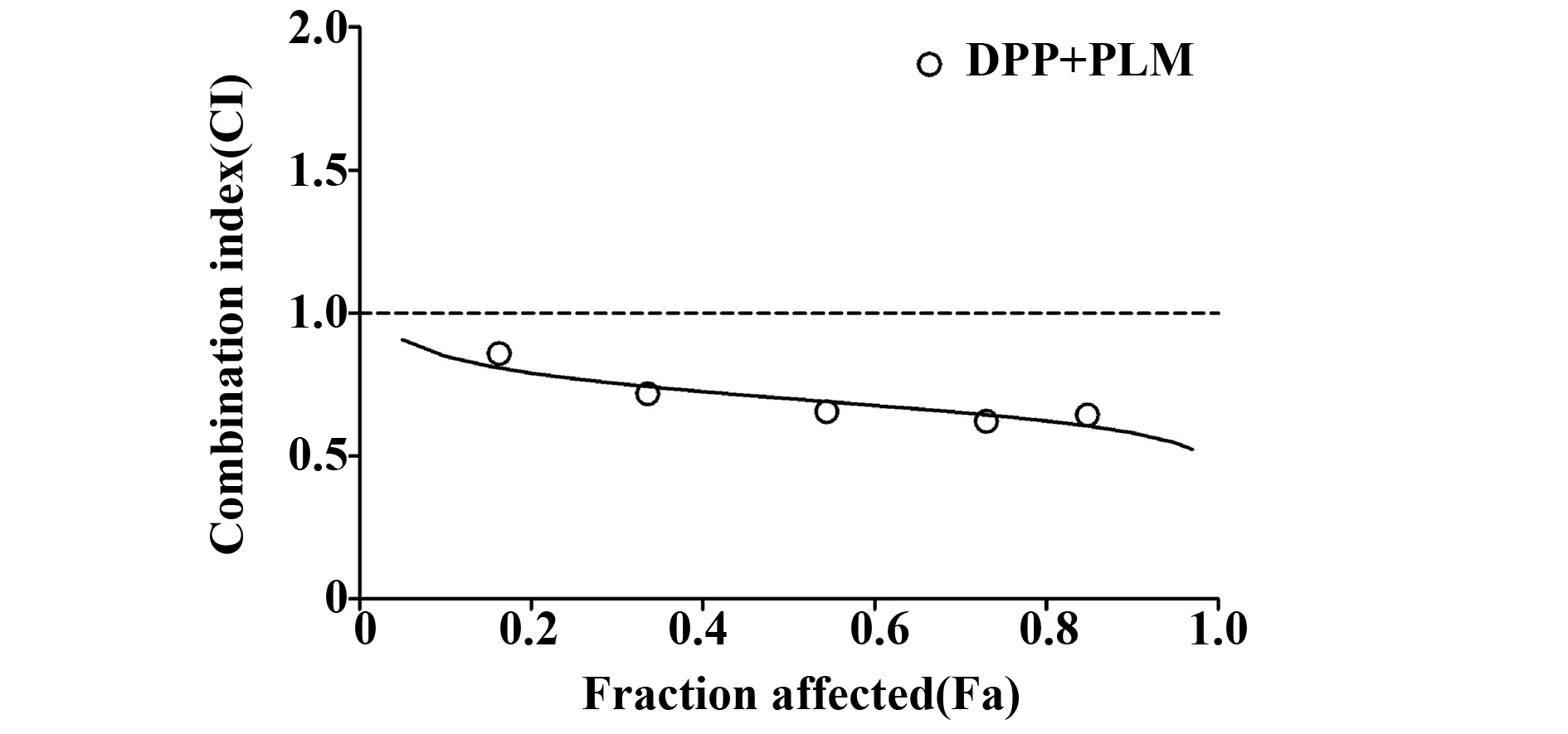
图3 抑制效应-联合指数曲线Fig.3 Graph of fraction affected(Fa)and combination index(CI)
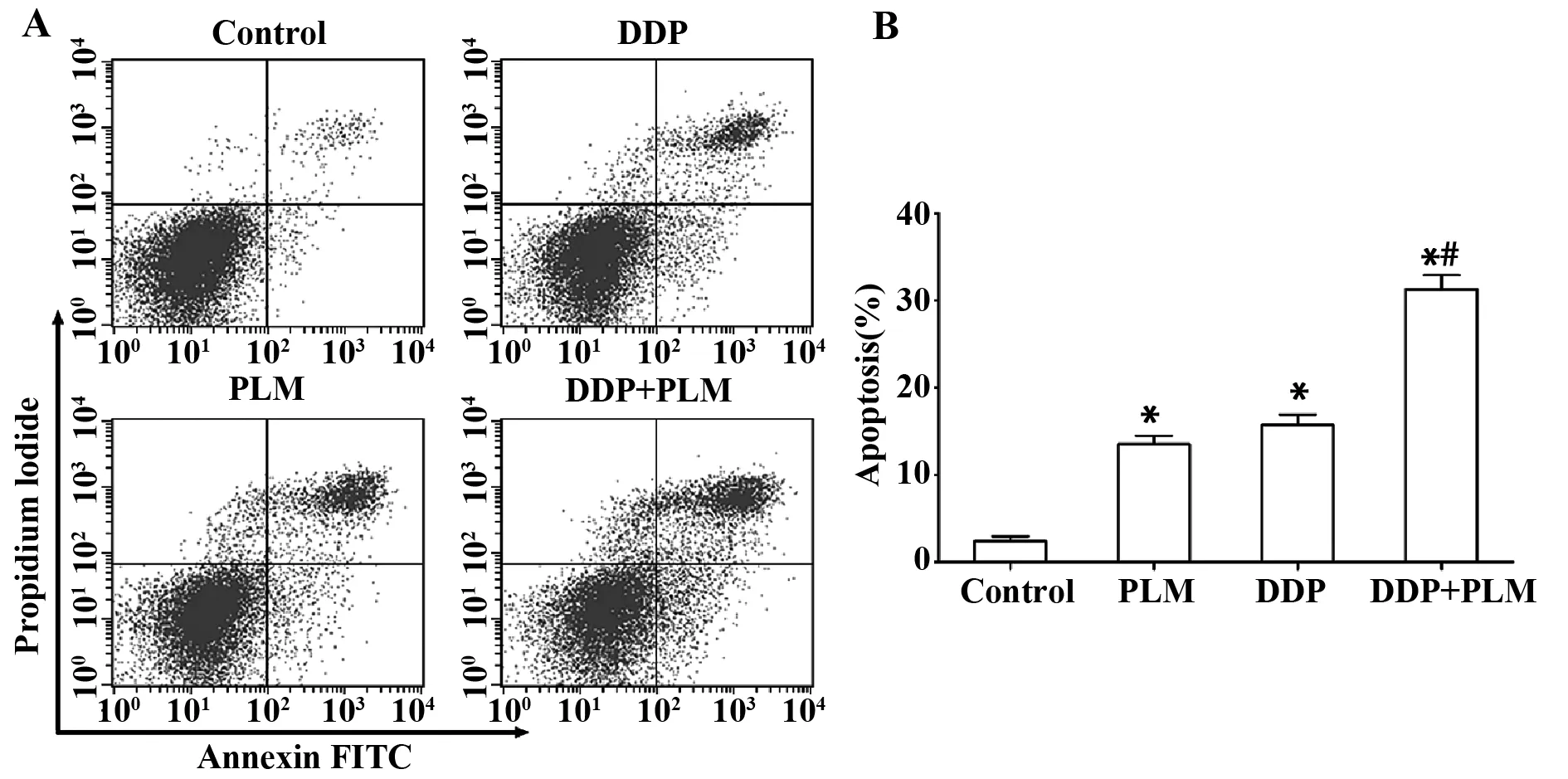
图4 PLM和DDP对H446/DDP细胞凋亡的影响Fig.4 Effect of PLM and DDP on apoptosis of H446/DDP cellsNote:A.Apoptosis detection;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus DDP group.
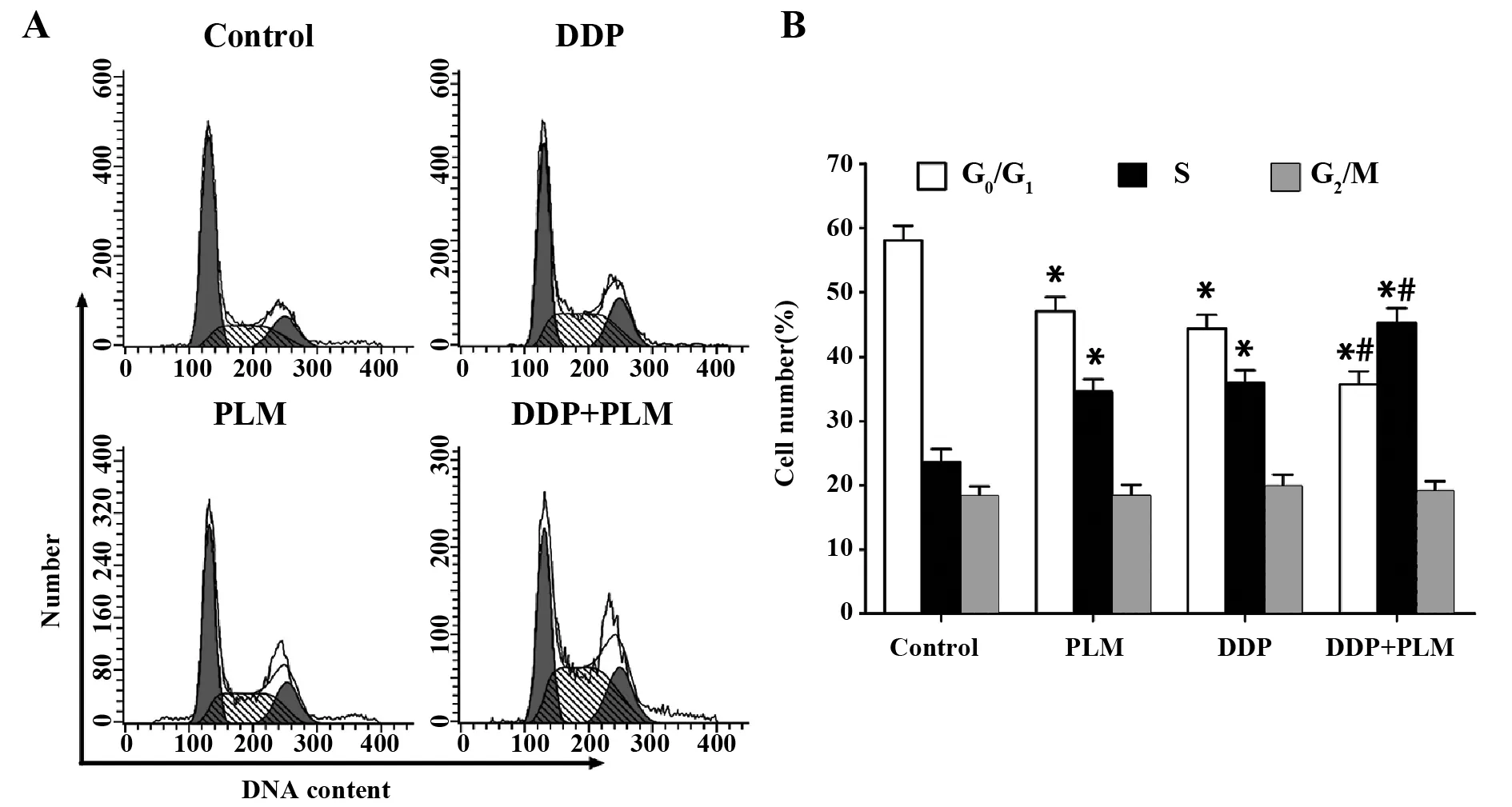
图5 PLM和DDP对H446/DDP细胞周期的影响Fig.5 Effect of PLM and DDP on cell cycle of H446/DDP cellsNote:A.Cell cycle detection;B.Statistica analys.*.P<0.05 versus control group;#.P<0.05 versus DDP group.
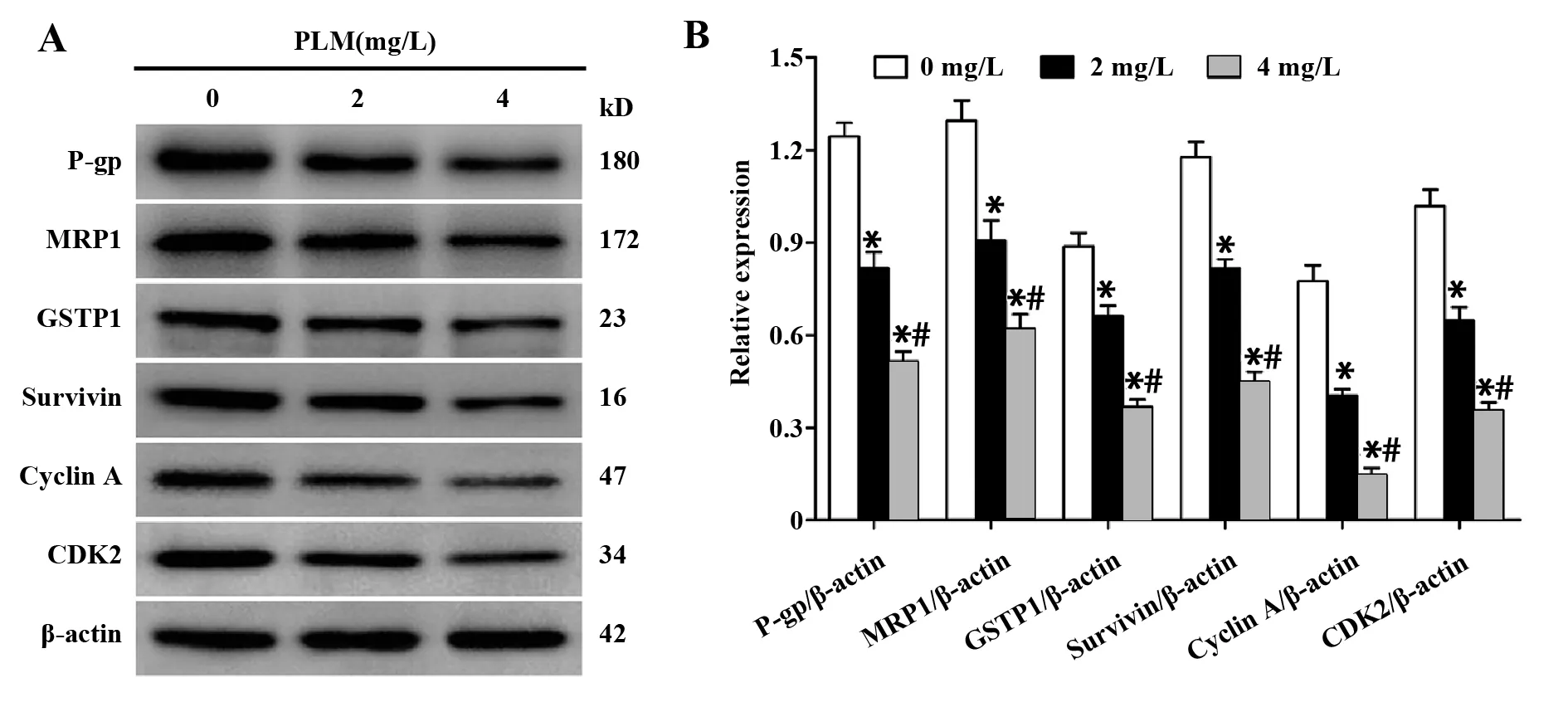
图6 PLM对H446/DDP细胞耐药相关蛋白表达的影响Fig.6 Effect of PLM on expression levels of resistance-related proteins in H446/DDP cellsNote:A.Western blot analysis;B.Statistica analysis.*.P<0.05 versus control group;#.P<0.05 versus 2 mg/L group.
2.5PLM与DDP对细胞周期的影响 如图5所示,与对照组相比,PLM组、DDP组和DDP+PLM组细胞G0/G1期细胞比例显著降低(P<0.05),S期细胞比例显著升高(P<0.05);与DDP组相比,DDP+PLM组G0/G1期细胞比例明显降低(P<0.05),S期细胞比例显著升高(P<0.05)。这表明DDP和PLM可诱导H446/DDP细胞发生S期阻滞,且二者联用效应更强。
2.6PLM对相关蛋白表达水平的影响 如图6所示,与对照组相比,经2 mg/L或4 mg/L PLM处理24 h后, H446/DDP细胞中P-gp、MRP1、GSTP1、Survivin、Cyclin A和CDK2蛋白表达水平均显著下降(P<0.05),且随PLM剂量的增加呈下降趋势。
3 讨论
化疗是治疗中晚期恶性肿瘤患者的重要手段之一,然而耐药性的产生严重制约了化疗的效果,甚至导致化疗失败。肺癌化疗耐药性的形成是一个多因素参与的复杂过程,涉及细胞内化疗药物的代谢与积累,以及抗凋亡能力等方面。下调P-gp和MRP1蛋白表达可抑制肺癌细胞对DDP的外排作用,从而逆转肺癌细胞对DDP的耐药性[9,10]。而上调GSTP1和Survivin蛋白表达可减弱DDP对肺癌细胞的杀伤作用[11,12]。本研究结果显示,耐药株H446/DDP细胞对DDP的耐药倍数为11.37,其P-gp、MRP1、GSTP1和Survivin蛋白表达水平也均显著高于亲代H446细胞。这表明上述蛋白可能在H446细胞获得DDP耐药性的过程中发挥着重要作用。
PLM是一种提取自胡椒科植物荜茇的生物碱类化合物,具有抗血小板凝集、抗阿尔兹海默病、抗血小板聚集、抗炎、抗抑郁和镇痛等药理学作用[13-16]。近年来PLM的抗肿瘤作用逐渐成为研究的热点。PLM可通过引发氧化应激诱导黑色素瘤细胞凋亡[3],也可通过抑制PI3K/Akt/mTOR信号通路抑制结肠癌细胞增殖[4],还可通过下调P-gp、MRP1和ABCG2蛋白表达逆转人视网膜母细胞瘤耐药株HXO-RB44/VCR和SO-Rb50/CBP细胞耐药性[8]。本研究结果表明,PLM可协同增强DDP对H446/DDP细胞的杀伤作用,逆转倍数为2.52。
肿瘤细胞可通过ATP 结合盒(ATP-binding cassette,ABC)转运蛋白将化疗药物外排至细胞外,使肿瘤细胞内化疗药物含量降低,最终导致多药耐药性。P-gp和MDR1为ABC转运蛋白家族的重要成员。Fang等[10]研究显示,抑制STAT3活化可下调肺癌耐药株A549/DDP细胞中MDR1和MRP1基因表达,进而逆转其耐药性。吴秋歌等[17]研究证实,抑制P-gp表达可提高H446细胞对DDP的敏感性。Zhao等[18]研究显示,SCLC耐药株H69/DDP细胞中MDR1蛋白表达显著升高。本研究结果表明,PLM可剂量依赖性地下调H446/DDP细胞中P-gp和MRP1的蛋白表达水平,这可能是PLM逆转H446/DDP细胞耐药性的机制之一。
GSTP1可催化谷胱甘肽与DDP的结合反应,使后者无法进入细胞核与靶点DNA结合,从而降低肿瘤细胞对DDP的敏感性[19]。Survivin为目前发现的作用最强的凋亡抑制因子,在肺癌细胞DDP耐药性的形成过程中发挥着重要作用[11]。Wu等[20]研究显示,下调GSTP1蛋白表达可增强H446/DDP对DDP的敏感性。Tang等[11]研究证实,H446/DDP细胞中Survivin蛋白呈高表达,抑制PI3K/Akt1通路可下调Survivin蛋白,继而逆转其DDP耐药性。本研究表明,PLM可剂量依赖性地下调H446/DDP细胞中GSTP1和Survivin的蛋白表达水平。
Song等[3]研究证实,PLM可上调人黑色素瘤A375和A875细胞中p21和p27蛋白表达,导致其发生G2/M期阻滞。Wang等[8]研究显示,PLM可通过下调CDK1蛋白表达阻滞人视网膜母细胞瘤细胞于G0/G1期和G2/M期。而下调Cyclin A和CDK2表达会使肿瘤细胞阻滞于S期,从而引起肿瘤细胞凋亡[21,22]。本研究证实,PLM可剂量依赖性地下调Cyclin A和CDK2蛋白表达,并与DDP协同阻滞H446/DDP细胞于S期。
综上所述,PLM可在体外逆转人小细胞肺癌耐药株H446/DDP细胞耐药性,这可能与其下调P-gp、MRP1、GSTP1、Survivin、Cyclin A和CDK2蛋白表达水平,进而增强DDP诱导的细胞凋亡和S期阻滞有关。