外周血辅助性T细胞22比例与肿瘤相关性的Meta分析①
2020-02-20胡佳丽王颖梅薛凤霞
胡佳丽 闫 晔 王颖梅 薛凤霞
(天津医科大学总医院,天津 300052)
机体抗肿瘤免疫反应中起重要作用的是细胞免疫,近年来辅助性T淋巴细胞在细胞免疫反应中的作用越来越为人们所重视。辅助性T细胞22(Th22细胞)是近几年新发现的一种不同于辅助性T细胞1、辅助性T细胞2、辅助性T细胞17和调节性T细胞的新型CD4+T淋巴细胞功能亚群[1]。该亚群的主要特点是能分泌IL-22和肿瘤坏死因子-α,但是不分泌IL-4、IL-17和干扰素-γ[2]。Th22细胞在肿瘤中发挥功能主要通过IL-22来实现,IL-22可以激活JAK/STAT细胞信号通路和MAPK细胞信号通路,从而调节机体的抗肿瘤免疫反应[3,4]。
目前国内外多项研究发现Th22细胞在许多肿瘤的发生中发挥促进肿瘤进展的作用,肿瘤患者外周血中的Th22细胞比例较健康人明显升高,并且处于肿瘤晚期的患者外周血Th22细胞比例更高[5-8]。但是也有少数研究指出Th22细胞比例在肿瘤患者外周血中相比健康人呈下降趋势[9]。这些研究表明关于Th22细胞在肿瘤免疫中的作用是促进还是抑制肿瘤的发生发展目前尚无定论。因此,本研究利用循证医学研究方法,通过系统评价近年国内外相关文献,分析Th22细胞与肿瘤发生发展的关系,为进一步研究肿瘤的发病机制及临床实践提供循证医学证据。
1 材料与方法
1.1材料
1.1.1纳入标准 ①研究类型:国内外已公开发表的关于外周血Th22细胞比例与肿瘤相关性的队列研究和病例对照研究;②研究对象:已经确诊为肿瘤,且为实体瘤的患者,国籍、种族、年龄不限;③暴露因素:外周血Th22细胞比例,通常是指外周血Th22细胞占CD4+T细胞的比例;④结局指标:外周血Th22细胞比例和肿瘤的相关性。
1.1.2排除标准 ①血液系统肿瘤等非实体瘤;②良性肿瘤或未明确诊断为恶性肿瘤;③重复报道或存在数据雷同等情况下,仅纳入实验设计更完善、样本量更大的研究;④研究除Th22细胞以外的其他免疫细胞或细胞因子;⑤相关指标不完整,且未报告可用于Meta分析的基本数据;⑥摘要、病例报告、评论、信件、细胞研究和动物研究;⑦病例数≤10例。
1.2方法
1.2.1文献检索策略 计算机检索PubMed、EMBASE、Web of Science、The Cochrane Library、SCOPUS、SpringerLink、Science Direct、CNKI、CBM、VIP 和 Wanfang数据库,搜集报道外周血Th22细胞比例与肿瘤相关性的研究,检索时间均为建库至2018年11月25日。同时手工检索纳入研究的参考文献,以补充获取相关文献。英文检索词包括:Th22 cell、T helper 22 cell、T helper type 22 cell、neoplasms、cancer、tumor、carcinoma、carcinogenesis等;中文检索词包括:Th22、Th22细胞、辅助性T细胞22、肿瘤、癌等。若数据库包含主题词检索功能,则进一步辅以主题词检索结果。以PubMed为例,其具体的检索方法见图1。
1.2.2文献筛选、资料提取与偏倚风险评价 由2名研究员使用EndNote软件独立筛选文献,通过阅读文题、摘要以及全文,以确定最终是否纳入,并提取资料以及交叉核对,同时采用纽卡斯尔-渥太华(the Newcastle-Ottawa scale,NOS)量表对纳入的研究进行偏倚风险评价。NOS量表包括3个方面,研究对象选择(4个条目)、组间可比性(1个条目)和暴露/结局评价(3个条目),采用星级系统的半量化原则,满分为9分[10]。具体评价细则可在NOS官方网站免费下载(http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp)。如对是否纳入某篇文献产生分歧,通过讨论解决,如若讨论后仍无法解决,则征求第3名研究员的意见。资料提取的主要内容包括:①纳入文献的基本特征:第一作者、出版年份;②纳入研究对象的基本特征:所患肿瘤种类、例数、年龄和外周血Th22细胞比例,以及健康对照的相应特征;③NOS评分。
1.3统计学分析 使用RevMan5.3软件进行Meta分析,采用加权均数差(weighted mean difference,WMD)及95%置信区间(95%confidence interval,95%CI)为效应指标。Meta分析的检验水准设为α=0.05。首先对纳入文献行异质性分析,采用卡方检验分析统计学异质性(检验水准为α=0.1),同时结合I2定量判断异质性的大小。若各研究结果间无统计学异质性(I2<50%,P>0.1),则采用固定效应模型进行Meta分析;其各研究结果间存在统计学异质性(I2≥50%,P≤0.1),则采用随机效应模型。同时,采用Stata12.0软件进行Meta回归和敏感性分析以期发现异质性的来源,通过漏斗图和Egger′s法来评估发表偏倚。如果漏斗图显示大部分研究处于“倒漏斗”的上部而基底部研究较少,且左右大致对称,则提示发表偏倚不明显,反之则提示存在明显的发表偏倚。而Egger′s法是在漏斗图基础上对发表偏倚进行客观检验的方法,P值<0.05提示存在发表偏倚。另外,本研究根据患者肿瘤种类和分期不同、Th22细胞圈定方法不同以及NOS评分不同分别进行亚组分析评估。
2 结果
2.1文献筛选流程及结果 初检获得文献1 246篇,通过EndNote软件剔除重复文献427篇,阅读剩余819篇文献的题目和摘要进行初筛,排除751篇明显不相关文献后,进一步阅读剩余的68篇文献的全文,排除不符合纳入标准的研究,最终纳入26个研究。文献筛选具体流程及结果见图2。

图1 PubMed检索策略Fig.1 Search strategy of PubMed
2.2纳入研究的基本特征及偏倚风险评价结果 纳入的26个研究均为病例对照研究,均采用流式细胞仪检测肿瘤患者术前以及健康对照的外周血中Th22细胞比例,包括8种实体瘤,其中7篇宫颈癌、6篇肝癌、4篇结直肠癌、3篇卵巢癌、2篇胰腺癌、2篇胃癌、1篇甲状腺癌和1篇脑胶质瘤。纳入研究的基本特征及偏倚风险评价结果见表1。
2.3Meta分析结果 共纳入26个研究,包括1 020例肿瘤患者和679例健康对照。采用随机效应模型的Meta分析结果显示,患者外周血的Th22细胞比例明显高于对照组[WMD=1.37,95%CI(1.07,1.68),P<0.000 01](图3)。当我们将肿瘤晚期患者和早期患者的外周血Th22细胞比例相互比较后发现,晚期患者外周血中Th22细胞比例比早期患者高[WMD=0.41,95%CI(0.17,0.66),P=0.000 9](图4)。
我们进一步根据肿瘤类型和分期、Th22细胞圈定方法以及纳入研究NOS评分进行亚组分析。结果显示,在不同肿瘤类型、不同分期、不同Th22细胞圈定方法以及不同NOS评分情况下,肿瘤患者外周血Th22细胞比例均较健康对照升高(P均<0.01),且各亚组异质性相比总体异质性也有一定程度下降。亚组分析结果还显示,在个体所患肿瘤为宫颈癌或肝癌、患者的分期处于晚期、Th22细胞圈定方法为CD4+IL22+时,患者外周血Th22细胞比例相比其他亚组表现得更高(表2)。此外,我们通过Meta回归对本文的异质性进一步探索后发现,肿瘤种类、Th22细胞圈定方法以及研究NOS评分均不是影响本文异质性高低的因素(P值均>0.01)(表3),因此有可能是纳入研究之间的设计存在差异引起的。
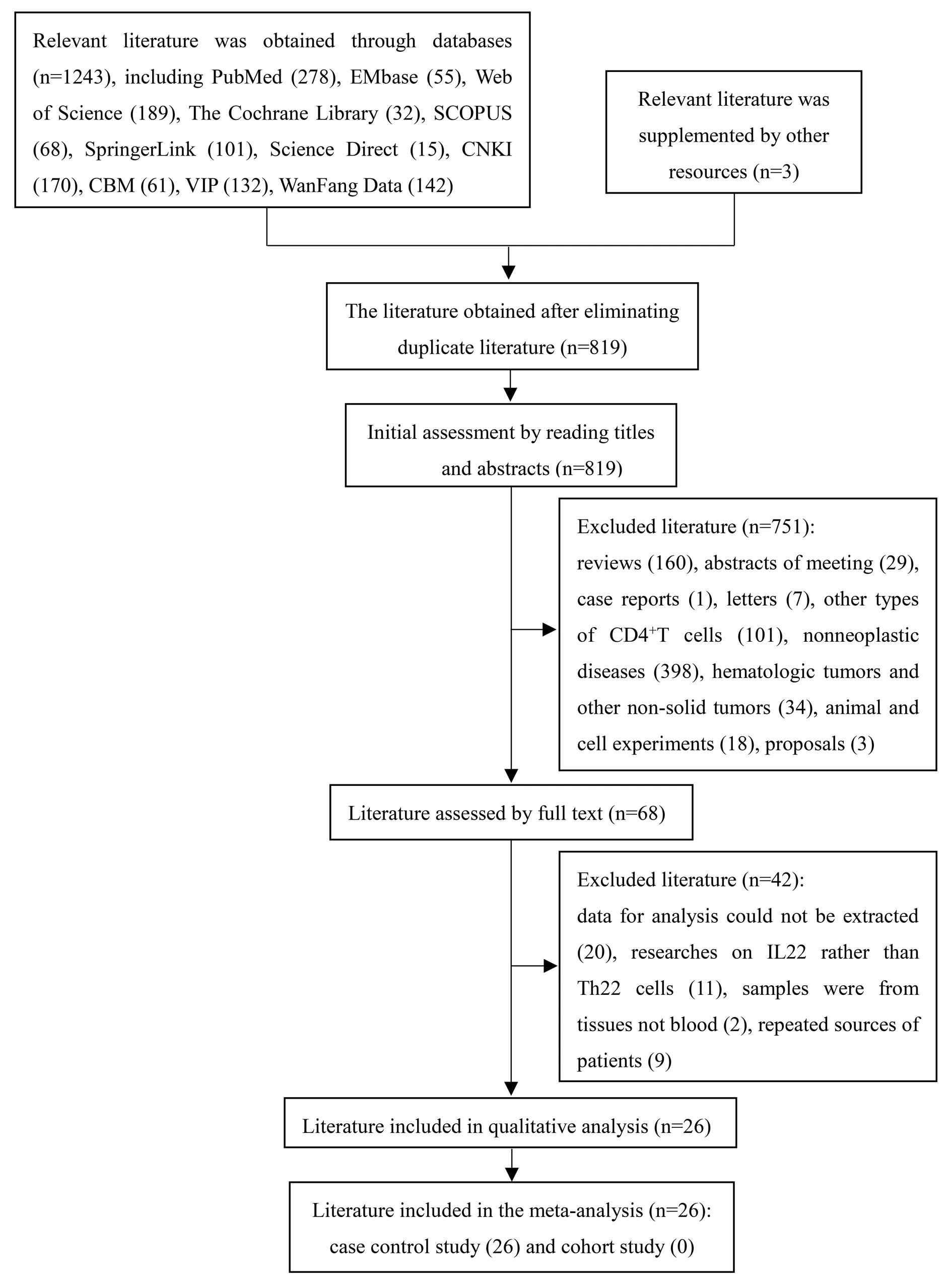
图2 文献筛选流程图及结果Fig.2 Flow chart of literature screening process and results
2.4敏感性分析及发表偏倚评估 采用依次逐项剔除单个研究的方法进行敏感性分析,重新估计合并效应量WMD,并与剔除前的分析结果比较。结果显示,逐一剔除每项研究后的分析结果与原来的结果没有冲突,提示本研究所得结果稳定(图5)。漏斗图分析结果显示,各项研究在中线两侧的分布对称性较差,且进一步的Egger′s检验也提示可能存在一定程度的发表偏倚(P=0.000),其原因可能是研究结果为外周血Th22细胞比例在肿瘤患者升高的文献更容易被刊物接收发表,这是本文异质性的重要来源之一(图6)。

图3 外周血Th22细胞比例与肿瘤相关性的Meta分析Fig.3 Meta-analysis of correlation between proportion of peripheral blood Th22 cells and tumors
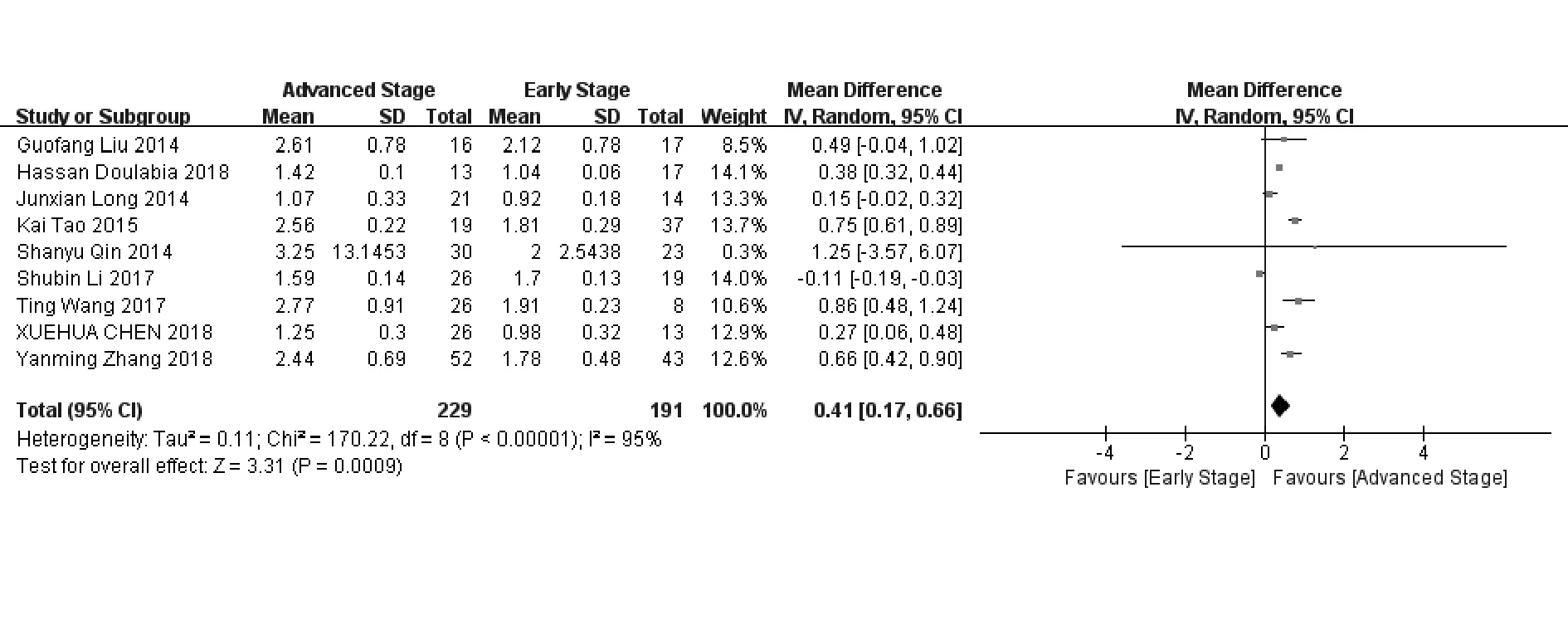
图4 肿瘤晚期患者与早期患者外周血中Th22细胞比例的Meta分析Fig.4 Meta-analysis of proportion of Th22 cells in peripheral blood of patients with tumors in advanced and early stage
表1 纳入研究基本特征及偏倚风险评价结果
Tab.1 Characteristics and risk of bias assessment of included literature
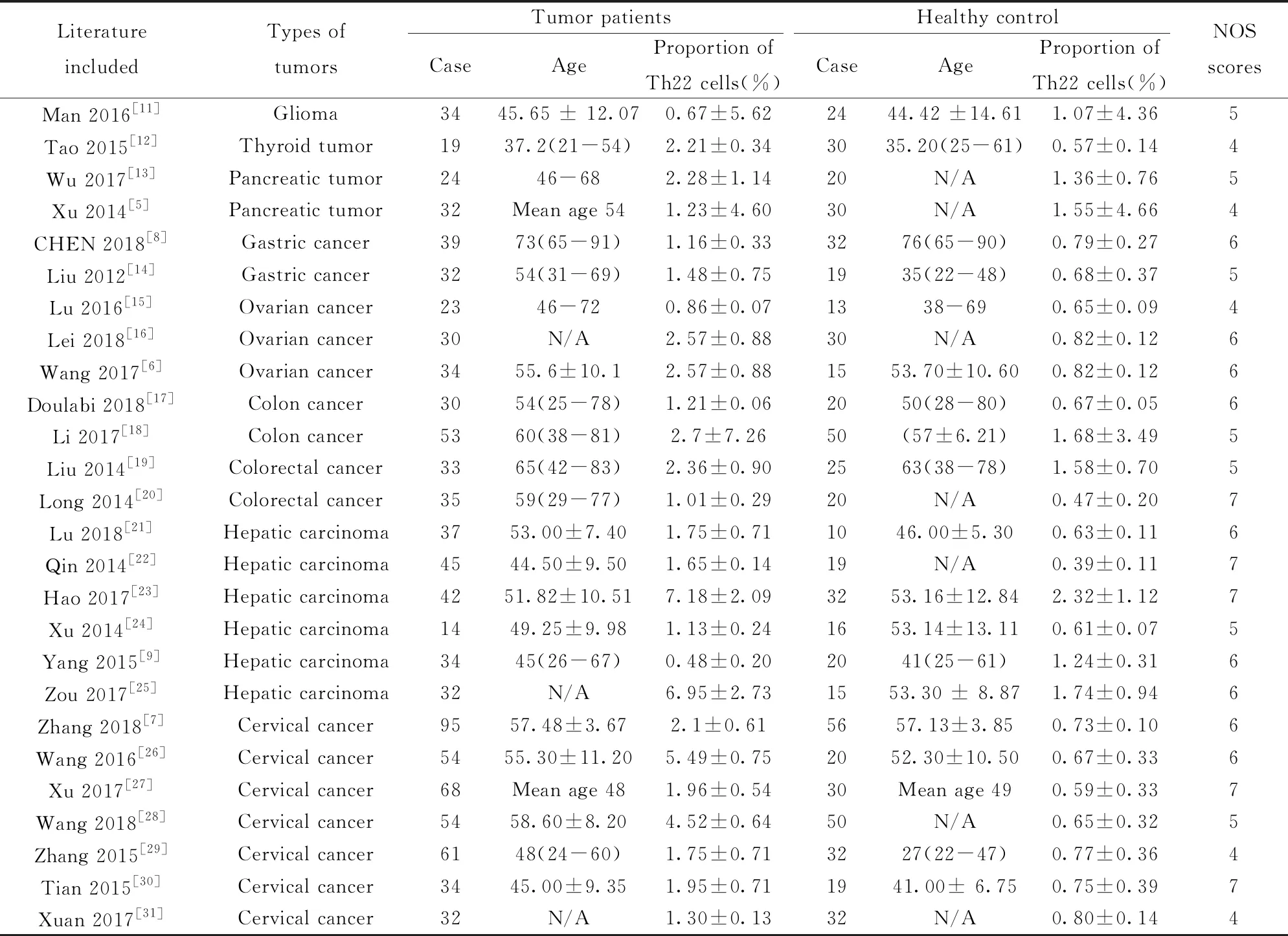
LiteratureincludedTypes oftumorsTumor patientsCaseAgeProportion ofTh22 cells(%)Healthy controlCaseAgeProportion ofTh22 cells(%)NOSscores Man 2016[11]Glioma3445.65 ± 12.070.67±5.622444.42 ±14.611.07±4.365Tao 2015[12]Thyroid tumor19 37.2(21-54)2.21±0.343035.20(25-61)0.57±0.144Wu 2017[13]Pancreatic tumor2446-682.28±1.1420N/A1.36±0.765Xu 2014[5]Pancreatic tumor32Mean age 541.23±4.6030N/A1.55±4.664CHEN 2018[8]Gastric cancer3973(65-91)1.16±0.333276(65-90)0.79±0.276Liu 2012[14]Gastric cancer3254(31-69)1.48±0.751935(22-48)0.68±0.375Lu 2016[15]Ovarian cancer2346-720.86±0.071338-690.65±0.094Lei 2018[16]Ovarian cancer30N/A2.57±0.8830N/A0.82±0.126Wang 2017[6]Ovarian cancer3455.6±10.12.57±0.881553.70±10.600.82±0.126Doulabi 2018[17]Colon cancer3054(25-78)1.21±0.062050(28-80)0.67±0.056Li 2017[18]Colon cancer5360(38-81)2.7±7.2650(57±6.21)1.68±3.495Liu 2014[19]Colorectal cancer3365(42-83)2.36±0.902563(38-78)1.58±0.705Long 2014[20]Colorectal cancer3559(29-77)1.01±0.2920N/A0.47±0.207Lu 2018[21]Hepatic carcinoma3753.00±7.401.75±0.711046.00±5.300.63±0.116Qin 2014[22]Hepatic carcinoma4544.50±9.501.65±0.1419N/A0.39±0.117Hao 2017[23]Hepatic carcinoma4251.82±10.517.18±2.093253.16±12.842.32±1.127Xu 2014[24]Hepatic carcinoma1449.25±9.981.13±0.241653.14±13.110.61±0.075Yang 2015[9]Hepatic carcinoma3445(26-67)0.48±0.202041(25-61)1.24±0.316Zou 2017[25]Hepatic carcinoma32N/A6.95±2.731553.30 ± 8.871.74±0.946Zhang 2018[7]Cervical cancer9557.48±3.672.1±0.615657.13±3.850.73±0.106Wang 2016[26]Cervical cancer5455.30±11.205.49±0.752052.30±10.500.67±0.336Xu 2017[27]Cervical cancer68Mean age 481.96±0.5430Mean age 490.59±0.337Wang 2018[28]Cervical cancer5458.60±8.204.52±0.6450N/A0.65±0.325Zhang 2015[29]Cervical cancer6148(24-60)1.75±0.713227(22-47)0.77±0.364Tian 2015[30]Cervical cancer3445.00±9.351.95±0.711941.00± 6.750.75±0.397Xuan 2017[31]Cervical cancer32N/A1.30±0.1332N/A0.80±0.144
Note:N/A.Not available.
表2 肿瘤患者与健康者对照外周血Th22细胞比例比较的亚组分析结果
Tab.2 Results of subgroup analysis comparing proportion of peripheral blood Th22 cells between patients with tumors and healthy control

SubgroupsNumbers ofliteratureHeterogeneityPI2MD(95%CI)(%)PTypes of tumorsColorectal cancer40.690%0.54(0.51,0.57)<0.000 01Pancreatic tumor20.314%0.83(0.18,1.47)0.01Ovarian cancer3<0.000 0199%1.23(0.01,2.45)0.05Cervical cancer7<0.000 01100%2.01(0.95,3.08)0.000 2Gastric cancer20.0184%0.56(0.14,0.98)0.009Hepatic carcinoma6<0.000199%1.65(0.88,2.42)<0.000 1Stage of tumorsEarly stage(Stage Ⅰ-Ⅱ)9<0.000 0198%0.72(0.40,1.04)<0.000 1Advanced stage(Stage Ⅲ-Ⅳ)9<0.000 0199%1.11(0.63,1.60)<0.000 01Different definitions of Th22 cellsCD4+IL22+5<0.000 01100%2.90(0.81,4.99)0.007CD4+IL17-IL22+30.0273%1.40(1.04,1.76)<0.000 01CD4+IFN-γ-IL17-IL22+10<0.000 0198%0.88(0.61,1.15)<0.000 1CD3+CD8-IFN-γ-IL17-IL22+20.2428%0.57(0.37,0.78)<0.000 1unclear definition5<0.000 01100%1.36(0.29,2.42)<0.000 1NOS scores≥7 Points5<0.000 01100%1.65(1.15,2.16)<0.000 01<7 Points21<0.000 01100%1.28(0.93,1.64)<0.000 01
表3 外周血Th22细胞比例与肿瘤相关性的Meta回归分析结果
Tab.3 Meta-regression analysis results of correlation between proportion of peripheral blood Th22 cells and tumors
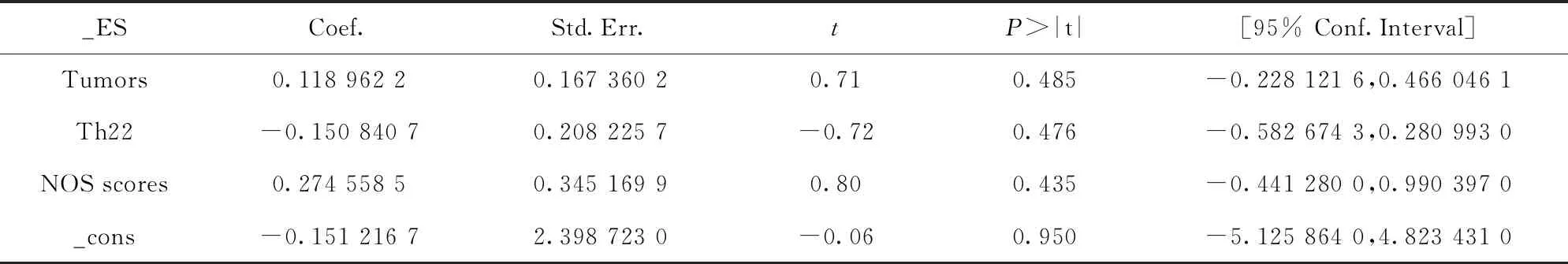
_ESCoef.Std.Err.tP>|t|[95% Conf.Interval]Tumors0.118 962 20.167 360 20.710.485-0.228 121 6,0.466 046 1Th22-0.150 840 70.208 225 7-0.720.476-0.582 674 3,0.280 993 0NOS scores0.274 558 50.345 169 90.800.435-0.441 280 0,0.990 397 0_cons-0.151 216 72.398 723 0-0.060.950-5.125 864 0,4.823 431 0
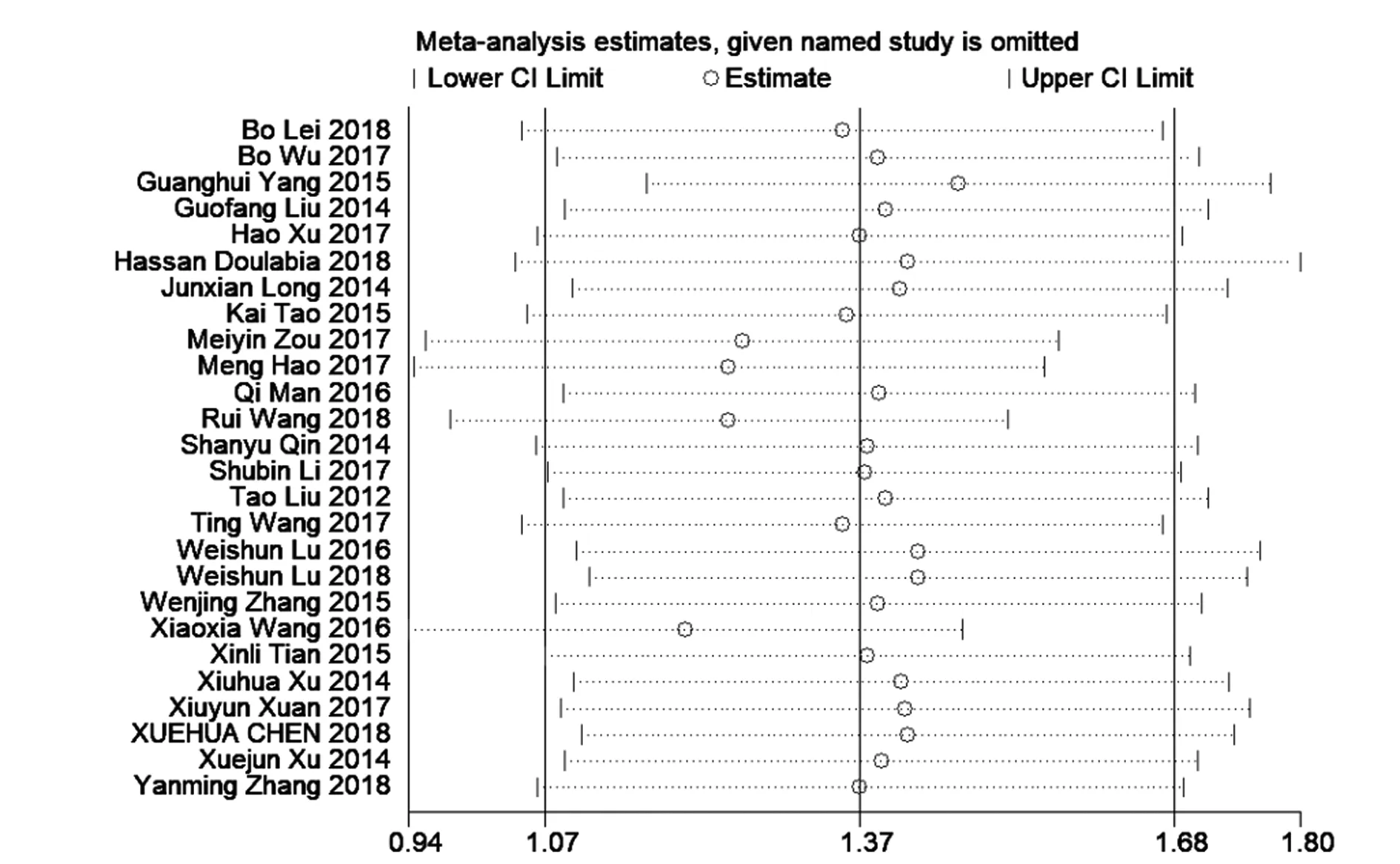
图5 外周血Th22细胞比例与肿瘤相关性的敏感性分析(逐一剔除单个研究)Fig.5 Sensitivity analysis of correlation between proportion of peripheral blood Th22 cells and tumors(eliminate individual study one by one)
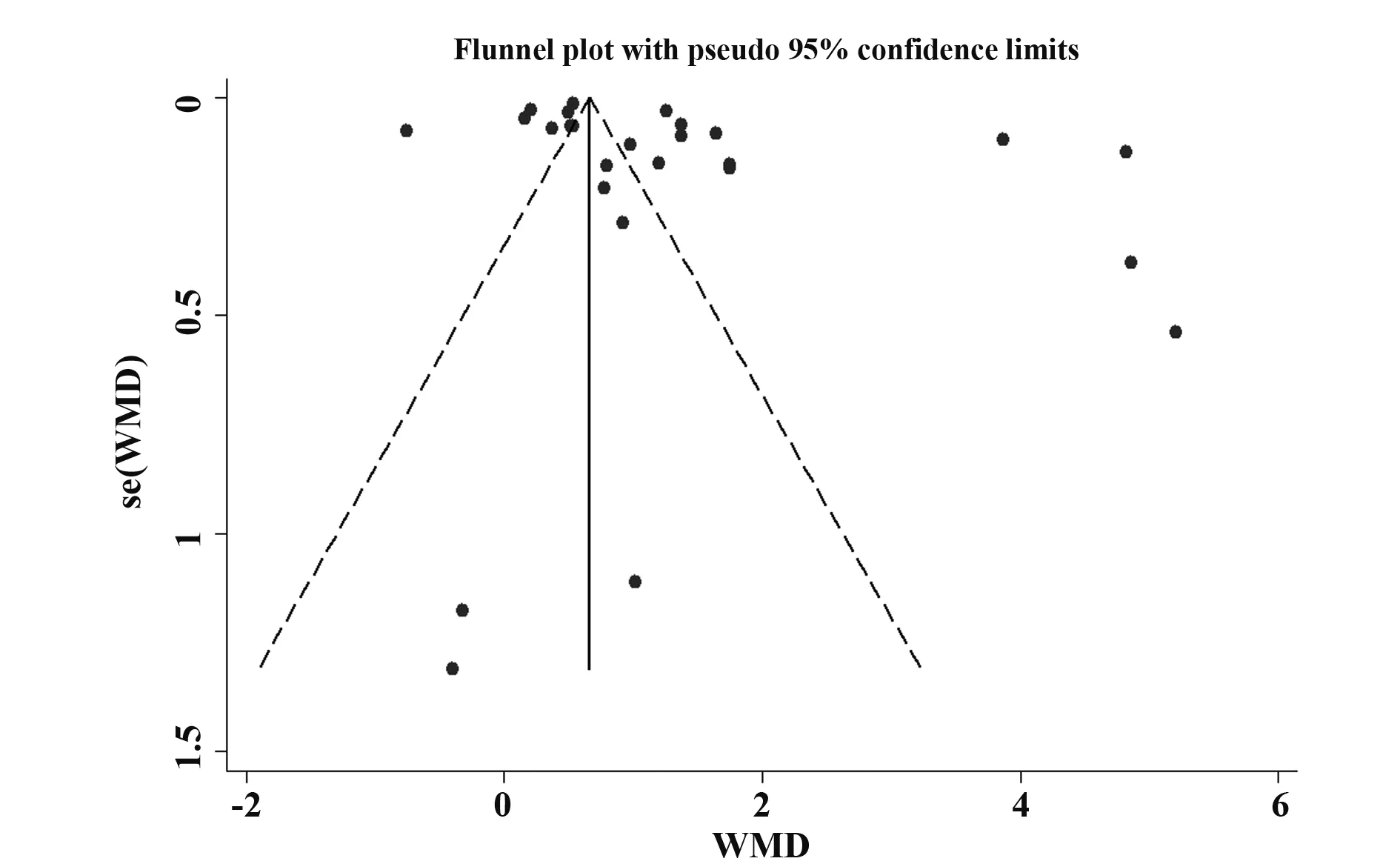
图6 外周血Th22细胞比例与肿瘤相关性的漏斗图Fig.6 Funnel plot of correlation between proportion of peripheral blood Th22 cells and tumors
3 讨论
Th22细胞是Trifari等[2]在2009年发现的一类新型CD4+T淋巴细胞亚群,是初始CD4+T细胞在白介素-6和干扰素-γ共同作用以及白介素-1β的协同促进下逐渐分化形成的。近十年的研究发现Th22细胞参与调控许多慢性炎症疾病以及自身免疫性疾病[32,33]。直到近五年,Th22细胞在肿瘤中的作用才开始逐渐被报道。研究者通过流式细胞技术检测肿瘤患者的外周血Th22细胞比例,发现其与健康人群外周血相比有所不同,大部分研究表明肿瘤患者外周血Th22细胞比例明显高于健康人群,但也有少部分研究提出其伴随着肿瘤的进展而不断减少[5-9]。这可能是因为在肿瘤发生发展的过程中,肿瘤细胞的激增导致机体免疫功能的初期应激和最终衰减,而Th22细胞的数量和功能改变是机体免疫功能变化的一种表现形式[34-37]。由于这些研究的证据等级较低且研究结果之间存在一定的差异性,Th22细胞在肿瘤中扮演的角色仍存在争议。故本研究通过纳入国内外相关文献进行Meta分析,进一步明确了Th22细胞在肿瘤发生发展中的作用。
由于血液系统肿瘤本身涉及血液细胞的变化,故本研究仅纳入实体瘤的相关研究,包括8种不同的实体瘤,共26个研究,Meta分析结果显示WMD=1.37,95%CI(1.07,1.68),显示肿瘤患者外周血中的Th22细胞比例较健康人群增多。另外,我们通过将肿瘤晚期患者和早期患者的外周血Th22细胞比例进行对比后发现,晚期患者外周血Th22细胞比例比早期患者更高,提示Th22细胞或许在不久的将来能作为一种新型的预测肿瘤分期和预后的生物标记物。同时,根据肿瘤类型进行亚组分析的结果发现Th22细胞比例在结直肠癌、胰腺癌、卵巢癌、宫颈癌、胃癌和肝癌患者外周血中相比健康人均升高。在甲状腺癌中的研究虽然仅有一篇,但也显示出增高的趋势。但是在脑胶质瘤患者与健康人的对比中却没有发现统计学差异,仍需进一步更多高质量研究的支持。由于Th22细胞是新发现的一种CD4+T细胞亚群,不同研究者对其的圈定方法也不尽相同。在本文中纳入的6种不同Th22细胞圈定方法中,Th22细胞比例在肿瘤患者组均高于健康对照组(P均<0.01)。大部分文献(10篇)把流式荧光抗体染色结果为CD4+IFN-γ-IL-17-IL-22+的细胞定义为Th22细胞,此时WMD=0.88,95%CI(0.61,1.15),P<0.000 1。这些亚组分析的结果均未发生逆转且使异质性降低,提示本研究的结果可靠。
本文Meta分析的结果直观地表明了外周血Th22细胞比例在肿瘤患者外周血中相比健康对照明显增高,尤其是在直肠癌、胰腺癌、卵巢癌、宫颈癌、胃癌和肝癌患者中,Th22细胞扮演着促进肿瘤发生发展的角色,且其在外周血中的比例伴随着疾病分期的升高而不断增加。另外,Sun等[36]将肿瘤细胞和Th22细胞共培养一段时间后发现,该组肿瘤细胞的增殖速度明显快于肿瘤细胞单独培养组,若同时添加抗IL-22抗体,则肿瘤细胞的增殖速率又被抑制,这一现象也提示了Th22细胞确实能促进肿瘤的进展,且该作用可能是通过IL-22作为桥梁来实现。而IL-22被发现可以激活JAK/STAT细胞信号通路和MAPK细胞信号通路进而促进肿瘤的发展[38]。结合这些研究结果可以明确Th22细胞能促进肿瘤的进展,但是更深入的机制还有待挖掘。
本研究的优势在于首次对外周血Th22细胞比例与肿瘤相关性的研究进行Meta分析,将多个研究结果的数据进行合并分析,扩大样本量,充分阐明了Th22细胞比例增加与肿瘤发生发展密切相关,解决了目前少量研究认为Th22细胞在肿瘤中发挥抑制作用的争议。但是本研究仍存在一定的局限性:①本研究共纳入26个研究,8种实体瘤,肿瘤的种类有待丰富;②阳性结果的研究更容易被发表,导致结果存在一定的发表偏倚;③纳入研究类型均为病例对照研究,未发现相关队列研究,病因推断能力较差。
综上所述,肿瘤患者的外周血Th22细胞比例较健康人群明显升高,且Th22细胞比例的大小对患者的疾病分期具有一定程度的提示作用。Th22细胞可能成为肿瘤患者的诊断和判断预后的新标志物,并能为患者定制精准的治疗方案提供循证医学证据。但是受纳入研究的肿瘤种类和研究数量的限制,上述结论尚需要更多研究予以证实。