两个双硫仑衍生物的合成及其体外抗肿瘤活性研究
2020-02-12贾艺悦牟感恩周则卫
贾艺悦,牟感恩,孟 鑫,沈 秀,周则卫,龙 伟
(中国医学科学院北京协和医学院放射医学研究所,天津 300192)
由于新药研发成本高,失败率高,周期长[1],近年来老药新用作为药物开发策略越来越受到重视[2],并由此诞生了大量的新适应症药物。双硫仑(disulfiram,DSF),分子式为C10H20N2S4,化学名为二硫化四乙基秋兰姆,又称戒酒硫、酒畏等,商品名为安塔布司(Antabuse),是一种较有前途的抗癌药物。早先发现DSF可以用于治疗酒精依赖,抑制酒精代谢过程中的乙醛脱氢酶,导致毒性物质乙醛在人体内大量累积,引起机体多种不适,达到戒酒目的[3];并且具有良好的安全性和耐受性[4]。在过去30年中,有报道DSF对多种肿瘤细胞株具有良好的体外抗肿瘤活力性[5-8],如乳腺癌、黑色素瘤、结直肠癌、神经胶质瘤、肺癌和前列腺癌等。DSF抑制泛素蛋白酶体/核转录因子NFκB通路、多药耐药基因MDR1的表达、拓扑异构酶、基质金属蛋白酶、核蛋白定位因子NPL4,调控MAP激酶通路。它能根除肿瘤干细胞(CSCs),显著逆转耐药肿瘤细胞的耐药性[9-13]。有研究报道,DSF的抗肿瘤机制为:在血清中迅速被还原为DDC,DDC是一种很强的过渡二价金属离子螯合剂,可结合铜离子。DSF接触铜离子的瞬间可触发活性氧产生,损伤DNA,蛋白质,脂质从而诱导肿瘤细胞死亡;而DDC与铜离子螯合形成的最终复合物会产生更强更持久的杀伤作用[14],DSF在血清中的转化过程见图1。DDC的硫醇基团是活性基团,秋兰姆结构及氮原子对其发挥活性是必不可少的[15]。在此基础上,我们对DSF结构进行改造,保留中间四个硫的活性部位,将两边换为对称的哌嗪基团,哌嗪基团比DSF多1个叔胺的碱性基团,会有一定线粒体靶向性。故此期望得到有更好抗肿瘤活性的衍生物。

图1 DSF在血清中的转化及活性形式
1 材料与方法
1.1 细胞、试剂和仪器
DF-101S恒温加热磁力搅拌器和RE-5299循环式真空水泵,购自巩义予华仪器责任有限责任公司;BuChiR-210旋转蒸发仪,购自瑞士BuChi公司;DZF-6020真空干燥箱,购自上海精宏仪器有限公司;紫外分光光度计,购自上海光谱仪器有限公司;GF254薄层层析硅胶板,购自烟台江友硅胶开发有限公司;核磁共振波谱仪,购自德国Bruker公司;多色荧光化学发光成像分析系统,购自德国Alliance公司。人乳腺癌细胞MCF-7和人肺癌细胞A549,均由北京协和医学院基础研究所提供。流式分析仪,购自美国BDbioscience公司。DSF(纯度>99%)、N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)、Cell Counting Kit-8(CCK-8)试剂盒购自大连美仑生物公司;胎牛血清(fetal bovine serum,FBS)购自以色列BI公司;磷脂酰丝氨酸蛋白抗体-碘化吡啶Annexin V-FITC/PI双染细胞凋亡检测试剂盒,购自凯基生物有限公司;PARP抗体和BAX抗体,购自美国Proteintech公司。
1.2 DSF衍生物的合成
胺、二硫化碳在KOH、NaOH或NaH等强碱存在下反应,在适当的溶剂中(常用乙醇作溶剂)形成对应的氨基二硫代甲酸盐,然后,再用碘单质将其氧化可得目标化合物。
衍生物DSF-1的合成步骤如下:取2 mL甲基哌嗪,溶于少许乙醇,加入溶有0.72 g NaOH的1 mL的水溶液,冰水浴下缓慢滴加1.1 mL二硫化碳,溶液起初为淡绿色,很快变为土黄色。室温搅拌约6 h,体系为棕黄色。分次加入2.3 g碘单质的2 mL的乙醇溶液,很快有白色沉淀析出,反应4 h体系为淡黄色,最后得到白色粉末2.085 g,产率33.04%。合成路线见图2。薄层层析(二氯甲烷∶甲醇=8∶1)显示为1个点。纯化后通过质谱和核磁氢谱、碳谱确证化合物的结构,为双(4-甲基-1-1-哌嗪基硫代甲酰基)二硫。

图2 DSF-1的合成路线
衍生物DSF-2的合成步骤如下:取2 mL乙基哌嗪,溶于少许乙醇,加入含有0.63 g NaOH的1 mL的水溶液,冰水浴下缓慢滴加0.95 mL二硫化碳,溶液起初为淡绿色,很快变为淡黄色。室温搅拌约6 h,体系为棕黄色。分次加入2.0 g碘单质的2 mL的乙醇溶液,很快有大量白色物质析出,反应4 h后体系变为淡黄色,最终得到白色粉末1.504 g,产率25.24%,合成路线见图3。薄层层析(二氯甲烷∶甲醇=8∶1)为1个点,纯化后通过质谱和核磁氢谱、碳谱确证化合物的结构,为双(4-乙基-1-1-哌嗪基硫代甲酰基)二硫。

图3 DSF-2的合成路线
1.3 细胞培养
MCF-7和A549细胞培养于含10%FBS、1%青链霉素的DMEM高糖培养基中,培养箱环境为37℃、CO2体积分数5%、相对湿度95%。细胞生长覆盖95%皿底面积时传代。
1.4 细胞增殖情况检测
受试物用DMSO溶解后,用DMEM培养基将其稀释为50、10、5、1和0.5μmol/L的溶液;含10%FBS的DMEM培养基将其稀释为10、5、1、0.5、0.1 μmol/L的溶液。NAC用含10%FBS的DMEM培养基溶解,浓度为1 mmol/L。
细胞处于对数生长期时胰酶消化,用细胞计数板计算细胞密度,按每孔5 000个细胞种于3个96孔板中,孵育24 h。待细胞贴壁并稳定生长后弃去旧培养液,第1个96孔板加入含10%FBS的DMEM配置的不同浓度的受试物溶液100μL,空白孔加入10%FBS的DMEM。第2个96孔板先加入含10%FBS的DMEM配置的不同浓度的受试物溶液50μL,每个孔再加入配好的NAC溶液50μL混匀,空白孔为10%FBS的DMEM和NAC溶液的混合液。第3个96孔板加入DMEM配置的不同浓度的溶液100μL,空白组为DMEM。每个浓度均设3个复孔,继续培养48 h后加入CCK-8溶液,37℃避光孵育,经酶标仪在480 nm处检测吸光度值,利用Graphpad软件计算IC50值,绘制存活率图,并进行t检验。细胞存活率为试验孔吸光度值与对照孔吸光度值的比值。
1.5 流式细胞术检测细胞凋亡率
受试物均用DMSO溶解,含10%FBS的DMEM培养基将DSF稀释为50、30μmol/L的溶液,将DSF-1和DSF-2稀释为20、10μmol/L的溶液。NAC用含10%FBS的DMEM培养基溶解,浓度为1 mmol/L。对数生长期的A549细胞和MCF-7细胞进行消化离心计数,6孔板每孔铺20万个细胞,孵育24 h。弃去培养基,按加入化合物的不同,以及是否含NAC,将MCF-7和A549细胞分为6个处理组,见表1。

表1 MCF-7和A549细胞的分组
作用24 h后收集死亡细胞,其余细胞用PBS冲洗并用胰酶消化收集并离心。将离心后的细胞重新悬浮在500μL缓冲液中,依次加入5μL FITC和5μL PI避光反应15 min。然后采用流式细胞仪检测细胞凋亡情况。用BD Accuri C6软件进行分析,直接可得细胞凋亡率。
1.6 Western blot法检测
取对数生长期的A549细胞和MCF-7的细胞消化离心计数,六孔板每孔铺20万个细胞,孵育24 h。弃去培养基。受试物用DMSO溶解后,含10%FBS的DMEM培养基稀释。MCF-7细胞各孔分别加入30 μmol/L的DSF溶液,10μmol/L的DSF-1溶液,10 μmol/L的DSF-2溶液,均为2 mL;A549细胞各孔分别加入50μmol/L的DSF溶液,20μmol/L的DSF-1溶液,20μmol/L的DSF-2溶液,均为2 mL。
作用24 h,收集细胞,常规裂解制备蛋白样品,经BCA蛋白定量法检测蛋白浓度。每组各取40μg总蛋白进行 SDS-PAGE,随后将蛋白印迹转到PVDF膜上,经 5%脱脂奶粉封闭、相应一抗溶液(1∶1 000稀释)4℃孵育,以及合适的二抗溶液(1∶3 000稀释)孵育。最后采用ECL化学发光显色试剂孵育曝光,相关结果采用多色荧光化学发光成像分析系统进行拍照,Image J分析条带灰度值。
蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值
1.7 统计学分析
所有实验均3次重复,用统计软件Graphpad Prism 8进行数据分析及t检验,α=0.05为检验水准。
2 结果
2.1 衍生物的结构表征
2.1.1 DSF-1 白色固体,m.p.143.6~144.8℃;1H NMR(CDCl3,400 MHz)δ:2.38(s,6H,CH3),2.61[t,8H,N(CH2)2],4.34[t,8H,CSN(CH2)2];13C NMR(CDCl3)δ: 193.55(CS2),54.53(NCCN),45.61(CH3); LC-MS m/z: 351.081(M+)。为双(4-甲基-1-1-哌嗪基硫代甲酰基)二硫。
2.1.2 DSF-2 白色固体,m.p.118.6~119.6℃;1H NMR(CDCl3,400 MHz) δ:4.34[t,8H,SCN(CH2)2],2.65[t,8H,N(CH2)2],2.5(q,J=7.2HZ,4H),1.15(t,J=7.2HZ,6H,CH3);13C NMR(CDCl3)δ:193.35(CS2),51.84(CH2),52.3(NCCN),12.00(CH3);LC-MS m/z:379.110(M+)。为双(4-乙基-1-1-哌嗪基硫代甲酰基)二硫。
2.2 CCK-8实验结果
用含10%FBS的DMEM培养基配制DSF及其2个衍生物,作用于MCF-7和A549细胞,CCK-8实验检测细胞增殖情况,结果见表2。可见作用时间在48 h时,两个衍生物对两种肿瘤细胞的抑制作用强于DSF,IC50的差异均有统计学意义(P<0.05)。

表2 DSF和衍生物分别作用于两种肿瘤细胞48 h时的IC50
DSF及其2个衍生物在含与不含FBS两种条件下对MCF-7和A549细胞的增殖抑制作用见图4~图6。可见体系中含FBS时,DSF及其2个衍生物作用下的MCF-7和A549细胞存活率均较不含FBS时降低,这一结果也与其他文献的报道一致[17]。可能的原因是因FBS中有铜离子,DSF及其衍生物抑制这两种肿瘤细胞的增殖需要铜离子的存在。
此外,NAC可以抑制ROS的产生,DSF及其2个衍生物在含与不含NAC两种条件下对MCF-7和A549细胞的增殖抑制作用见图7~图9。可见体系中含NAC时,DSF及其2个衍生物作用下的MCF-7和A549细胞存活率均较不含NAC时升高(P<0.05或P<0.01),提示DSF及其2个衍生物可能是通过产生ROS发挥抑制肿瘤细胞增殖的作用。

图4 DSF在含与不含FBS两种条件下对MCF-7和A549细胞的增殖抑制作用
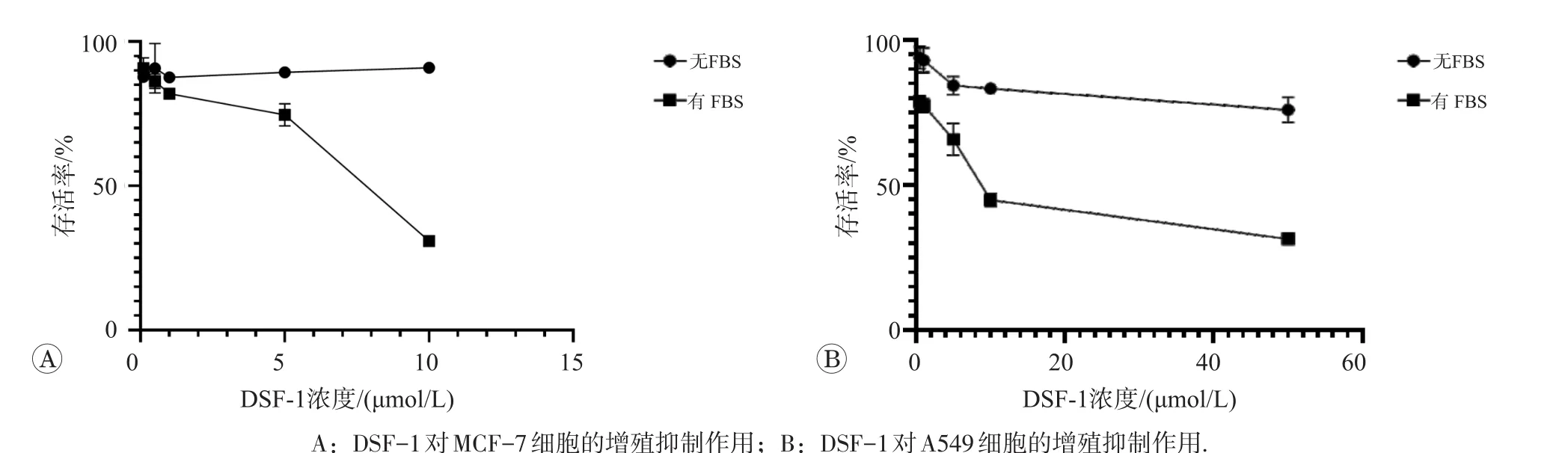
图5 DSF-1在含与不含FBS两种条件下对MCF-7和A549细胞的增殖抑制作用

图6 DSF-2在含与不含FBS两种条件下对MCF-7和A549细胞的增殖抑制作用
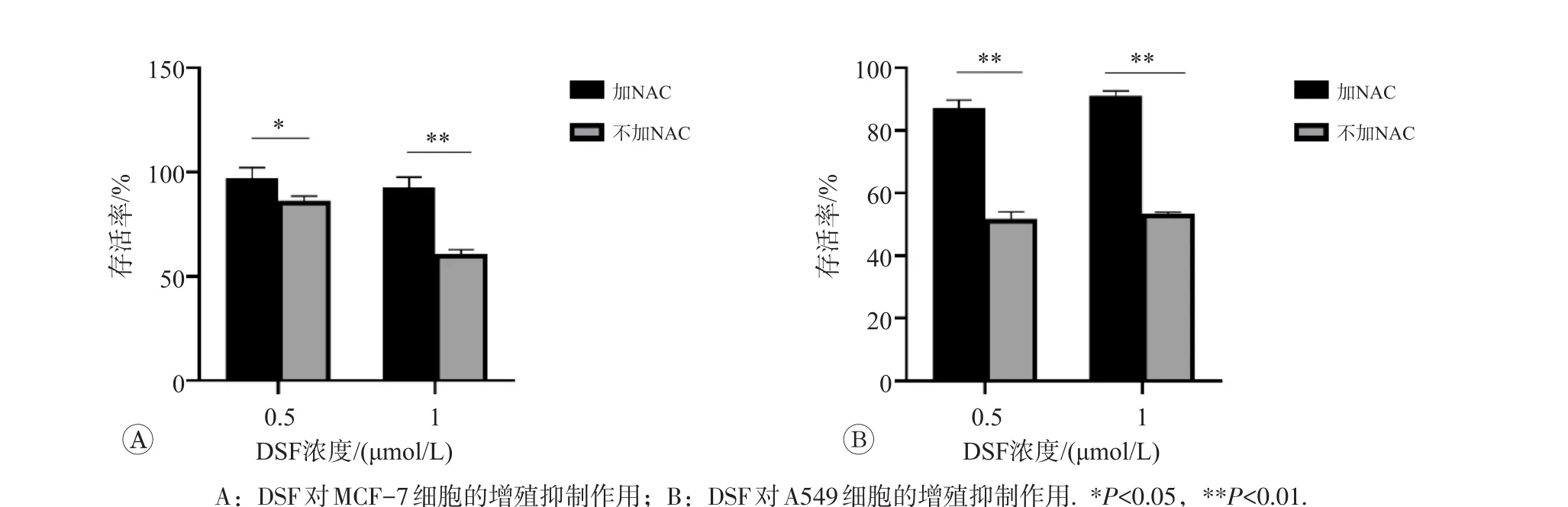
图7 DSF在含与不含NAC两种条件下对两种肿瘤细胞的增殖抑制作用

图8 DSF-1在含与不含NAC两种条件下对两种肿瘤细胞的增殖抑制作用

图9 DSF-2在含与不含NAC两种条件下对两种肿瘤细胞的增殖抑制作用
2.3 细胞凋亡情况
流式细胞术检测结果见图10,可见与DSF相比,DSF-1和DSF-2作用后的MCF-7和A549细胞凋亡比例均增加(P<0.05或P<0.01);与不加NAC相比,DSF-1和DSF-2加入NAC作用后的MCF-7和A549细胞凋亡比例减少(P<0.05或P<0.01)。
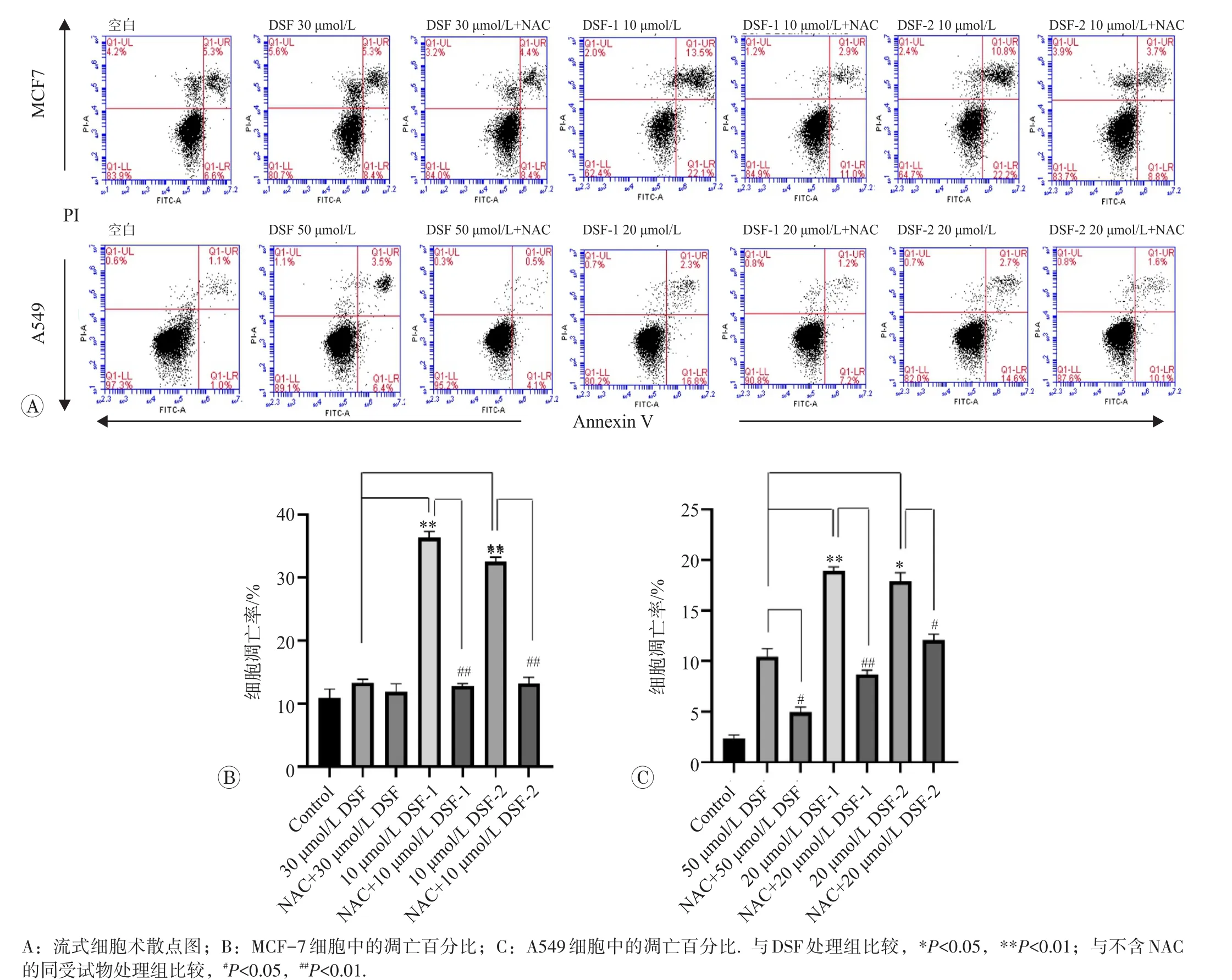
图10 DSF及其2种衍生物对MCF-7和A549细胞凋亡的影响
2.4 Western blot实验结果
Western blot检测结果见图11和图12,可见与对照组比较,DSF-1和DSF-2作用后MCF-7和A549细胞的PARP表达水平降低(P<0.05或P<0.01),DSF及其2种衍生物作用后MCF-7和A549细胞的BAX表达水平升高(P<0.05或P<0.01)。
3 讨论
双硫仑发挥抗肿瘤作用主要是依赖于秋兰姆结构及氮原子[15]。我们在前期大量的结构改造衍生物中筛选出了哌嗪环连接简单基团这一结构特征的衍生物,衍生物1和衍生物2活性较为突出。
双硫仑诱导氧化应激,可以增加黑色素瘤细胞的ROS水平,其活性能够被外源性的抗氧化剂抑制[5]。Colin等发现双硫仑对人神经母细胞瘤SK-N-BE及人胶质母细胞瘤UVW的抑制作用在有血清时呈双相作用,在低浓度时加入铜离子螯合剂时DSF失去活性,表明DSF/Cu复合物发挥抗肿瘤作用;在高浓度时加入NAC,DSF失去活性,表明氧化应激占主导[17]。而在本实验选择的两种肿瘤细胞中DSF及两个衍生物的抑制作用呈剂量依赖,并且在不加血清时完全失去活性。血清中有15μmol/L铜离子,10%~15%的血清中有1.5~2.3μmol/L铜离子[16],因此衍生物发挥抗肿瘤作用需要血清中的铜离子。同时我们也观察到在两种肿瘤细胞中,抗氧化剂会明显抑制衍生物的活性,证明其通过产生ROS发挥抗肿瘤作用。流式细胞术证明了DSF及两个衍生物可以诱导肿瘤细胞凋亡,并且这种作用可以被NAC抑制。

图11 DSF及其2种衍生物对MCF-7细胞凋亡相关蛋白表达的影响

图12 DSF及其2种衍生物对A549细胞凋亡相关蛋白表达的影响
细胞凋亡分为3种途径:内质网应激途径,死亡受体途径和线粒体途径。研究报道双硫仑通过调节线粒体通路相关蛋白诱导肿瘤细胞凋亡。BCL-2家族蛋白中促凋亡与促存活蛋白之间的相互作用控制着细胞色素C等物质从线粒体释放。其中BAX是研究最广泛的促凋亡蛋白,存在于细胞质中。当细胞受到凋亡信号诱导时,BAX构象改变向线粒体转位并形成二聚体,PT孔打开,细胞色素C及凋亡诱导因子从线粒体释放入细胞质,促进蛋白水解及caspase激活[18]。多聚ADP核糖聚合酶(PARP)是一类存在于多数真核细胞中的蛋白质翻译后修饰酶,在维持基因组的完整性方面起着关键作用。在细胞凋亡过程中,激活的caspase-3将PARP酶剪切为89 kD和24 kD两个片段,使其失去PARP原酶的正常功能。Western blot实验结果表明衍生物可以增加两种肿瘤细胞中BAX的表达,减少PARP酶的表达。但具体的机制需要进一步研究。同时,还需要进一步的体内荷瘤实验确证衍生物的抗肿瘤活性。
综上所述,合成的两个双硫仑衍生物具有一定的体外抗肿瘤功效,优于双硫仑,且其活性与铜离子的存在密切相关。其机制可能与凋亡相关蛋白的表达,以及增加肿瘤细胞内ROS的产生相关。
