ECE-1基因去甲基化在腹主动脉缩窄术后左室肥厚大鼠中的作用及机制研究
2020-02-12樊琼玲王家威俞金秀马正文张石蕾由淑萍
樊琼玲,王家威,俞金秀,马正文,张石蕾,蒋 红,由淑萍,
(1.新疆医科大学护理学院,新疆 乌鲁木齐830011;2.新疆医科大学公共卫生学院,新疆乌鲁木齐 830011)
截至2018年,我国高血压患病人数高达2.45亿[1]。左室肥厚作为高血压靶器官损害之一,使心肌细胞从成熟的“收缩状态”向“胚胎型合成状态”转化,是冠心病、心力衰竭、脑卒中等心血管疾病的独立危险因素[2]。因此,减缓和逆转左室肥厚迫在眉睫。课题组前期对哈萨克族高血压患者外周血样本研究发现[3],差异甲基化基因参与基因转录调控、离子代谢和细胞分化等多个生物学过程,其中内皮素转换酶(endothel in converting enzyme,ECE)基因甲基化参与了代谢相关通路。内皮素1(endothelin 1,ET-1)作为最强的活性多肽可直接参与心肌肥厚的形成及病理过程。ECE-1是ET-1生成的主要限速酶,是调控ET-1水平的重要因素。研究发现[4-5],ECE-1位于染色体1p36.1,在启动子区域有1个CpG岛,ECE-1c基因甲基化会降低其转录活性,而导致ET-1生成减少;同样,ECE-1基因去甲基化会增加其转录活性,使体内ET-1生成增多,血压升高而促进心肌肥厚。因此,ECE-1基因去甲基化可能是高血压心肌肥厚的一个新靶点,磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/PKB)信号通路是重要的生存信号通路。研究表明[6],PI3K/PKB信号通路及通路中的众多受体和激酶与心血管疾病有着密切的联系,并在其病理过程中发挥着重要的作用。因此,本实验通过腹主动脉缩窄术(abdominal aortic constriction,AAC)建立大鼠压力超负荷左室肥厚模型,探讨ECE-1基因去甲基化在高血压左室肥厚大鼠中的作用,及对PI3K/PKB信号通路的影响,为高血压左室肥厚寻找新的靶点。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠30只,体质量180~220 g,购自新疆医科大学实验动物中心,动物生产许可证号SYXK(新)2016-0003,合格证号SCXK(新)2016-0002。饲养环境温度22~24℃,相对湿度45%~55%,每天按12 h/12 h明/暗交替。本动物实验由新疆医科大学第一临床附属医院动物伦理委员会批准(20180223-183)。
1.2 实验试剂
ANP、ECE-1引物及探针及ECE-1甲基化引物,由上海生工生物工程公司合成;β-actin引物,购于北京博奥森生物科技有限公司;DNA提取试剂盒、DNA重亚硫酸盐转化试剂盒,购于北京天根生化科技有限公司;2×Tap PCR Master Mix,购于美国Biomiga公司。兔抗PI3K、PKB、p-PI3K、p-PKB和β-actin抗体、ET-1 ELISA试剂盒,购于北京博奥森生物科技有限公司;SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒、4×蛋白质上样缓冲液,购于北京索莱宝生物有限公司;反转录试剂盒,购于美国Thermo Scientific公司;荧光定量试剂盒,购于大连TaKaRa公司。
1.3 实验仪器
-80℃医用低温保存箱,产自青岛海尔特种电器有限公司;HD11 XE超声诊断仪,产自德国飞利浦有限公司;液氮罐,产自四川乐山市东亚机电工贸有限公司;移液器、QuantStudio实时荧光定量PCR仪、全波长自动酶联免疫反应检验测试仪,产自美国Thermo Scientific公司;Western blot使用的电源、电泳装置及转膜装置,产自美国Bio-Rad公司;FluorChem E化学发光高灵敏凝胶成像仪,产自美国Protein Simple公司;基因扩增仪,产自美国Bio-Rad公司。
1.4 动物分组与心肌肥厚模型的制备
大鼠左心室肥厚模型制备参照文献[7]。健康SPF级SD大鼠30只,采用随机数字表法分为对照组、模型组、假手术组,每组10只。大鼠禁食12 h后,按0.002 mL/g给予2.5%戊巴比妥钠腹腔麻醉,备皮,无菌环境下腹正中剖开腹腔2~2.5 cm,将腹内脏器推向右侧,于右肾动脉上方0.5 cm处剥离并充分暴露腹主动脉,将8号针头平行腹主动脉用2号线一并结扎后,抽出针头,造成腹主动脉狭窄,随后腹腔滴注20万U青霉素预防感染,关闭腹腔。假手术组大鼠剖腹后,分离腹主动脉,不予结扎;对照组不进行手术。
1.5 指标检测
1.5.1 大鼠心脏质量指数测量大鼠行腹主动脉缩窄术6周后,进行超声心动检查,后经腹主动脉采血处死。处死后立即打开胸腔,取出心脏,去除主动脉和左右心耳,4℃生理盐水冲洗心腔3次,用干净滤纸吸干水分后称取体质量(body weight,BW)和心脏质量(heart weight,HW),按下式计算心脏质量指数(heart weight index,HWI):
HWI=HW/BW
1.5.2 大鼠超声心动检查腹腔注射2.5%戊巴比妥钠麻醉大鼠后,左侧上腹部及胸部备皮后仰卧并固定大鼠四肢。以频率60 Hz小动物超声探头于胸骨左侧检测,显示左室短轴切面。选择清晰的图像进行分析。检测指标包括左室舒张末内径(left ventricular end-diastolic diameter,LVED)、左室舒张末后壁厚度(left ventricular posterior wall thickness,LVPWT)、射血分数(ejection fractions,EF)、左室短轴收缩率(fractional shortening,FS)。以上指标均取3个测量值后取平均值。
1.5.3 心肌病理学检查剪取心尖部位部分心肌,以4%多聚甲醛固定后石蜡包埋组织,切片厚度4μm,置于60℃烤箱2 h烘干,苏木精-伊红染色,中性树胶封片后光学显微镜下观察并拍照。用Image J图像分析软件测量单个细胞表面积,每组随机取4张切片,每张切片随机取3个视野,每个视野检测10~15个细胞,取其平均值为单个细胞表面积(the area of myocardial cells,AMC)。
1.5.4 甲基化特异性PCR检测ECE-1基因的甲基化状态 采用DNA提取试剂盒提取大鼠左室心肌组织中全基因组DNA,按说明书进行。分光光度计检测DNA浓度,要求吸光度值=D(260)/D(280)在1.8~1.9之间,DNA量不少于200 ng,体积不高于20μL,以符合甲基化修饰要求。使用DNA重亚硫酸盐转化试剂盒对各样本基因组DNA进行亚硫酸盐修饰及纯化,按说明书操作。甲基化特异性PCR(methylation-specific PCR,MSP)反应体系为25μL,其中含亚硫酸盐修饰后DNA模板 3 μL,10×Buffer 2.5 μL,22.5 mmol/L 的dNTPs 2.5μL,10 μmol/L的基因引物各1μL,HotStar Taq DNA聚合酶0.1μL,用双蒸水调整体系,使得终体积为25μL。循环反应共45个循环;72℃延伸5 min;ECE-1基因甲基化引物经Methprimer网站在线设计,由上海生工合成,引物序列见表1。反应结束后,取5μL PCR产物经2.0%的琼脂糖凝胶电泳,Bio-Rad凝胶成像系统摄像并分析甲基化条带及非甲基化条带的光密度值。以经SssI甲基转移酶处理的DNA为甲基化的阳性对照,以正常对照组DNA为未甲基化的阳性对照。按下式计算待测基因的去甲基化率:
去甲基化率=D(302)非甲基化/[D(302)甲基化+D(302)非甲基化]×100%

表1 MSP检测引物序列
1.5.5 血浆ET-1水平检测抽取大鼠腹主动脉血,置于抗凝管内,常温放置2 h后,3 000 r/min离心,用移液器吸取上层清液,-80℃保存待测。据酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书检测大鼠血浆ET-1水平。
1.5.6 荧光定量PCR检测心肌肥厚因子心房利钠肽和ECE-1mRNA表达取50 mg心肌样品,以Trizol法提取左室心肌组织总RNA,纯化后紫外分光光度计检测纯度,吸光度值D(260)/D(280)>1.8。定量后将RNA反转录为cDNA,取产物2μL在实时荧光定量PCR仪中进行扩增。总反应体系为20μL,扩增条件:95℃、30 s;95℃、3 s,60℃、30 s,40个循环;95℃、15 s,60℃、60 s。结束后设基线值、阈值,取循环阈值(CT),目的基因相对表达量以采用法分析。目的基因心房利钠肽(atrial natriuretic peptide,ANP)、ECE-1和内参β-actin引物序列见表2。
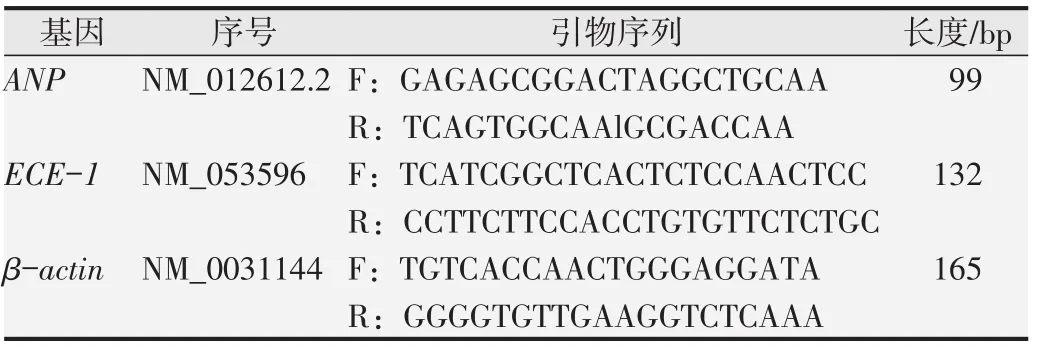
表2 荧光定量PCR检测引物序列
1.5.7 Westernblot检测心肌p-PI3K、PI3K、p-PKB、PKB蛋白表达在50 mg大鼠左室心肌样品中加入3次液氮冷冻后,加入RIPA裂解液研磨提取总蛋白,BCA法测定蛋白浓度,取蛋白样品40μg,100℃下热变性5 min,上样于聚丙烯酰胺凝胶进行还原性SDS-PAGE电泳,湿转(PVDF膜),200 mA恒流电转90 min。封闭液(5%脱脂奶粉)封闭 PVDF膜过夜,用1×TBST缓冲液充分振荡清洗3次,每次10 min,TBST稀释抗体,一抗浓度为:p-PI3K,PI3K,p-PKB,PKB均按1∶1 000稀释;ECE-1,1∶200稀释;β-actin,1∶5 000稀释。ECL显色,FluorChem E化学发光高灵敏凝胶成像仪上检测条带灰度值,按下式计算蛋白相对表达水平:
蛋白相对表达水平/%=目的条带灰度/β-actin条带灰度×100%
1.6 统计学方法
采用SPSS 25.0版软件进行统计分析,定量资料以xˉ±s表示,多组间均数比较采用ONE-WAY ANOVA,多组间两两比较采用LSD法,以α=0.05为检验水准。
2 结果
2.1 各组大鼠的HWI的比较
各组大鼠HWI结果见表3。三组大鼠的BW没有明显差异;与空白组比,假手术组的HW、HWI没有明显差异。与假手术组相比,模型组HW、HWI显著增加,其中HWI增加31.5%,差异具有统计学意义(P<0.01)。表明模型组大鼠出现心肌肥厚。
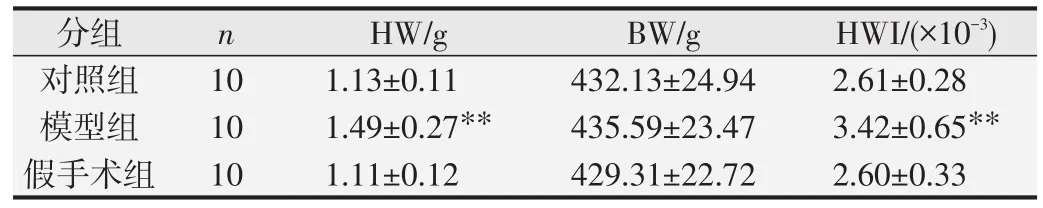
表3 各组大鼠HWI的比较
2.2 各组大鼠超声心动图检测指标的变化
各组大鼠超声心动图检测结果见表4。与对照组比较,假手术组大鼠的LVPWT、LVED、EF和FS无明显统计学差异;与假手术组比较,模型组LVPWT明显上升,LVED、EF和FS明显下降,差异具有统计学意义(P<0.01)。提示模型组大鼠压力负荷型心肌肥厚模型成功建立,出现心功能下降表现。
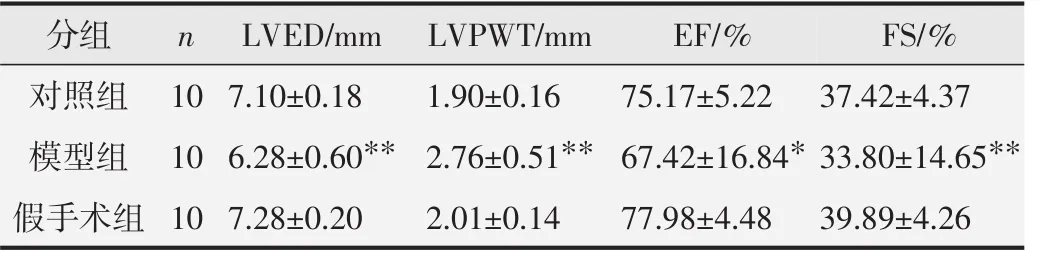
表4 各组大鼠超声心动图检测结果
2.3 各组大鼠心肌组织病理学的变化
各组大鼠心肌组织病理学检测结果见图1。苏木素-伊红染色显示,对照组与假手术组大鼠心肌细胞排列整齐,单位视野内细胞数量和细胞间距正常,未见明显炎性浸润。与假手术组比较,模型组的心肌细胞排列紊乱,组织中可见炎性细胞浸润间质增大,单位视野内细胞核的数量减少,细胞间距变小,AMC明显增大(P<0.01)。提示腹主动脉缩窄术后6周大鼠心肌肥厚形成。
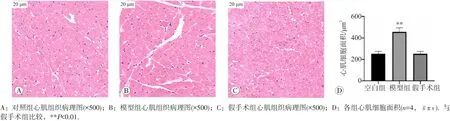
图1 各组大鼠心肌组织病理学变化
2.4 各组大鼠心肌组织中ECE-1基因去甲基化水平的改变
各组大鼠心肌组织ECE-1基因去甲基化水平检测结果见图2。结果显示,与对照组、假手术组相比,模型组去甲基化水平明显升高,差异具有统计学意义。提示心肌肥厚的发生与ECE-1基因去甲基化水平升高有关。
2.5 各组大鼠血浆ET-1水平改变
各组大鼠血浆ET-1水平检测结果见表5。与对照组比,假手术组血浆ET-1水平没有明显差异;与假手术相比,模型组血浆ET-1浓度显著升高(P<0.01)。

表5 各组血浆ET-1水平
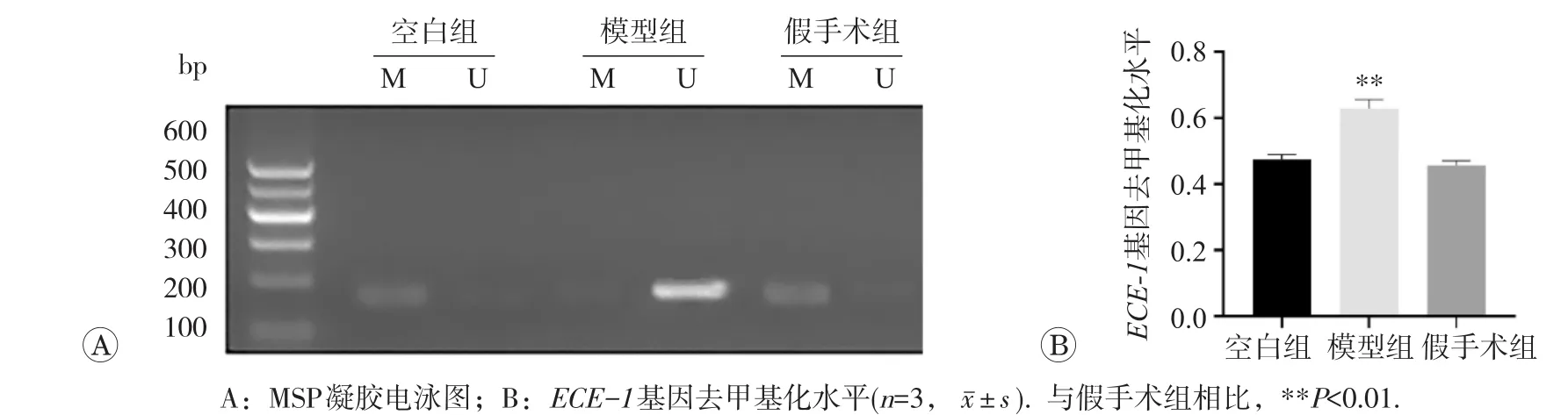
图2 各组大鼠心肌组织ECE-1基因甲基化水平
2.6 各组大鼠心肌组织中心肌肥厚因子ANP和ECE-1 mRNA表达的改变
各组大鼠心肌组织中心肌肥厚因子ANP和ECE-1 mRNA表达检测结果见图3。与对照组比较,假手术组大鼠心肌组织的ANP和ECE-1 mRNA表达水平无明显统计学差异;与假手术组比较,模型组大鼠心肌组织的心肌肥厚因子ANP和ECE-1的mRNA表达明显上调(P<0.01)。

图3 各组大鼠ANP、ECE-1 mRNA的相对表达水平
2.7 各组大鼠心肌组织中的PI3K/PKB通路相关基因的蛋白表达的变化
各组大鼠心肌组织中PI3K/PKB通路相关蛋白表达检测结果见图4。与对照组比较,假手术组大鼠心肌组织的PI3K、PKB、p-PI3K、p-PKB蛋白表达水平无明显统计学差异;与假手术组比较,模型组大鼠的心肌组织中PI3K、PKB蛋白表达无明显变化,磷酸化蛋白p-PI3K、p-PKB表达明显下调(P<0.01)。
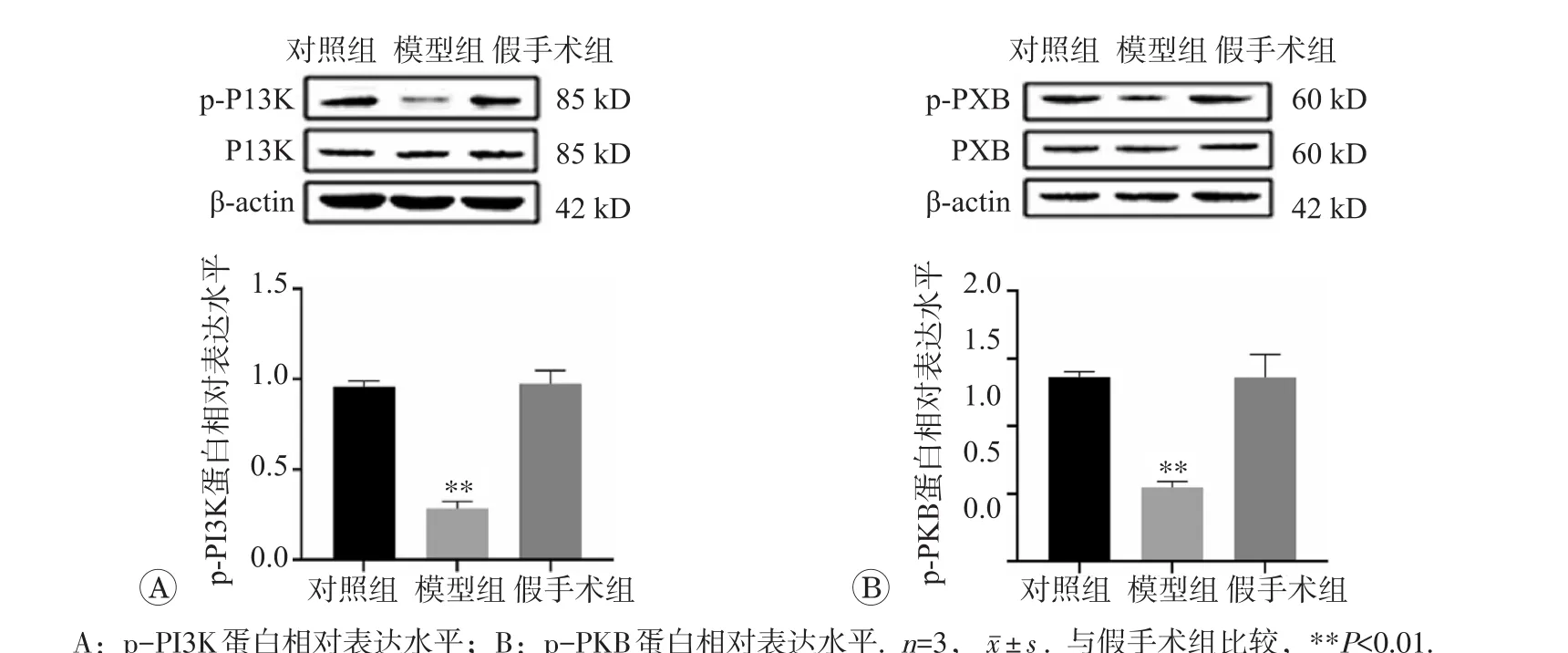
图4 各组大鼠p-PI3K、p-PKB蛋白表达水平
3 讨论
心肌肥厚的形成与高血压的关系密切,是最为常见的高血压靶器官损害和最严重的并发症之一[8]。近年来的研究表明,心肌肥厚的逆转可降低心血管疾病发病率、死亡率及总死亡率,其作用优于单纯的高血压患者血压水平的降低及降压治疗方案的调整[9-10]。因此,对高血压的治疗不应局限于血压的控制,更应该关注逆转左室肥厚并防止心肌的纤维化,使心肌恢复正常结构和功能。
DNA甲基化是指在DNA序列里特定的碱基在DNA甲基转移酶的催化作用下,S-腺苷甲硫氨酸作为甲基供体,通过共价键结合获得一个甲基的观遗传学DNA甲基化修饰过程[11]。ET-1是迄今所知最强的缩血管物质,可强烈收缩入球动脉和出球动脉,导致尿液和排钠减少,血压升高。而ECE-1作为内皮素生成过程中最后一步反应的关键酶,限制着ET-1的合成。同时,ET-1和ECE-1在心血管疾病中共存,ECE-1可调节ET-1的生成对疾病发生发展十分重要[12]。在体外血管内皮细胞实验中[4-5],ECE-1c基因启动子区CpG岛的甲基化会降低其转录活性,导致ECE-1c表达下降,从而进一步导致体内ET-1生成减少,血压降低,提示ECE-1甲基化可能参与了高血压的病理过程。在本研究中,我们运用MSP法检测了ECE-1基因甲基化状态在正常大鼠心肌组织和AAC术后的压力超负荷的肥厚心肌组织中的差异。实验结果显示,模型组大鼠心肌组织的ECE-1基因去甲基化水平相较于假手术组和对照组明显升高。因此,ECE-1基因去甲基化也可能参与了心肌肥厚的发生。
研究表明[13],ET-1可通过内皮素受体B1调节内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的活性及一氧化氮(nitric oxide,NO)的释放。NO作为一种重要的舒张血管物质,可以从多个水平拮抗ET-1的缩血管作用,维持心血管的正常功能[14]。PI3K/PKB是NO的重要的上游信号通路,直接影响着NO的生成与释放。PI3K/PKB信号通路及通路中的众多受体和激酶与高血压、心力衰竭等心血管疾病有着密切的联系[15-16]。PKB是此通路的信号核心,其活化可通过磷酸化激活或抑制下游效应分子,从而调节分子功能[17]。PKB在早期心衰病人中的短暂活化,对心肌细胞是有利的,其可通过抑制细胞凋亡,增强血管生成,促进心肌能量代谢和抑制炎症反应等反应完成,但是PKB的持续性激活,将会导致心脏功能严重下降[18]。在本研究中我们发现,在腹主动脉缩窄术后6周的大鼠发生了压力超负荷心肌肥厚,Western blot显示,相较于假手术组,模型组大鼠心肌组织中PPI3K、P-PKB蛋白表达显著降低。因此,ECE-1基因去甲基化可能与PI3K/PKB信号通路中PI3K、PKB蛋白磷酸化水平被抑制有关,从而导致了高血压心肌肥厚的发生发展。
腹主动脉缩窄术可通过增加外周循环阻力使心脏后负荷增加,与原发性高血压的形成过程类似,是研究压力超负荷心肌肥厚及心衰的病理生理、分子生物学机制和心血管系统药理学的理想动物模型。本实验以超声心动检查、病理组织学检测以及心肌肥厚因子ANP mRNA表达水平评价心肌肥厚模型。实验发现,造模6周后,与假手术组比较,模型组大鼠的BW和HW显著下降,HWI显著上升(P<0.01)。超声心动图作为筛查及诊断心肌病的首选影像学方法,可以为心功能的评价提供全面客观的依据[19]。实验显示,与假手术组比较,模型组大鼠的LVPWT呈明显上升,LVED、EF和FS呈明显下降,心功能明显变差(P<0.01)。从心肌病理学检查发现,与假手术组比较,模型组大鼠的心肌细胞排列紊乱,组织中可见炎性细胞浸润间质增大,单位视野细胞核的数量减少,AMC明显增加(P<0.01);以上都明确提示了模型组大鼠发生了心肌肥厚。此外,ANP是心肌肥厚的标志性基因,在实时荧光定量PCR检测中发现模型组组ANP mRNA相对表达水平明显升高(P<0.01)。以上4个方面,从超声、病理到分子水平证实了AAC后大鼠压力超负荷心肌肥厚模型的成功建立,从而进一步佐证ECE-1基因在心肌肥厚中的作用。
综上所述,在本实验中,我们对高血压左室肥厚与ECE-1基因甲基化水平、PI3K/PKB信号通路的关系进行了初步探讨,发现ECE-1去甲基化参与了压力超负荷心肌肥厚的形成过程,且与心肌肥厚正相关,该过程可能与PI3K/PKB信号通路的抑制有关。
