降脂酮对棕榈酸诱导BRL-3A细胞胰岛素抵抗的保护作用
2020-02-12周珈右韩家诚管浩军海春旭李文丽
金 磊,周珈右,韩家诚 ,管浩军,王 帅,彭 洁,王 欣,海春旭,李文丽,
(1.空军军医大学预防医学系军事毒理学与防化医学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室,陕西 西安 710032;2.空军军医大学基础医学院学员队,陕西 西安 710032)
二型糖尿病(type 2 diabctesmellitus,T2DM)是威胁全球人类健康的最重要的非传染性疾病之一,近年来,T2DM及糖尿病前期罹患率飞速增长。糖尿病不仅损害了患者的精神和肉体,还使得个体生存质量显著下降,罹患心血管事件及死亡风险明显升高,由此导致的卫生支出增加也给个体和社会造成了沉重负担。T2DM的发病机制不清,有许多假说,如遗传学说、肥胖学说、胰岛素失代偿学说、脂毒性学说、氧化应激学说等。随着对T2DM发病机制研究的深入[1],有关的治疗药物日趋丰富与多样化[2],但多存在非治疗副反应。而中药日益受到人们的关注。研究发现,除根皮苷、小檗碱外,姜黄素、齐墩果酸、黄芪、葛根素等多种中药组分及中成制剂均具有降低血糖、血脂,减轻胰岛素抵抗(insulin resistance,IR)等效果。因此,对植物提取物的重新认识,让人们对其作用的有效部位、作用机理有更深刻的认识,并对其改造成为治疗T2DM的有生力量[3]。中药槐角在临床上能较好地控制高脂血症,而降脂酮(JZT)是槐角提取后得到的有效制剂,体内研究发现其有较好降低脂肪和类脂效果,但在体外及IR中的效果尚无研究。我们前期建立了棕榈酸(palmitic acid,PA)诱导大鼠肝细胞系BRL-3A胰岛素抵抗细胞模型[4]。本实验研究降脂酮对棕榈酸诱导BRL-3A细胞IR模型糖脂代谢及氧化应激的影响,为探讨降脂酮作为治疗胰岛素抵抗的T2DM候选药提供实验基础。
1 材料与方法
1.1 细胞与试剂
BRL-3A细胞为大鼠肝细胞系,购自中国科学院上海细胞生物学研究所。RMPI-1640培养基购自美国Gibco公司,MTT购自Amresco公司,DMSO、PA、DCFH-DA购自Sigma公司,JZT由中国科学院化学研究所自由基研究室提供,新生牛血清购自杭州四季青生物工程材料有限公司,胰蛋白酶和BSA购自西安国安生物科技有限公司,BCA蛋白定量分析试剂盒购自Thermo公司,葡萄糖测定试剂盒购自北京普利莱基因技术有限公司,甘油三酯(TG)测试盒、微量还原性谷胱甘肽(GSH)测试盒、高密度脂蛋白胆固醇(HDL-C)测试盒、低密度脂蛋白胆固醇(LDL-C)测试盒、丙二醛(MDA)测试盒、过氧化氢酶(CAT)测试盒、总抗氧化能力(T-AOC)测试盒、总胆固醇(TC)测试盒均购自南京建成生物工程研究所。其余常规试剂均为国产分析纯。
1.2 主要仪器
医用型洁净工作台(SW-CJ,苏州安泰空气技术有限公司);CO2培养箱(Thermo公司);倒置荧光显微镜(Olympus公司),全波段酶标仪(Infinite 200 PRO);全自动高速冷冻离心机(Sigma公司),流式细胞仪(BD Accuri C6)。
1.3 方法
1.3.1 细胞培养与分组当处于对数生长期BRL-3A肝细胞汇合度超过90%时,胰酶消化离心后弃去上清液将细胞收集,加入完全培养基重悬成单细胞悬液。调整细胞浓度约为1×105/mL,将细胞接种于微孔板,接种量为每孔100 μL/孔(96孔板)和500 μL/孔(96孔板)。在37℃恒温、饱和湿度、CO2体积分数为5%的培养箱中培养12 h,观察细胞汇合度超过80%时按实验分组处理。观察微孔板细胞处于对数生长期,用PBS溶液洗涤3次后,施加以下处理因素,置于37℃培养箱不同时间后实验。对照组加入无血清RPMI-1640培养液;PA组100μmol/L PA培养12 h;JZT组用JZT预处理后,换用100μmol/L PA培养12 h。以上每组均设复孔,重复3次。
1.3.2 MTT法检测细胞活力MTT(5 mg/mL)储备液解冻后,将MTT储备液:RPMI-1640培养液按1∶9比例稀释成MTT工作液。细胞经处理完毕后,每孔加入MTT工作液200μL,置于37℃培养箱继续孵育4 h。终止孵育,吸弃孔内上清液,每孔加入150μL DMSO,振荡溶解紫色结晶3 min。酶标仪上测定各孔490 nm波长处吸光度D(490)值。按下式计算处理组细胞相对生存率:
处理组细胞相对生存率=D(490)处理组/D(490)对照组×100%
1.3.3 糖代谢指标测定具体操作步骤参照参考文献[4]。
1.3.4 脂代谢指标测定TG、TC、HDL-C、LDL-C测定按试剂盒说明书操作。酶标仪上测定500 nm波长处吸光度D(500)值,按下式计算各指标含量(以TG为例):

1.3.5 DCFH-DA荧光探针检测细胞内ROS6孔板中细胞按实验分组处理后,吸弃孔内培养液,避光加入DCFH-DA(10μmol/L,每孔1 mL),于37℃培养箱中孵育30 min。PBS溶液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。胰酶消化离心收集细胞,PBS溶液洗涤,离心收集细胞沉淀。加入PBS溶液1 mL重悬成单细胞悬液,置于流式细胞仪检测(EX 488 nm,EM 530 nm)。数据获取和分析采用CFlowPlus软件。
1.3.6 氧化还原指标测定MDA、T-AOC、CAT、GSH测定按试剂盒说明书操作。酶标仪测定各孔及空白孔吸光度D(520)值。按下式计算各指标含量(以MDA为例):

1.4 统计学方法
采用SPSS 21.0软件对数据进行统计学分析,数据用xˉ±s表示,多组间均数比较采用单因素方差分析(one-way ANOVA analysis),并用LSD-t检验进行两两比较。以α=0.05为检验水准。
2 结果
2.1 降脂酮对BRL-3A细胞生存率的影响
2.1.1 高浓度降脂酮降低BRL-3A细胞的生存率MTT实验结果见图1,降脂酮对BRL-3A细胞生存率影响呈时间-效应和剂量-效应关系。25 mg/mL降脂酮作用于BRL-3A细胞12或24 h,细胞生存率与对照组相比显著降低(P<0.05)。因此,作为改善IR、治疗T2DM候选药物,筛选时应选择0.062 5~1 mg/mL作用1、2 h。
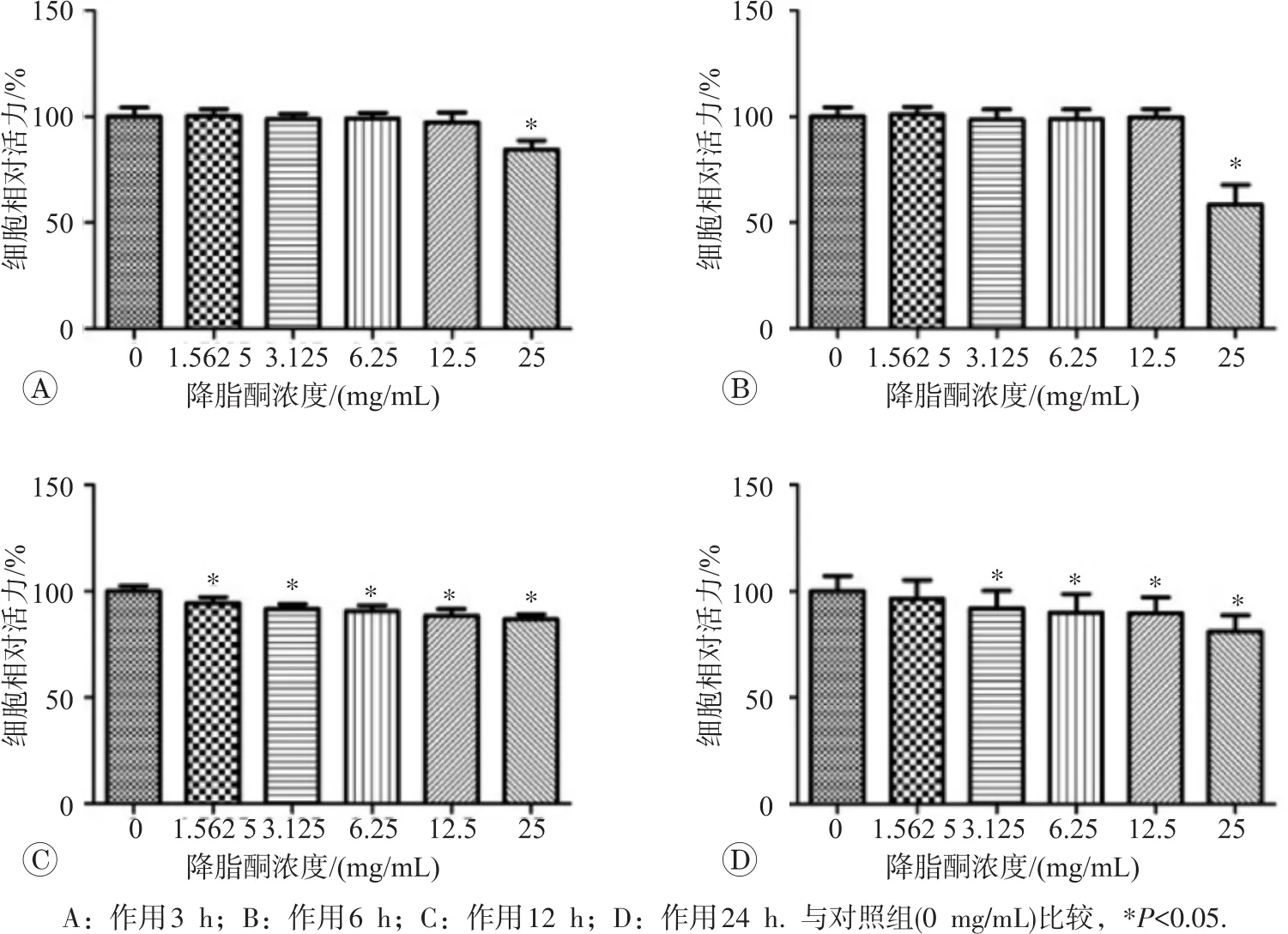
图1 1.562 5~25 mg/mL降脂酮对BRL-3A细胞相对生存率的影响
2.1.2 低浓度降脂酮对BRL-3A细胞生存率无明显影响MTT实验结果见图2,低浓度降脂酮相对于高浓度组,对BRL-3A细胞生存率影响较小,0.062 5~1 mg/mL作用1、2 h对BRL-3A细胞生存率无明显影响 (P>0.05)。作用6、12 h还可轻度增加细胞生存率,而在长时间(24 h)作用后细胞生存率比对照组降低(P<0.05),为避免药物对细胞的增殖和抑制作用对后续检测指标造成偏倚,选0.062 5~1 mg/mL作用1、2 h为药物实验条件。
2.2 降脂酮增加IR模型细胞的糖代谢水平
2.2.1 高浓度降脂酮增加IR模型细胞的基础葡萄糖消耗因降脂酮作用3、6、12、24 h对BRL-3A细胞生存率有影响,故选取0.5、1、2 h进行预处理。结果(图3)显示,较高浓度(0.625~10 mg/mL)降脂酮预处理不同时间(0.5、1、2 h)细胞葡萄糖摄取能力,与模型组相比均明显改善(P<0.05),且与对照组相当(P>0.05)。
2.2.2 低浓度降脂酮增加IR模型细胞的基础葡萄糖消耗采用低浓度(0.062 5~1 mg/mL)降脂酮预处理0.5、1、2 h后造模检测葡萄糖消耗结果见图4,降脂酮预处理0.5 h未改善模型细胞葡萄糖摄取能力,而预处理1、2 h均可改善模型细胞葡萄糖摄取能力(P<0.05),其中1 h改善效果最明显。故此后均采用1 h预处理后造模检测相关指标。
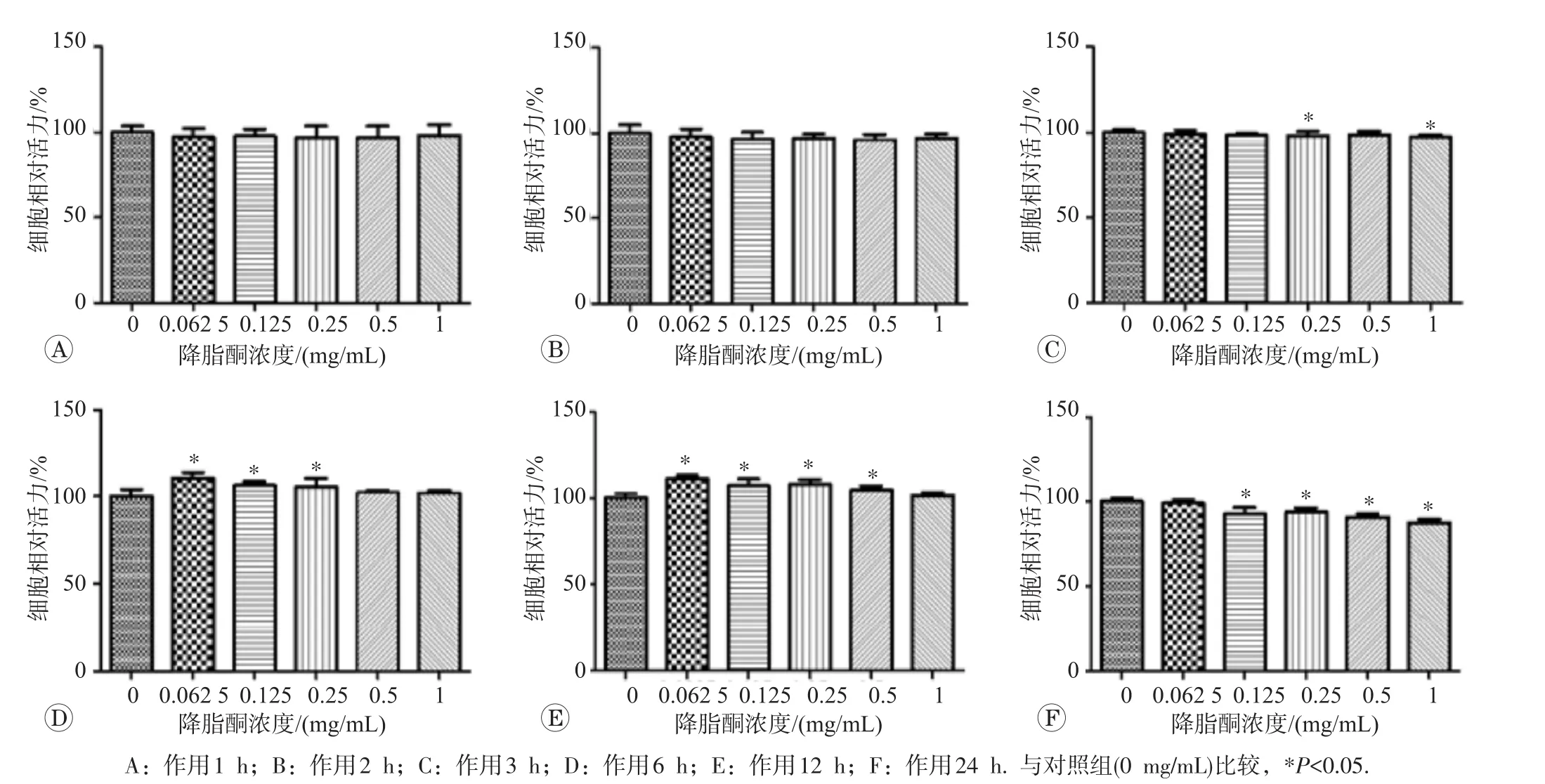
图2 0.062 5~1 mg/mL降脂酮对BRL-3A细胞相对生存率的影响
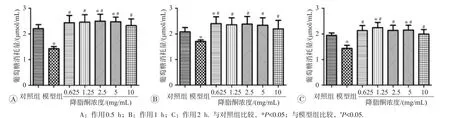
图3 0.625~10 mg/mL降脂酮对IR模型细胞基础葡萄糖消耗的影响

图4 0.0625~1 mg/mL降脂酮对IR模型细胞基础葡萄糖消耗的影响
2.3 降脂酮改善IR模型细胞的脂代谢水平
2.3.1 降脂酮降低IR模型细胞的TG含量培养液中TG含量检测结果如图5A所示,与对照组(0.018 mmol/L)相比,模型组细胞的培养液中TG含量(0.059 mmol/L)明显增加(P<0.05)。用降脂酮预处理后有所降低(0.034、0.034、0.035、0.030 mmol/L),与对照组相比无统计学差异(P>0.05)。细胞中TG含量检测结果如图5B所示,与对照组(0.808 nmol/mg)相比,模型组细胞TG含量(1.805 nmol/mg)明显增高(P<0.05)。各剂量降脂酮预处理组细胞内TG含量明显降低(0.539、0.534、0.459、0.407 nmol/mg,P<0.05)。因此,降脂酮可改善PA导致的BRL-3A细胞内外TG代谢紊乱,减轻细胞IR。
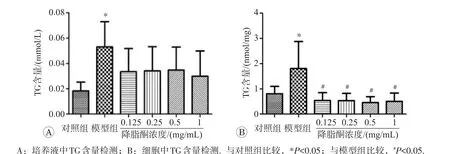
图5 降脂酮对IR模型BRL-3A型细胞TG含量的影响
2.3.2 降脂酮降低IR模型细胞的TC含量培养液中TC含量检测结果如图6A所示,与对照组(0.110 mmol/L)相比,模型组及降脂酮组BRL-3A细胞模的培养液中TC含量(0.096、0.105、0.109、0.098、0.100 mmol/L,P>0.05)无明显变化。细胞中TC含量检测结果如图6B所示,与对照组(0.680 nmol/mg)相比,模型组细胞TC含量(1.249 nmol/mg)明显增加(P<0.05)。各剂量降脂酮组预处理后细胞内TG含量明显降低(0.521、0.463、0.261、0.359 nmol/mg,P<0.05)。因此,降脂酮可改善PA导致的BRL-3A细胞TC代谢紊乱,减轻细胞IR。
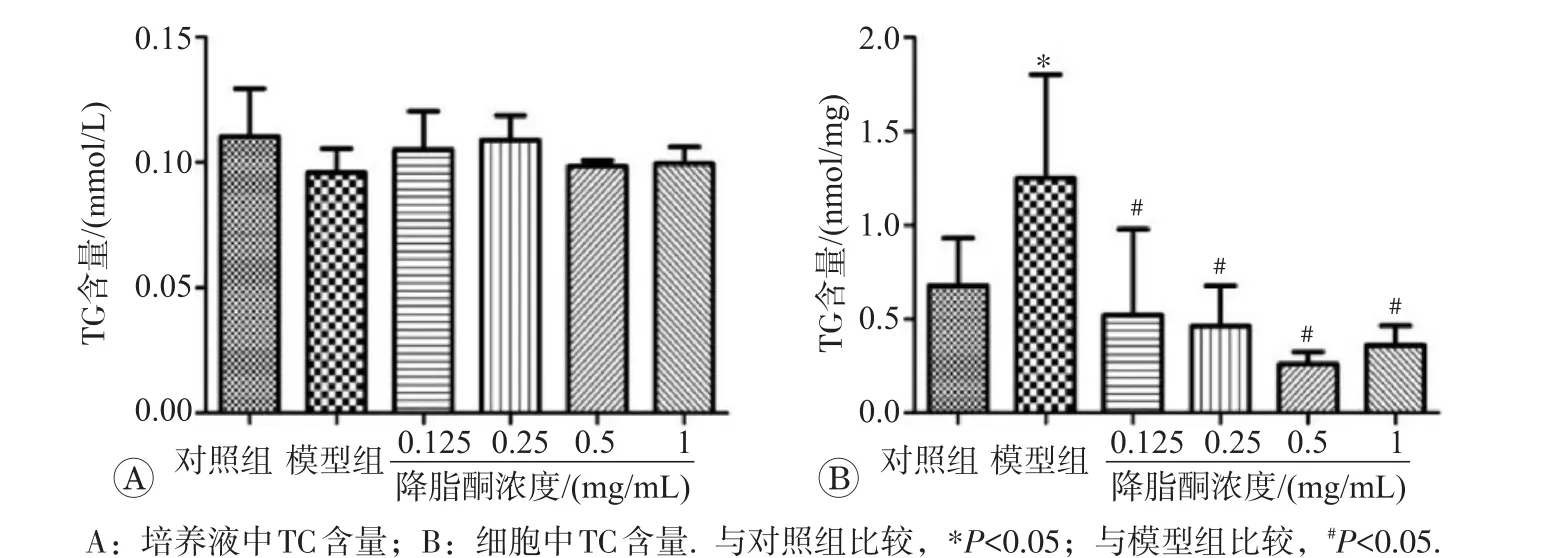
图6 降脂酮对IR模型细胞TC含量的影响
2.3.3 降脂酮增加IR模型细胞HDL-C含量和降低LDL-C含量HDL-C检测结果如图7A所示,与对照组(0.193 nmol/mg)相比,模型组细胞中HDL-C含量(0.020 nmol/mg)明显降低(P<0.05)。用降脂酮预处理后,随着浓度加大,细胞HDL-C含量逐渐增高(0.024、0.038、0.108 nmol/mg),呈现明显的剂量-效应关系。1 mg/mL降脂酮预处理细胞后,其HDL-C水平达到最高(0.172 nmol/mg),与模型组相比有统计学差异(P<0.05),与对照组相比差异无统计学意义(P>0.05)。提示降脂酮可改善PA导致的BRL-3A细胞HDL-C水平降低,使得细胞逆向胆固醇转运能力增强,从而改善细胞IR。
细胞中LDL-C含量检测结果如图7B所示,与对照组(0.186 nmol/mg)相比,模型组细胞中LDL-C含量(0.947 nmol/mg)明显增加(P<0.05)。在加用降脂酮预处理后,随着浓度加大,细胞中LDL-C含量逐渐降低(0.704、0.533、0.639 nmol/mg),呈现明显的剂量-效应关系。在1 mg/mL降脂酮预处理细胞后,其LDL-C水平达到最低(0.185 nmol/mg),与模型组相比有统计学差异(P<0.05),与对照组相比差异无统计学意义(P>0.05)。表明降脂酮可改善PA导致的BRL-3A细胞LDL-C含量升高,从而改善细胞IR。
2.4 降脂酮改善IR模型细胞的氧化应激水平
2.4.1 降脂酮降低IR模型细胞的ROS水平与对照组相比,模型组细胞内ROS峰值发生右移,从对照组的50%依次升高至68.4%,在降脂酮预处理后ROS升高的细胞比例逐渐下降(67.5%、67.5%、62.1%、61.7%)。分析荧光强度发现,模型组相对荧光度与对照组相比明显增加(P<0.05),小剂量降脂酮(0.125 mg/mL)未降低PA导致细胞ROS水平升高。随降脂酮浓度增加,细胞内ROS水平逐渐下降,虽相对荧光度仍较高,但与对照组相比已无统计学差异(图8)。因此,降脂酮可降低PA导致的BRL-3A细胞内ROS水平升高,改善了细胞的氧化应激损伤程度,且存在剂量-效应关系。
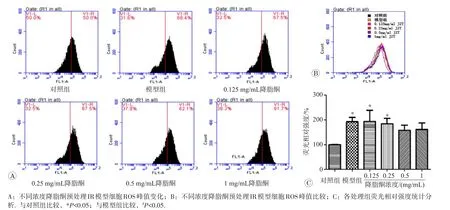
图8 降脂酮对IR模型细胞ROS水平的影响
2.4.2 降脂酮降低IR模型细胞的MDA含量、CAT活性和GSH含量细胞MDA含量检测结果如图9A所示,与对照组(0.27 nmol/mg)相比,模型组细胞内MDA含量明显增高(2.63 nmol/mg,P<0.05)。用降脂酮预处理后细胞MDA含量明显下降(0.63、0.77、0.87、0.50 nmol/mg,P<0.05)。因此,降脂酮可减少PA导致的BRL-3A细胞内MDA含量增高,降低了脂质过氧化程度,进一步验证了降脂酮可减轻PA对细胞造成的氧化应激损伤。
CAT活性检测结果如图9B所示,与对照组(2.08 U/mL)相比,模型组CAT活性(0.30 U/mL)明显降低(P<0.05),用降脂酮预处理后细胞CAT活性明显改善(0.85、0.91、1.14、1.74 U/mL,P<0.05)。因此,降脂酮可改善IR引起的CAT活性下降,恢复细胞清除羟自由基(·OH)的能力,减轻细胞氧化应激损伤,进而保护细胞内环境稳定和细胞的正常代谢。GSH检测结果如图9C所示,与对照组相比,模型组及降脂酮组BRL-3A细胞内GSH含量均无明显变化(P>0.05)。
2.4.3 降脂酮增强IR模型细胞的T-AOCT-AOC检测结果如图10所示,与对照组相比,模型组细胞内及培养液T-AOC均明显下降(P<0.05),用降脂酮预处理后细胞内及培养液T-AOC明显改善(P<0.05)。因此,IR可产生细胞及外环境总抗氧化能力下降,降脂酮可改善此过程,减轻细胞氧化应激损伤。

图9 降脂酮对IR模型细胞MDA含量、CAT活性和GSH含量的影响
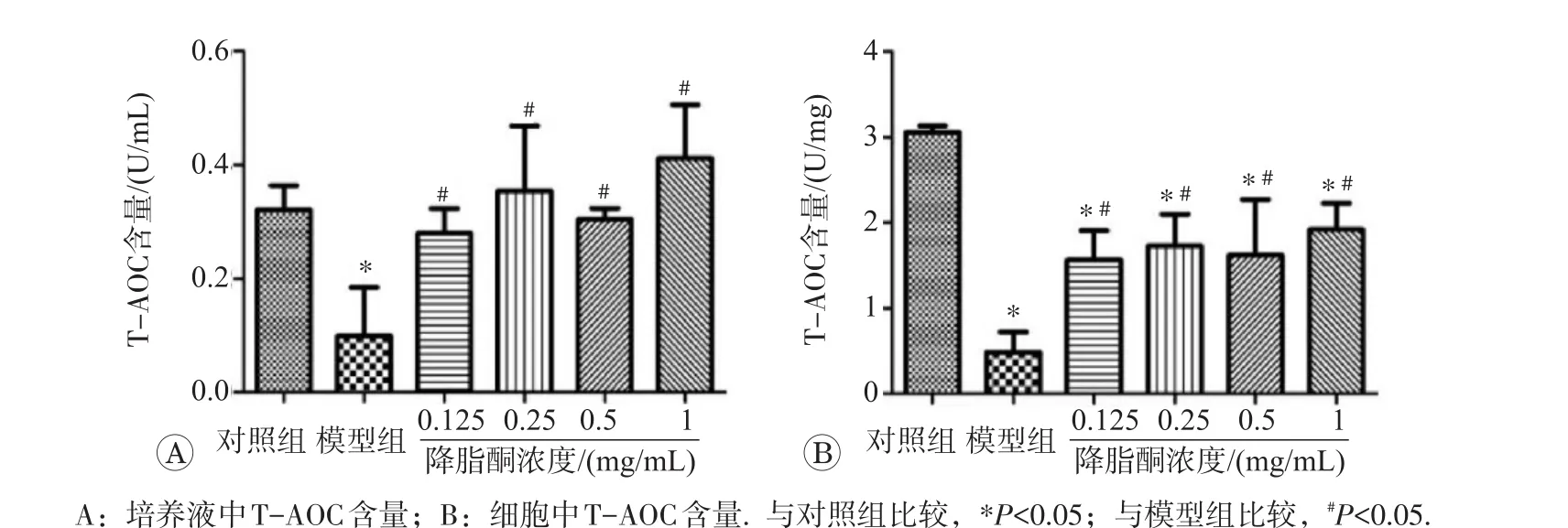
图10 降脂酮对IR模型细胞T-AOC的影响
3 讨论
血浆中胆固醇主要以LDL-C形式存在,被氧化修饰后(Ox-LDL-C)沉积于血管内壁是导致动脉粥样硬化的主因之一[5]。肝脏作为机体代谢中心是调控TG、TC、HDL-C、LDL-C等脂类物质代谢的关键器官,生物体内LDL-C绝大部分由肝细胞通过LDL-R途径清除[6],而高脂条件肝组织中LDL-R的mRNA表达降低。研究发现许多黄酮类如小檗碱[7]、葛根素可以促进肝脏LDL-R的mRNA和蛋白表达,从而有效降低血脂,减少罹患动脉粥样硬化风险。中药槐角含有多种黄酮及异黄酮类成分,由此制成的中药复合制剂-槐角颗粒在临床上可较好地控制高脂血症[8]。降脂酮是槐角经乙醇提取后用大孔吸附树脂法分离得到的总黄酮有效部位制剂,槐角总黄酮含量达60%以上[9],体内研究发现其有较好降低脂肪和类脂效果,但在体外及IR中的效果尚无研究。
本实验结果表明,降脂酮对细胞生存率的影响呈时间-效应和剂量-效应关系。综合考虑MTT结果选取小剂量短时间预处理后,检测基础葡萄糖消耗发现,各剂量降脂酮组的摄糖能力较模型组明显改善,说明降脂酮可改善细胞糖代谢,减轻IR。脂代谢指标结果显示,模型组与对照组相比,培养液及细胞内TG水平明显增高,降脂酮处理后TG水平均明显下降,细胞中TG水平下降程度有统计学差异。在TC水平上,培养液中各组无差异,在细胞中,各剂量降脂酮组明显降低了PA导致的TC水平升高。另外模型组细胞中,促进胆固醇酯逆向转运的HDL-C水平明显下降,而动脉粥样硬化相关指标LDL-C水平则明显增高。各剂量降脂酮组则能明显改善以上两项指标,并可使之达到对照组水平。说明降脂酮改善TG、TC、HDLC、LDL-C作用均较强,其中,中剂量组和高剂量组的效果尤为明显。因此降脂酮可改善IR模型BRL-3A细胞的糖脂代谢,减轻IR。
ROS在IR的发生发展过程中起着至关重要的作用,槐角中富含黄酮类物质在结构上多具有酚羟基和羟基,具有较强的抗氧化活性。实验表明,高脂产生的IR会使细胞ROS水平升高,而各剂量降脂酮组较模型组降低,说明降脂酮有减轻氧化应激损伤作用。MDA含量反映了脂质过氧化程度,降脂酮可降低PA导致的BRL-3A细胞内MDA水平增高,降低了脂质过氧化,进一步验证了降脂酮可降低细胞的氧化应激损伤程度。CAT、T-AOC反映了细胞的抗氧化能力,间接反应肝细胞损伤程度。IR模型组细胞中二者均明显降低,用降脂酮后二者能力均明显增强,尤以中高剂量组效果最为明显。GSH在模型组及降脂酮组中均无明显变化。总之,降脂酮通过调节细胞氧化应激程度途径改变糖脂水平,从而改善IR,且此途径很可能是通过酶促体系完成的。.
近年来由于科学研究发现脂肪在脂代谢、脂肪因子及激素方面的特殊作用,倾向于将其归类于内分泌器官[1,10-14]。其在IR的发生发展中居于核心地位,而氧化应激又是其中的关键一环。选择一种能有效调节氧化应激,改善糖脂代谢,同时又能对肝脏这一关键器官具有靶向作用的药物,对于T2DM药物的研发十分重要。中成药在治疗IR及相关疾病方面取得了较大进展。多种中草药及复合制剂均被证明在调节血糖、血脂、减轻IR、调节氧化应激方面有较好疗效。本实验结果显示,降脂酮能有效降低细胞ROS水平,减轻脂质过氧化程度,提高细胞抗氧化能力,从而减轻氧化应激损伤,恢复氧化与抗氧化平衡。并能够降低肝细胞脂类(TG、TC、LDL-C)水平,提高胆固醇酯逆向转运能力及葡萄糖摄取能力,从而减轻肝细胞炎性损伤和IR程度,保持肝细胞的结构和功能。
因此,降脂酮同时具有保肝、降糖、降脂、抗氧化、减轻IR等多重效应,其作用机制可能是:抑制ROS生成、脂质过氧化和提高抗氧化能力,调节脂代谢,减轻游离脂肪酸毒性作用,从而恢复细胞糖代谢,改善IR。降脂酮的作用机制及其能否作为治疗T2DM的候选药物还需要进一步研究。
