多溴联苯醚BDE-3、BDE-47和BDE-209的体外遗传毒性评价
2020-02-12曹易懿刘维映尤馨悦陈瑞雪张新宇
曹易懿,刘维映,尤馨悦,奚 晶,陈瑞雪,张新宇,栾 洋
(上海交通大学医学院公共卫生学院/虹桥国际医学研究院,上海 200025)
20世纪70年代,多溴联苯醚(polybrominated diphenyl ethers,PBDEs)因其优良的阻燃效果开始被广泛用于建筑、电器、化工、纺织等领域。全球PBDEs生产量迅速上升,我国更是每年数万吨的生产和消费大国。PBDEs及含有PBDEs的制品在其生产、使用和废弃过程中都会释放到环境中,在大气、水体、土壤蓄积,甚至目前可在室内灰尘中检测到约57~80 ng/g(灰尘)的PBDEs混合物[1-2]。PBDEs因具有较强的亲脂性,易于在生物体内富集,并沿食物链逐级放大,国内外均已有研究显示在人体血液、乳汁等生物样本中检测出PBDEs[3-4]。现有报道PBDEs除了具有内分泌干扰作用、生殖发育毒性和神经毒性外[5-7],流行病学资料显示可能与乳腺癌、甲状腺癌等也有相关性[8-9]。因此,PBDEs对人类健康的影响已经引起了全球广泛关注。2009年的《斯德哥尔摩公约》将PBDEs认定为新型持久性有机污染物,四、五、六和七溴联苯醚列入禁止生产和使用的化合物名单,并在2017年限制了BDE-209的使用范围[10]。
世界卫生组织(World Health Organization,WHO)和美国国家毒理学计划(National Toxicology Program,NTP)报告显示,十溴联苯醚(decabromodiphenyl ether,BDE-209)、DE-71[含有2,2′,4,4′-四溴联苯醚(2,2′,4,4′-tetrabromodiphenyl ether,BDE-47)的商用PBDEs的混合物]均能引起大、小鼠肝癌发病率升高,提示对人类具有潜在致癌风险[11-12]。现有PBDEs的致癌实验数据仍不充分,体内外遗传毒性试验结果也不一致,PBDEs可能致癌的机制尚未阐明[13-16]。因此,我们应用TK6细胞进行体外碱性彗星试验,体外胞质分裂阻滞微核细胞组学试验和TK基因突变试验来考察PBDEs的遗传毒性。
PBDEs是多卤代芳烃家族成员之一,根据分子中所含溴原子的数量不同将PBDEs分为10个同系组,一共209同系物。环境中各种PBDEs在不断蓄积的同时也发生着降解,可发生还原反应脱溴,生成低溴代联苯醚。4-溴联苯醚(4-bromodiphenyl ether,BDE-3)不仅是一溴代的同系物,同样也是高溴代联苯醚光降解的终产物[17-18]。目前,仅有高溴代联苯醚BDE-209可以在全球范围继续限制性使用。四溴联苯醚BDE-47相比其他同系物具有相对较强的毒性[19],而环境中大约有2%的BDE-47却来源于BDE-209的降解[20]。即使大多数的PBDEs已经禁用,但仍能从已生产和使用的产品中不断释放进入环境。环境和生物体内BDE-47相比过去已有下降趋势,但仍是在乳汁、血清等生物样本中含量最高的[4]。因此,我们选择BDE-3、BDE-47和BDE-209作为代表性的高溴代和低溴代的PBDEs进行研究。通过检测包括DNA损伤、染色体异常和基因突变的多遗传学终点的实验组合系统性考察BDE-3、BDE-47和BDE-209的体外遗传毒性,为明确PBDEs是否是遗传毒性致癌物提供参考依据。
1 材料与方法
1.1 受试物
BDE-3(CAS号101-55-3)和BDE-209(CAS号1163-19-5)均购自Sigma-Aldrich公司。BDE-47(CAS号5436-43-1)购自美国Matrix Scientific公司。
1.2 阳性对照品
喜树碱(camptothecin,CPT)购自梯希爱(TCI,上海)化成工业发展有限公司,终浓度10μmol/L。丝裂霉素C(mitomycin C,MMC)购自Roche公司,终浓度1.5μmol/L。4-硝基喹啉-N-氧化物(4-nitroquinoline-N-oxide,4-NQO)购自Sigma-Aldrich公司,终浓度1 μmol/L。
1.3 细胞培养和分组处理
TK6细胞由日本国立医药品食品卫生研究所遗传毒理部赠送,采用含10%马血清(Gibco公司)、200μg/mL丙酮酸钠、100 U/mL青霉素和100 g/mL链霉素的RPMI 1640培养基,在37℃、CO2体积分数为5%、饱和湿度条件下做常规悬浮培养,细胞密度维持在(2.0~10.0)×105个/mL。
使用二甲亚砜(DMSO,购自Sigma-Aldrich公司)配制不同浓度的BDE-3、BDE-47和BDE-209。DMSO在细胞培养液中的终浓度为0.5%(V/V)。通过预试验测定细胞相对悬浮增长率选择产生合适的细胞毒性剂量进行实验。根据经济合作与发展组织(Organisation for Economic Co-operation and Development,OECD)指导原则(test guideline,487和490)要求选择的毒性剂量尽量覆盖到较高细胞毒性剂量[即产生(55±5)%的细胞毒性]到无细胞毒性或者低细胞毒性剂量[21]。BDE-209在>120μmol/L剂量下已有沉淀产生,但未观察到细胞毒性,为了尽可能覆盖到较高的细胞毒性,故在有沉淀剂量下设定剂量。每种PBDEs均设定5个剂量组,BDE-3为60、90、120、180和240 μmol/L;BDE-47为 60、120、180、200 和 240 μmol/L;BDE-209 为24、40、120、180和240μmol/L,同时设阴性对照组均加入0.5%的溶媒DMSO,阳性对照组CPT 10 μmol/L(彗星试验),MMC 1.5 μmol/L(微核试验)和4-NQO 1μmol/L(TK基因突变试验)。
调整细胞浓度约为2.0×105个/mL,加入不同浓度的PBDEs。彗星试验和微核试验每个剂量2个复孔。每个复孔处理细胞5 mL,每个剂量分别取2.5 mL加在6孔细胞培养板内,一块用于彗星试验,另一块用于微核试验。在用于微核试验的6孔细胞培养板内加入细胞松弛素B(cytochalasin B),终浓度为3μg/mL。TK基因突变试验每个剂量处理细胞20 mL。每个实验中TK6细胞均与PBDEs共同处理24 h。
1.4 体外碱性彗星试验
先用1%的常熔点琼脂糖凝胶在载玻片上制备第1层胶,55℃烘干后备用。细胞处理24 h后,1 000 r/min离心 5 min离心除去培养液;再用HBSS/EDTA缓冲液离心清洗1次。将细胞悬液与0.7%的低熔点琼脂糖凝胶(按1∶9体积比)混合均匀后铺在第1层胶上,迅速放置于4℃下,待凝固后继续在4℃下裂解1.5 h(细胞裂解液配制:NaCl 81.23 g,EDTA2Na 20.68 g,Tris碱0.67 g,NaOH 4 g,完全溶于水中,调节pH至10.0,定容至500 mL。临用前,在45 mL上述混合液中加入5 mL DMSO和0.5 mL Triton X-100)。然后转移至碱性电泳缓冲液中,静置40 min后在300 mA下电泳20 min。用0.4 mol/L Tris-HCl中和,无水乙醇脱水,干燥后用1μg/mL的DAPI染色10 min,在荧光显微镜(Olympus,IX73)下观察细胞形成的DNA彗星拖尾情况,用COMET IV(Perceptive Instruments,Version 4.3)实时图像测定系统进行分析,每个剂量组分析100个细胞图像(每个复孔分析50个,2个复孔合计分析100个),测定彗星的尾长、尾部DNA百分数和尾矩。计算平均值(xˉ)和标准差(s),用于判定DNA的损伤程度。
1.5 体外胞质分裂阻滞微核细胞组学试验
细胞处理24 h后,1 000 r/min,5 min离心除去培养液,加入3 mL的0.075 mol/L KCl低渗5 min后再加入1 mL的预冷的固定液(V甲醇∶V冰醋酸=3∶1)混匀,离心弃上清。再次加入固定液固定15 min后离心(重复1次),弃上清(留适量液体),重悬混匀后滴片。室温自然干燥后,用PBS配制10%吉姆萨液染色15 min。显微镜观察标本片:①每个剂量组计数500个细胞(每个复孔的标本计数250个,2个复孔合计500个),分别计数单核,双核、三核和四核的细胞数,用于计算各剂量产生的细胞毒性。根据OECD指导原则(test guideline 487)计算公式胞质分裂阻滞增殖指数(cytokinesis-block proliferation index,CBPI)如下。②每个剂量组至少计数2 000个双核细胞中(每个复孔计数1 000个,2个复孔合计2 000个)出现I型微核、II型微核、核质桥及核芽的细胞数,分别计算其发生频率并用以分析造成染色体损伤的机制。核质桥及核芽的界定标准参照文献的方法[22]。微核直径小于主核的1/4为I型微核;直径为主核的1/4~1/2为II型微核。
CBPI指数=(单核细胞数+2×双核细胞数+3×多核细胞数)/总细胞数
细胞毒性/%=[1-(CBPI给药组-1)÷(CBPI对照组-1)]×100%
1.6 TK基因突变试验
参照文献的方法进行实验[23],细胞处理24 h后,1 000 r/min,5 min离心除去培养液。调整细胞浓度,即第0天(Day 0)在96孔板上按约1.6个/孔接种细胞,阴性对照组2块板,其余剂量组和阳性对照组1块板,2周后计数每块细胞板有集落生长的孔数用以测定生存率PE0(plate efficiency,PE)。剩余细胞继续培养72 h(突变表达期,Day 1~Day 3),期间每日计数活细胞浓度,测定细胞相对悬浮增长率(relative suspension growth,RSG),培养到期后,Day 3在96孔板上按约1.6个/孔接种细胞,对照组2块板,其余剂量组和阳性对照组1块板,用于测定生存率(PE3);同时将细胞按4.0×104个/孔接种至含有突变选择剂三氟胸苷(trifluorothymidine,TFT)3μg/mL的96孔板上,进行TFT抗性突变频率(mutation frequency,fM)的测定,阴性对照组4块板,其余剂量组和阳性对照组2块板,2周后计数每块平板有集落生长的孔数(即正常生长的克隆),并计算正常生长克隆突变频率(normally growing mutant,fNM);继续在96孔板每孔补充加入TFT,终浓度为3μg/mL,再培养2周后观察新生的克隆数(即慢速生长的克隆),并计算慢速生长克隆突变频率(slowly growing mutant,fSM);同时计算4周总克隆数的总突变频率(total growing mutant,fTM)。通过PE3和RSG计算相对总增长率(relative total growth,RTG),以RTG为指标考察受试物的细胞毒性。此外通过fNM和fSM分析引起致突变作用的机制。
1.7 统计学方法
彗星试验进行非参数Kruskal-Wallis test检验,并用Dunn"s Multiple Comparison Test进行组间检验。微核试验采用泊松分布检验。TK基因突变试验对fM进行泊松分布检验,考察各个剂量组与阴性对照组相比是否具有差异,以fTM判断受试物是否具有致突变作用;并采用Pearson Product-moment Correlation判断fM的升高是否具有剂量依赖性。
2 结果
2.1 体外碱性彗星试验结果
不同剂量BDE-3、BDE-47和BDE-209处理TK6细胞后的体外碱性彗星试验(见表1),结果显示BDE-3、BDE-47和BDE-209的各个剂量组与阴性对照组相比,均未引起TK6细胞彗星的尾长、尾部DNA百分数和尾矩的增加,表明未对TK6细胞造成DNA链断裂。
2.2 体外胞质阻滞微核细胞组学试验结果
见表2。结果表明:BDE-3、BDE-47和BDE-209在各剂量下未对TK6细胞产生严重的细胞毒性,在各剂量下均未引起TK6细胞的微核率、核质桥率和核芽率升高,且不具有剂量依赖性升高趋势(P>0.05)。
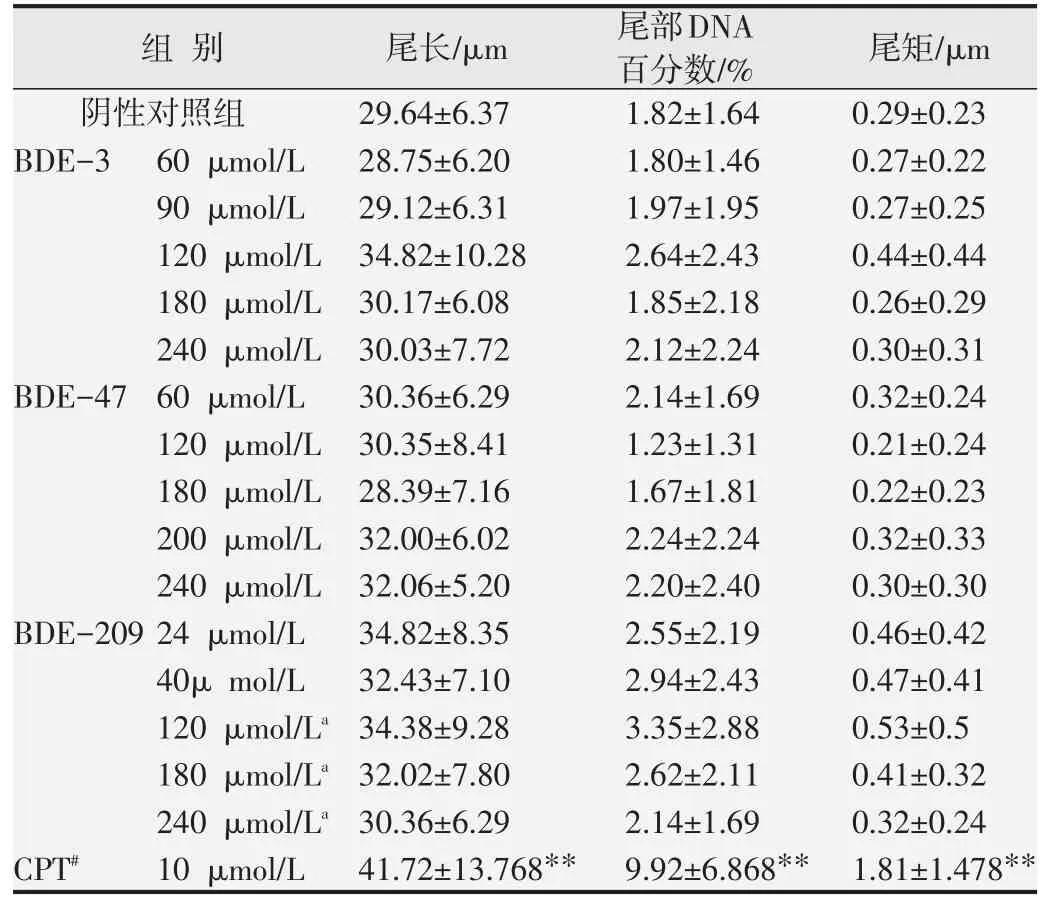
表1 不同剂量BDE-3、BDE-47和BDE-209处理TK6细胞后的体外碱性彗星试验结果(x±s)
2.3 TK基因突变试验结果
见图1。BDE-3、BDE-47和BDE-209在各剂量下的RTG均未有低于10%,表明未对TK6细胞产生严重的细胞毒性。阴性对照组的fTM为8.3×10-6,阳性对照4-NQO的fTM为88.2×10-6,符合文献要求[24]。与阴性对照组相比,BDE-3在120、180和240μmol/L剂量下fTM为对照组的1.7、1.8和4.3倍;BDE-47在180、200和240μmol/L剂量下fTM为对照组的3.0、5.1和2.7倍;BDE-209在120、180和240μmol/L剂量下fTM为对照组的1.7、1.8和2.7倍;分别与阴性对照组的fTM进行泊松分布检验,差异均具有统计学意义(P<0.05),Pearson Product-moment Correlation检验表明fM具有剂量-效应关系(相关系数R2BDE-3=0.85,P=0.0085;R2BDE-47=0.85,P=0.0255;R2BDE-209=0.90,P=0.0036)。阴性对照组的fNM为 5.0×10-6,fSM为2.6×10-6;与阴性对照组相比,BDE-3在120、180和240μmol/L剂量下fNM(fSM)为阴性对照组的1.2(2.5)、1.5(2.2)和3.1(6.2)倍;BDE-47在180、200和240μmol/L剂量下fNM(fSM)为阴性对照组的 2.0(4.5)、4.1(6.1)和 4.3(0.2)倍;BDE-209 在 120、180和240μmol/L剂量下fNM(fSM)为阴性对照组的1.7(1.5)、2.1(1.3)和 3.1(1.8)倍。

表2 不同剂量BDE-3、BDE-47和BDE-209处理TK6细胞后的体外胞质阻滞微核细胞组学试验结果

图1 不同剂量BDE-3、BDE-47和BDE-209处理TK6细胞后的TK基因突变试验结果
3 讨论
本研究中BDE-3、BDE-47和BDE-209均能引起TK6细胞TK基因突变频率升高,其中BDE-47突变频率升高倍数大于BDE-3和BDE-209,表明3种PBDEs对TK6细胞均具有致突变作用,且致突变作用BDE-47强于BDE-3和BDE-209。同时测定的各剂量下RTG均>10%,表明没有因严重的细胞毒性而产生突变频率升高的假阳性结果。通过fSM和fNM与阴性对照相比升高的倍数,我们发现BDE-3的fSM升高倍数相对较大,BDE-209而是fNM升高倍数相对较大,BDE-47的fSM和fNM相对阴性对照组均有明显升高。正常生长的突变克隆表明受试物主要造成的是点突变,所以在培养2周后即可肉眼观察到;而慢速生长的突变克隆表明受试物造成了与生长相关基因的损伤,导致克隆生长缓慢,在培养4周后才能肉眼观察到,所以fSM高表明受试物主要引起DNA大片的缺失或者发生了染色体畸变[23,25-26]。因此TK基因突变试验结果提示,3种PBDEs引起TK6细胞基因突变的机制并不相同,BDE-209以点突变为主,BDE-3以DNA大片段缺失为主,BDE-47则两种致突变机制均有。
近年来,PBDEs的遗传学损伤效应引起广泛关注,较多体外研究显示BDE-3/BDE-47能引起细胞单/双DNA链断裂,但不一定能引起细胞微核率升高或基因突变[13,15,19]。本研究中体外彗星试验和微核试验结果显示BDE-3、BDE-47和BDE-209在各剂量下均未引起TK6细胞的DNA损伤以及微核率、核质桥率和核芽率升高,表明3种PBDEs未引起TK6细胞染色体损伤和DNA链断裂,我们认为可能与不同细胞系处理后产生的细胞毒性相关。我们采用CBPI指数观察细胞经过1~1.5个细胞周期后细胞核分裂的情况,更客观评价了细胞毒性,避免了过高的细胞毒性产生体外实验假阳性结果。此外,比较TK基因突变试验的RTG值和体外微核试验的CBPI值,显示BDE-209的细胞毒性小于BDE-3和BDE-47,提示高溴代的联苯醚毒性小于低溴代联苯醚。我们认为可能是由于低溴代联苯醚的细胞跨膜转运能力强于高溴代联苯醚造成的[27]。BDE-209是一种高溴代联苯醚,含有10个溴原子,使其具有高分子量的疏水性,其渗透生物膜发挥其生物活性的能力可能受到影响,因而具有较小的细胞毒性和较弱的致突变能力。
目前有报道提示混合功能氧化酶系统可能介导PBDEs的致癌效应,使PBDEs具有亲电子性,导致毒性增强,成为致突变物或终致癌物。如,BDE-47和BDE-209可通过孕烷X受体激活诱导小鼠体内CYP3A11和CYP2B10表达升高[28];四溴联苯醚(BDE-47和BDE-77)诱导乙氧基异吩噁唑—O—脱乙基酶(EROD)升高[29-30]。而在我们另一项研究BDE-47的gpt delta转基因小鼠体内实验中显示BDE-47不具有引起外周血红细胞微核率和Pig-a基因突变频率升高的作用,也未引起睾丸和肝脏的gpt基因突变频率升高[16];提示PBDEs毒性作用可能并不需要经过体内代谢活化。因此,在本研究中我们在非代谢活化条件下进行体外细胞实验,验证PBDEs是否是直接致突变物,结果发现3种PBDE对TK6细胞均具有一定的致突变能力。此外,我们认为体外细胞实验即便在合适的细胞毒性剂量范围内仍可能存在一定的假阳性结果,但PBDEs同系物的毒性作用机制不尽相同,BDE-3和BDE-209的体内遗传毒性实验也尚未有报道,所以PBDEs是否是遗传毒性致癌物仍值得关注。为了明确PBDEs的遗传毒性作用机制,本研究结果提示我们需要进一步通过体内实验考察不同的PBDEs的遗传毒性。
综上,在本研究中我们应用了用包括检测DNA损伤、染色体改变和基因突变的体外实验组合系统考察了3种代表性PBDE的遗传毒性,认为这3种PBDE主要引起细胞基因突变,且可能因其溴原子的数量和结构的不同造成细胞毒性差异以及致突变机制的区别,希望能为进一步探讨PBDEs的致癌性机制提供参考依据。
