小胶质细胞活化介导的MMP-9信号通路在电针预处理对MCAO大鼠的脑保护效应中的作用
2020-02-11陈丽莹蒋佩萱徐诗婷罗咿君刘妍张江松赵逸彬王豪林咸明
陈丽莹,蒋佩萱,徐诗婷,罗咿君,刘妍,张江松,赵逸彬,王豪,林咸明
·动物实验·
小胶质细胞活化介导的MMP-9信号通路在电针预处理对MCAO大鼠的脑保护效应中的作用
陈丽莹,蒋佩萱,徐诗婷,罗咿君,刘妍,张江松,赵逸彬,王豪,林咸明
(浙江中医药大学,杭州 310053)
通过观察电针预处理对大脑中动脉栓塞(MCAO)大鼠的脑梗死体积、小胶质细胞的活化和基质金属蛋白酶-9(MMP-9)阳性细胞表达的影响,评价电针预处理对MCAO大鼠的脑保护效应及相关机制。将32只健康雄性SD大鼠随机分为假手术组、模型组、电针预处理组和针刺组,每组8只。取百会、风府穴行电针15 d后,采用Zea Longa改良线栓法复制大鼠大脑MCAO模型。用Longa 4分法和Morris水迷宫进行神经行为学评分及学习和记忆能力的观察,用TTC染色法检测脑梗死体积,并用免疫荧光法检测活化的小胶质细胞、MMP-9的阳性细胞。模型组大鼠脑梗死体积、MMP-9阳性细胞、小胶质细胞活化较假手术组明显增多(<0.01,<0.05),电针预处理组、针刺组较模型组明显减少(<0.01,<0.05)。百会、风府穴电针预处理15 d能减小MCAO大鼠脑梗死体积,减轻学习与记忆能力的丧失,发挥脑保护效应。此效应可能是通过抑制小胶质细胞活化介导的MMP-9信号通路来实现。
针刺疗法;电针预处理;再灌注损伤;脑缺血;小胶质细胞;基质金属蛋白酶-9;大鼠
卒中包括出血性卒中和缺血性卒中,其中缺血性卒中占60%~70%,具有发病率高、病死率高、致残率高、复发率高、合并症多及治愈率低等特点[1],主要的负面影响是降低了患者的日常生活能力和工作学习能力[2-3],给患者家庭及社会带来沉重的负担。目前临床上有各种预防方法(用高压氧、一氧化氮、低氧、低温或中药如地龙和水蛭复方制剂以及针刺等诱导脑缺血耐受以期减少脑缺血性损伤[4-6])和治疗方法(溶栓、抗血小板、抗凝、降纤等),但大部分预防和治疗方法均有较大的局限性,难以直接应用于临床。相比之下,针刺预处理是最佳选择,具有操作简便易行,经济安全有效等优点。大量基础和临床研究表明,针刺预处理具有脑保护效应[6-8]。可见,针刺预处理防治卒中是一个新的切入点,应用于临床的可能性较大。
研究表明,血脑屏障(blood brain barrier, BBB)的损害与多种因素有关,其中与小胶质细胞、基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)关系密切。脑缺血损伤后,小胶质细胞迅速活化,会分泌各种蛋白水解酶和炎性介质[9],如MMP-9、IL-6、IL-1b。其中MMP-9能通过降解紧密连接蛋白、细胞外基质成分参与BBB结构和功能的破坏[10],从而导致了脑损伤。相关研究表明,电针预处理能够明显减轻脑缺血损伤,可以抑制小胶质细胞的活化,减少MMP-9阳性细胞的表达,减小脑梗死体积(%),减轻卒中后学习和记忆能力的损伤[11-13]。而电针预处理是否通过调节小胶质细胞活化介导的MMP-9信号通路而发挥脑保护效应,减小脑梗死体积、减轻卒中后学习和记忆能力的丧失目前尚无报道。本研究拟探讨电针预处理对缺血再灌注后脑梗死体积、小胶质细胞的活化和MMP-9阳性细胞表达的影响,现报道如下。
1 材料与方法
1.1 实验动物与分组
清洁级健康雄性Sprague Dawley(SD)大鼠32只,体质量(250±20)g,上海西普尔-必凯实验动物有限公司提供[实验动物生产许可证号SCXK(沪)2013-0016],常规饮食,饲养环境温度为18℃~22℃。采用查随机数字表法将32只SD大鼠随机分成假手术组、模型组、电针预处理组和针刺组,每组8只。分别进行以下处理,假手术组仅予以颈总动脉分离,不结扎、不插线;模型组采用Zea Longa改良线栓法复制右侧大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型;电针预处理组取百会、风府穴行电针预处理15 d后行右侧MCAO造模;针刺组仅将针灸针刺入穴位,深度和角度同电针预处理组,其余与电针预处理组无异。
1.2 材料与试剂
TTC(T817,Solarbio公司);anti-MMP-9(ET1705- 78,huabio有限公司);anti-iba1(ET1704-69,huabio有限公司);韩氏穴位神经刺激仪(HANS-100A,中国南京济生医疗科技有限公司);冰冻切片机(LeicaCM 1900);激光多普勒组织血流仪(帕瑞医学科技有限公司)。
1.3 预处理方法
取百会、风府穴,定位参照《实验动物穴位图谱》。常规消毒后,采用苏州医疗用品厂有限公司出品的华佗牌0.30 mm×25 mm针灸针进行针刺,刺入穴位后连接韩氏穴位神经刺激仪,设置参数为频率2/15 Hz,电流为2 mA,以肢体轻微抖动为度。每次30 min,每日1次,连续15 d不间断。针刺组仅刺入上述两个穴位但不予通电。
1.4 模型建立
采用Zea Longa改良线栓法复制SD大鼠右侧MCAO模型。术前12 h禁食不禁水,称重,用水合氯醛腹腔麻醉,暴露颞骨,置于激光多普勒血流监测仪下监测脑部即时基础血流。然后将大鼠以仰卧位固定于恒温台,分离右侧颈总动脉、颈外动脉、颈内动脉,将制备好的线栓,经颈总动脉分叉下端进入颈内动脉颅内段,阻断大脑中动脉血流,同时用激光多普勒血流仪监测造模后缺血程度以确定MCAO大鼠造模成功。90 min后再灌注,将栓线提至颈内动脉起始部,剪去大鼠体外的栓线,即恢复大脑中动脉的血流,同时予青霉素钠肌肉注射。假手术组仅分离颈总动脉、颈内动脉、颈外动脉,不结扎及插线。
1.5 MCAO造模质量控制
1.5.1 脑血流
MCAO大鼠造模术前、术中激光多普勒监测大鼠右侧大脑中动脉供血区域血流,若该区域血流量明显降低,下降程度至基础值的(45±10)%[14],则确定MCAO大鼠造模成功。
1.5.2 神经行为学评分
采用Longa的4分法对大鼠的神经功能进行分级评分。大鼠于脑缺血再灌注麻醉清醒后,均出现轻重不等的神经功能缺失体征,0分为无神经功能缺损;1分为悬尾时左前肢屈曲;2分为爬行时向左侧转圈;3分为爬行时出现向左侧倾倒;4分为意识障碍或者死亡。神经行为学评分为1~3分可确定MCAO大鼠造模成功。剔除评分为0分和4分的大鼠。
1.6 空间学习记忆行为学功能
用Morris水迷宫[15]观测MCAO大鼠手术前后的空间学习与记忆能力,各组大鼠于预处理第10—14天进行定位航行实验,即大鼠依次从4个象限面朝池壁进入水中,若大鼠在90 s内找到平台并停留超过5 s,则记录其从入水到爬上平台的时间(即潜伏期);若大鼠在入水后90 s内未能找到平台,则由测试者引至平台,并在平台上停留30 s,潜伏期记为90 s。各组大鼠分别于定位航行试验结束24 h后和造模24 h后进行空间探索实验,即撤除平台,在远离平台象限的固定入水点将大鼠面向池壁放入水中,所有大鼠必须在同一入水点,使其自由游泳90 s,分别记录各组大鼠造模前后空间探索实验中90 s内穿越原平台象限的次数,并进行造模前后自身对照和造模后组间对照。
1.7 动物处死及取材
上述实验完成后,行水合氯醛腹腔麻醉,用生理盐水经左心室灌注,直至流出液为澄清液体。用于TTC染色的操作为,断头取脑,于﹣20℃冰箱中速冻,20 min后置于脑槽中切片。用于免疫荧光染色的操作为,用生理盐水灌注后再推注多聚甲醛溶液,然后滴注多聚甲醛溶液,30 min后进行断头取脑,置于多聚甲醛溶液中固定过夜,然后于蔗糖溶液中梯度脱水,﹣80℃冻存后切片,重点取梗死区及其周围脑组织。
1.8 观察指标及检测方法
1.8.1 脑梗死体积及脑缺血程度
将切片放入TTC染液中,避光,再放入37℃恒温箱30 min,使之均匀染色,染成红色的为正常脑组织,白色为梗死脑组织,将染色的脑片按切片顺序排列,标号、设定标尺并拍照,利用Image-Pro Plus图像处理软件计算脑梗死体积(梗死体积=每个脑片梗死面积×2 mm),每个脑组织梗死的总体积由连续切割的5~6片脑组织的梗死体积相加所得。最后计算出梗死总体积相对于整个大脑体积百分比,以此结果做统计分析。
1.8.2 活化的小胶质细胞和MMP-9阳性细胞数
取玻片复温,抗原修复,PBS洗涤3×10 min,封闭,加入一抗anti-iba1(活化的小胶质细胞的标志物)/ anti-MMP-9,4℃孵育过夜,PBS洗涤5×10 min,加入二抗37℃孵育1 h,PBS洗涤5×10 min,封片。封片后,于共聚焦荧光显微镜下采集图像。
1.9 统计学方法
所有数据采用SPSS16.0软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,组间计量资料比较采用单因素方差分析,方差齐时用检验,方差不齐时用-检验。以<0.05表示差异具有统计学意义。
2 结果
2.1 MCAO造模质量控制
2.1.1 脑血流
MCAO大鼠术前及术中采用激光多普勒监测大鼠脑血流,可见右侧大脑中动脉供血区域血流量明显降低,脑血流下降至基础值的(45±10)%,确定MCAO大鼠造模成功。详见图1、图2。

图1 造模模式图

2.1.2 神经行为学评分
由表1可见,与假手术组相比,各组大鼠神经行为学评分均显著升高(<0.01);与模型组相比,电针预处理组和针刺组神经行为学评分均降低,但差异均无统计学意义(>0.05),这可能与每组大鼠数量较少(每组7~8只)以及可能存在评分的主观因素有关。
2.2 Morris水迷宫
由表2可见,术前各组大鼠穿越原平台象限次数比较,差异均无统计学意义(>0.05)。假手术组大鼠假手术前后穿越原平台象限次数几乎不变(>0.05);其余3组大鼠术后穿越原平台次数比术前明显减少 (<0.05)。与假手术组比较,各组大鼠术后穿越原平台象限次数明显减少(<0.01);与模型组相比,电针预处理组和针刺组大鼠术后穿越原平台象限次数明显增多(<0.05);与针刺组比较,电针预处理组大鼠术后穿越原平台象限次数无明显变化(>0.05)。各组大鼠Morris水迷宫实验结果见图3、图4。
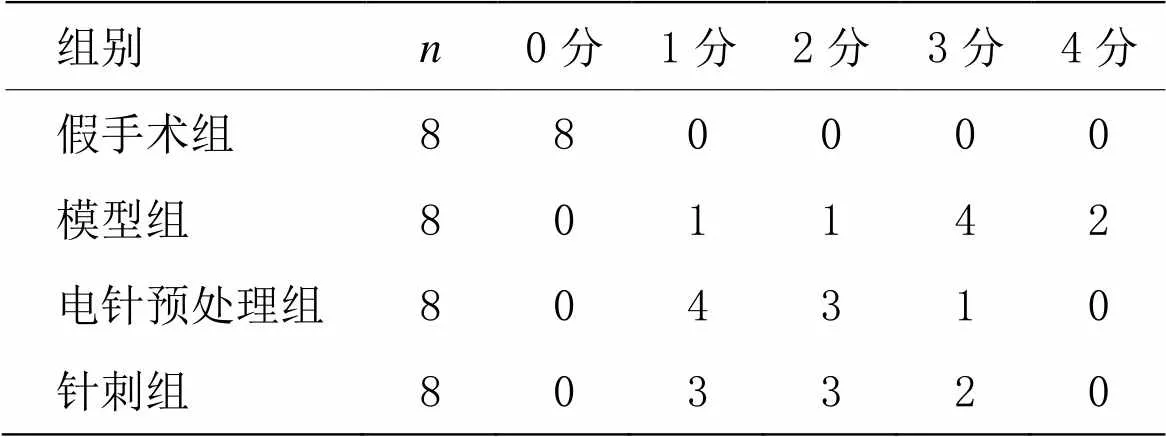
表1 各组大鼠术后神经行为学评分比较 (只)

表2 各组大鼠术前术后空间探索实验中穿越原平台象限次数比较 (±s,次)
注:与术前比较1)<0.05;与假手术组比较2)<0.01;与模型组比较3)<0.05

注:A为假手术组,B为模型组,C为电针预处理组,D为针刺组

注:A为假手术组,B为模型组,C为电针预处理组,D为针刺组
2.3 电针预处理对MCAO大鼠脑梗死体积的影响
由图5可见,假手术组正常脑组织染色为红色,模型组、电针预处理组和针刺组脑组织均可见不同程度苍白色脑组织(梗死灶)。

图5 各组大鼠的脑组织TTC染色
由图6可见,与假手术组相比,各组大鼠脑梗死体积明显增大(<0.05);与模型组相比,电针预处理组和针刺组脑梗死体积明显减小(<0.01);与针刺组比较,电针预处理组脑梗死体积减小不明显(>0.05)。

注:与假手术组比较1)P<0.05;与模型组比较2)P<0.01
2.4 电针预处理对MMP-9阳性细胞表达的影响
MMP-9主要位于梗死区及其周围脑组织中。由图7、图8可见,与假手术组相比,其余各组大鼠梗死周围皮质中MMP-9阳性细胞明显增多(<0.01);与模型组相比,电针预处理组和针刺组大鼠梗死周围皮质中MMP-9阳性细胞明显减少(<0.01);与针刺组比较,电针预处理组大鼠梗死周围皮质中MMP-9阳性细胞减少不明显(>0.05)。
2.5 电针预处理对小胶质细胞活化的影响
活化的小胶质细胞主要位于梗死区及其周围脑组织中。由图9可见,假手术组活化的小胶质细胞数量较少,且形态单一、突触不明显;模型组、电针预处理组、针刺组脑组织均可见大量的活化的小胶质细胞,且形态多样。由图10可见,与假手术组相比,其余各组大鼠活化的小胶质细胞明显增多(<0.01);与模型组相比,电针预处理组和针刺组活化的小胶质细胞明显减少 (<0.01);与针刺组比较,电针预处理组活化的小胶质细胞减少不明显(>0.05)。

图7 各组大鼠梗死周围皮质中MMP-9阳性细胞(×400)

注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01

图9 各组大鼠活化的小胶质细胞(×400)
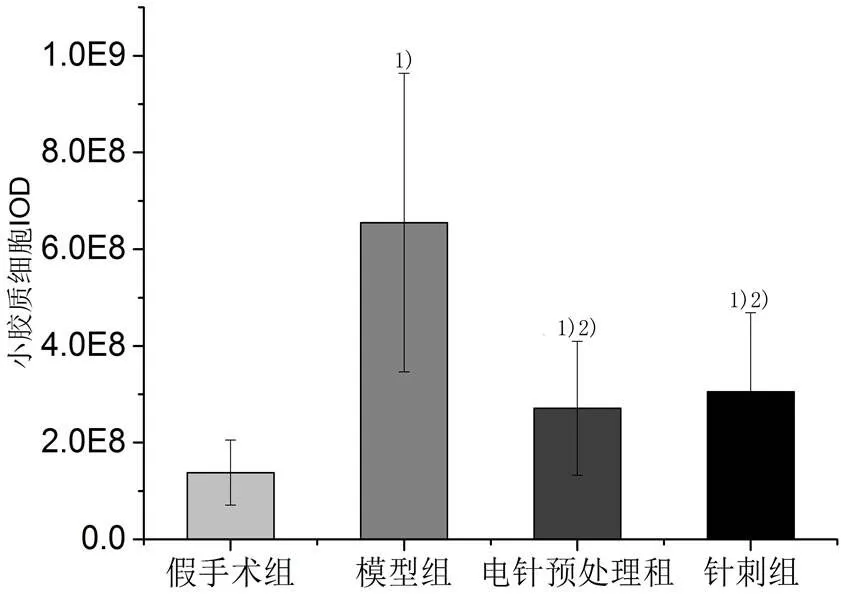
注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01
3 讨论
缺血性卒中多由脑血管血流减少或完全阻塞、脑部血液循环障碍以致脑组织受损而引起的一系列症状,是一个多因素的、复杂的发病过程。大量临床实践证明,一旦发生完全性卒中,虽有较多缺血性脑血管病的治疗方法,但由于我国群众对缺血性卒中早期识别认知度低、农村患者离医院远、院前急救能力不足、院内诊治延误、溶栓时间窗短等因素,导致我国缺血性卒中救治不足及溶栓率低(仅2.5%)[16],且没有完整明确的治疗方案,多数卒中患者治疗效果不能令人满意。因此,对于卒中更应强调“预防为主”的方针,而研究表明,针刺预处理有很好的脑保护效应,对预防缺血性卒中有很好的效果。卒中属中医学“中风”范畴,其病机为各种原因引起气血逆乱,产生风、火、痰、瘀而致脑脉痹阻,窍闭神匿,神不导气,故醒脑开窍针法是其基本疗法[12],且“病变在脑,首取督脉”。本研究针刺督脉上的百会和风府,并接上电针,以加强醒脑开窍的作用。
BBB是维持中枢神经系统内环境稳态的重要结构,脑组织缺血缺氧导致了BBB的初始损伤,再灌注虽可部分逆转脑缺血的级联反应,但BBB会因再灌注损伤机制造成进一步损伤[17]。小胶质细胞是脑内主要的免疫效应细胞。脑缺血后,小胶质细胞可迅速大量活化,形态、大小、功能均发生改变,具有吞噬功能并分泌各种炎症介质[18-21]。活化的小胶质细胞可能通过以下两种途径在脑缺血再灌注损伤过程中发挥重要作用[22-25],①直接与神经细胞接触,发挥吞噬功能造成脑损伤;②进一步释放蛋白水解酶(如MMP-9)和炎性细胞因子(如TNF-a、IL-1b和IL-6),导致继发性脑损伤。小胶质细胞活化后,会启动胞内转录因子(如NF-kB)入核,从而启动下游基因,使之表达,释放与BBB密切相关的基质金属蛋白酶(matrimet allopreinase, MMPs)[26]。在目前已探明的20余种MMPs中,MMP-9与脑微血管损伤关系最为密切[27-29]。MMP-9是一种主要由脑微血管内皮细胞合成分泌的明胶酶,其表达与BBB的损伤密切相关,与兴奋性神经毒性、神经炎症反应密切相关。在脑梗死及炎症反应过程中,MMP-9阳性细胞的表达增多,通过降解脑血管基质的关键成分如紧密连接蛋白,使基膜和紧密连接结构遭到破坏,加重BBB破坏,导致脑水肿和出血性损伤[30-31];MMP-9阳性细胞的表达增多,还会增加缺血半暗带中的神经元损伤,从而增大了脑梗死体积。Lin R等[32]研究发现,电针可以减轻脑缺血对脑超微结构的损伤和抑制BBB中MMP-9阳性细胞的表达来改善学习与记忆能力。可见,MMP-9分泌增加所致的BBB破坏在缺血性卒中的病理变化中起着关键作用,与脑梗死体积大小、神经功能损伤程度、学习与记忆能力的丧失密切相关。因此,在防治缺血性卒中的研究中,下调MMP-9阳性细胞的表达是关键。
本实验通过免疫荧光染色法观察到模型组梗死区及其周围脑组织灰质中活化的小胶质细胞和梗死周围皮质中MMP-9明显增多,其可能的机制为,脑缺血时,梗死区脑组织细胞氧糖剥夺,神经细胞死亡或内源性信号改变,信号的改变激活小胶质细胞;也可能是缺血时神经元去极化,细胞外的高浓度钾离子激活小胶质细胞;亦可能是受损的神经细胞释放细胞因子如白介素4(IL-4)和克隆刺激因子激活小胶质细胞[33-34]。小胶质细胞活化后,启动胞内转录因子(如NF-kB)入核,启动下游基因,使之表达,使活化的小胶质细胞进一步释放蛋白水解酶(如MMP-9)和炎性细胞因子(如TNF-a、IL-1b和IL-6),加重BBB破坏和神经细胞损伤[26]。MMP-9以前酶原形式存在于小胶质细胞内,缺血后、炎症发生时,小胶质细胞中MMP-9阳性细胞表达明显上调[35-38],BBB结构被破坏,发生脑梗死、神经功能损伤、认知功能受损等一系列不良后果。电针预处理组和针刺组活化的小胶质细胞和MMP-9表达明显低于模型组,其可能的机制为电针预处理和针刺预处理均能通过抑制小胶质细胞的活化,降低NF-kB的转录,抑制MMP-9、TNF-a、IL-1b和IL-6等的分泌,从而减轻脑缺血再灌注损伤。
通过Longa 4分法观察到模型组大鼠术后神经行为学评分明显高于假手术组,通过水迷宫实验观察到模型组大鼠在空间探索实验中穿过原平台象限的次数明显低于假手术组,通过TTC染色观察到模型组大鼠脑梗死体积明显大于假手术组,说明脑缺血再灌注会造成严重的损伤,其可能的机制为脑缺血再灌注过程中由于自由基、NO、基质金属蛋白酶、细胞因子、黏附分子、水通道蛋白等物质破坏了BBB的结构和功能,中枢神经系统内环境稳态被打破,从而发生了一系列继发损伤。电针预处理组和针刺组脑缺血再灌注损伤明显轻于模型组,证实电针预处理和针刺预处理均有脑保护效应,其可能的机制为电针预处理和针刺预处理均可通过抑制小胶质细胞的活化,使转录因子NF-kB核移位减少,从而减少MMP-9的分泌,减轻脑缺血再灌注损伤后的炎症反应,对脑组织起保护作用,即电针预处理和针刺预处理均可通过抑制小胶质细胞活化介导的MMP-9信号通路而发挥脑保护效应。
通过以上研究和论述,笔者认为取百会、风府电针预处理可通过抑制小胶质细胞活化介导的MMP-9的信号通路来减轻脑缺血后BBB的破坏程度,保护了BBB结构和功能的相对完整性,从而减轻了脑缺血再灌注损伤,即发挥了脑保护效应。且笔者认为电针预处理的脑保护效应比针刺预处理强,但由于每组大鼠数量有限,差异无统计学意义(>0.05),还需进一步深入研究。本研究注重中医学治未病的思想,采用电针预处理的干预方法来预防缺血性卒中,用科学的数据为中医学治未病提供科学依据,这对日后预防缺血性脑血管病提供了新思路,并可能成为易患缺血性脑血管病的高危人群的预防保健疗法。
[1] 何俐.基层卒中诊治理论与实践[J].中国卒中杂志, 2018,13(6):579.
[2] 王娟,杨玮,周凌艳.节律性运动训练对脑卒中后偏瘫病人日常生活能力、运动功能及生存质量的影响[J].全科护理,2018,16(33):4168-4170.
[3] 张振香,林蓓蕾,刘腊梅,等.社区脑卒中患者生活能力水平及其影响因素[J].中国老年学杂志,2012,32(4): 785-787.
[4] 毕庆国,刘春兰,付建辉,等.rt-PA联合高压氧对大鼠脑缺血再灌注损伤的保护作用及其机制[J].西安交通大学学报(医学版),2016,37(3):372-377.
[5] 林亚平,刘琴,陈楚淘,等.针刺联合亚低温对脑缺血再灌注损伤大鼠脑组织MAPK/ERK通路及凋亡相关因子的影响[J].中南大学学报(医学版),2017,42(4):380- 388.
[6] 叶涛,朱路文,唐强.电针预处理诱导脑缺血耐受的研究进展[J].针灸临床杂志,2015,31(2):87-90.
[7] 刘建勋,林咸明.不同时程电针预处理对脑缺血大鼠血脑屏障功能的保护效应[J].上海针灸杂志,2014,33 (12):1169-1172.
[8] 卢永屹.针刺干预中风先兆疗效观察[J].上海针灸杂志,2008,27(10):10-11.
[9] Perego C, Fumagalli S, Zanier ER,. Macrophages are essential for maintaining a M2 protective response early after ischemic brain injury[J]., 2016, 96:284-293.
[10] Singh S, Houng AK, Reed GL. Matrix Metalloproteinase- 9 Mediates the Deleterious Effects of α2-Antiplasmin on Blood-Brain Barrier Breakdown and Ischemic Brain Injury in Experimental Stroke[J]., 2018, 376:40-47.
[11] 张弦,黄国付,邹璟,等.电针预处理对脑缺血后小胶质细胞活化影响的研究进展[J].中医药导报,2017,23 (6):77-79,82.
[12] 林咸明,陈丽萍,姚旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障基质金属蛋白酶-9、血管内皮生长因子的影响[J].针刺研究,2015,40(1):40-44.
[13] 郑仕平,韩为,储浩然,等.通督调神针灸预处理对脑缺血再灌注大鼠miRNA664及MMP9调控机制的研究[J].上海针灸杂志,2016,35(1):76-80.
[14] 刘宇,孟然,闫峰,等.激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析[J].中国病理生理杂志,2011,27(3):620-624.
[15] 周娇娇,阙建宇,于雯雯,等.Morris水迷宫检测动物学习记忆水平的方法学[J].中国老年学杂志,2017,37 (24):6274-6277.
[16] 鲍欢,姜华,汪超,等.院前-院内医疗联动体系在进一步提高脑卒中急救水平中的作用[C].中华医学会第十八次全国神经病学学术会议论文汇编,2015:867.
[17] 甘照儒,桑栎楠.脑缺血/再灌注损伤级联反应研究进展[J].医学综述,2009,15(1):43-45.
[18] Yang C, Hou X, Feng Q,.Lupus serum IgG induces microglia activation through Fc fragment dependent way and modulated by B-cell activating factor[J]., 2019,17(1):426.
[19] Gao F, Shen J, Zhao L,.Curcumin Alleviates Lipopolysaccharide (LPS)-Activated Neuroinflammation via Modulation of miR-199b-5p/IκB Kinase β (IKKβ)/ Nuclear Factor Kappa B (NF-κB) Pathway in Microglia[J]., 2019,25:9801-9810.
[20] Speicher AM, Wiendl H, Meuth SG,.Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration[J]., 2019,14(1):46.
[21] 甘海燕,李琳,杨琰,等.补阳还五汤调控小胶质细胞/巨噬细胞极化抑制大鼠脑缺血后炎症反应研究[J].浙江中医药大学学报,2019,43(1):1-6.
[22] Su N, März S, Plagemann T,.Occurrence of Transmembrane Protein 119 in the Retina is Not Restricted to the Microglia: An Immunohistochemical Study[J]., 2019,8(6):29.
[23] Teng Y, Zhang Y, Yue S,.Intrathecal injection of bone marrow stromal cells attenuates neuropathic pain via inhibition of P2X4R in spinal cord microglia[J]., 2019,16(1):271.
[24] Karali M, Guadagnino I, Marrocco E,.AAV-miR- 204 Protects from Retinal Degeneration by Attenuation of Microglia Activation and Photoreceptor Cell Death[J]., 2019,19:144-156.
[25] 孙振宇,李斌.中枢神经系统中小胶质细胞特性与功能的相关研究进展[J].中国医学创新,2013,10(16): 151-153.
[26] 何丽君,肖作为,鄢英慧,等.红景天苷对活化小胶质细胞MMP-2和MMP-9表达水平的影响及其机制研究[J].海峡药学,2016,28(9):265-269.
[27] Xu S, Liu S, Yan G.Lycium Barbarum Exerts Protection against Glaucoma-Like Injury Via Inhibition of MMP-9 Signaling In Vitro[J]., 2019,25:9794- 9800.
[28] Guo JT, Cao XQ, Wu LL,.Effect of IL-1β on apoptosis of synovial cells in rheumatoid arthritis rats via the NF-κB pathway[J]., 2019,23(23):10211-10217.
[29] Moon JH, Na JY, Lee MC,. Neuroprotective effects of systemic cerebral endothelial cell transplantation in a rat model of cerebral ischemia[J]., 2016, 8(5):2343-2353.
[30] Yang Y, Rosenberg GA. Matrix metalloproteinases as therapeutic targets for stroke[J].s, 2015,1623: 30-38.
[31] Pang J, Chen Y, Kuai L,. Inhibition of Blood-Brain Barrier Disruption by an Apolipoprotein E-Mimetic Peptide Ameliorates Early Brain Injury in Experimental Subarachnoid Hemorrhage[J]., 2017, 8(3):257-272.
[32] Lin R, Yu K, Li X,. Electroacupuncture ameliorates post-stroke learning and memory through minimizing ultrastructural brain damage and inhibiting the expression of MMP-2 and MMP-9 in cerebral ischemia-reperfusion injured rats[J]., 2016,14(1):225-233.
[33] 王鲜,黄佳,柳维林,等.电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响[J].中国康复理论与实践,2015,21(11):1251-1255.
[34] 袁琼兰,李瑞祥,羊惠君,等.大鼠脑缺血再灌注时小胶质细胞或巨噬细胞的活化与增殖[J].中国神经免疫学和神经病学杂志,2003,10(1):54-59.
[35] Romanic AM, White RF, Arleth AJ,. Matrix metalloproteinase expression increases after cerebral focal ischemia in rats: inhibition of matrix metallo- proteinase-9 reduces infarct size[J]., 1998,29(5): 1020-1030.
[36] Vafadari B, Salamian A, Kaczmarek L.MMP-9 in trans- lation: from molecule to brain physiology, pathology, and therapy[J]., 2016,139(Suppl 2):91-114.
[37] Liutkevicius V, Lesauskaite V, Liutkeviciene R,.Matrix Metalloproteinases (MMP-2,-3,-9) Gene Poly- morphisms in Cases of Benign Vocal Fold Lesions and Laryngeal Carcinoma[J]., 2020,34(1):267- 274.
[38] Coilly A, Desterke C, Guettier C,.FABP4 and MMP9 levels identified as predictive factors for poor prognosis in patients with nonalcoholic fatty liver using data mining approaches and gene expression analysis[J]., 2019,9(1):19785.
Effect of Matrix Metalloproteinase-9 Pathway Mediated by Microglia Activation on the Brain Protective Effect of Electroacupuncture Pretreatment in A Rat Model of Middle Cerebral Artery Occlusion
-,-,-,-,,-,-,,-.
,310053,
By studying the effect of electroacupuncture pretreatment on the cerebral infarct volume, activation of microglia and expression of matrix metalloproteinase-9 (MMP-9) positive cells in a rat model of middle cerebral artery occlusion (MCAO), to evaluate the brain protective effect of electroacupuncture pretreatment on MCAO rats and its related mechanism.Thirty-two health Sprague Dawley (SD) rats were randomized into a sham operation group, a model group, an electroacupuncture pretreatment group and an acupuncture group, with 8 rats in each group. After the electroacupuncture at Baihui (GV20) and Fengfu (GV16) for 15 days, the modified Zea Longa’s thread occlusion method was adopted to prepare the rat model of MCAO. The neurobehavioral score and the ability of learning and memory were observed by using Longa 4-point method and the Morris water maze. The cerebral infarct volume was examined by using 2,3,5-Triphenyltetrazolium chloride (TTC) staining method. The activated microglia and MMP-9 positive cells were examined by using immunofluorescence method.Compared with the sham operation group, the cerebral infarct volume, the number of MMP-9 positive cells and the activation of microglia in the model group were significantly increased (<0.01). Compared with the model group, the cerebral infarct volume, the number of MMP-9 positive cells and the activation of microglia in the electroacupuncture pretreatment group and acupuncture group decreased significantly (<0.05).The electroacupuncture pretreatment at Baihui (GV20) and Fengfu (GV16) can decrease the cerebral infarct volume in MCAO rats, improve the loss of learning and memory, and exert the brain protective effect. The action mechanism is possibly related to the inhibition of MMP-9 pathway mediated by microglia activation.
Acupuncture therapy; Electroacupuncture pretreatment; Reperfusion injury;Brain ischemia; Microglia; Matrix metalloproteinase-9; Rats
R2-03
A
10.13460/j.issn.1005-0957.2020.01.0090
1005-0957(2020)01-0090-08
2019-06-03
国家级大学生创新创业训练计划(201810344028)
陈丽莹(1996—),女,2015级学生,Email:870717938@qq.com
林咸明(1966—),男,教授,Email:linxianming66@126.com
