miR-204-5p靶向JARID2调控葡萄膜黑色素瘤细胞增殖侵袭迁移的机制
2020-02-07马宇周利晓刘意武卫
马宇 周利晓 刘意 武卫
(1郑州大学第五附属医院眼科,河南 郑州 450052;2郑州铁路职业技术学院;3郑州大学第二附属医院 眼科)
葡萄膜黑色素瘤(UM)是主要发生于成人眼部的一种原发性恶性肿瘤,极易发生转移,死亡率极高〔1〕。调查显示,UM的致死率高达50 %,主要死于肝转移,预后极差,近13%的患者预后存活期超过1年〔2,3〕。UM易于通过血液进行转移,主要转移至肝脏、肺和骨〔4〕。目前国内外针对UM的靶向治疗的研究具很大潜力。miRNA是一种小的非编码RNA,长度为19~24个核苷酸,其通过结合靶基因的3'非编码区域,以完全或不完全互补的方式降解靶基因或抑制靶基因翻译,以至靶基因沉默〔5〕。miR-204-5p在肿瘤中普遍作为抑癌基因发挥作用,但其在UM中的作用机制尚未十分清楚。含有JmjC域(具有去甲基化活性)的SMCX蛋白(JARID2)为Jumonji蛋白家族中的一员,其作为癌基因参与肿瘤的生理病理过程〔6,7〕。JARID2表达异常可促进肿瘤细胞的上皮细胞向间质细胞转化(EMT),进而发挥肿瘤的恶性促进作用〔8,9〕。但JARID2在UM中的调控作用机制尚未完全清楚。本研究拟以UM细胞MUM-2B为研究对象,检测miR-204-5p、JARID2在 MUM-2B细胞中的表达,观察过表达miR-204-5p、敲减JARID2、过表达JARID2对MUM-2B细胞增殖、迁移、侵袭的影响。
1 材料与方法
1.1材料 正常葡萄膜上皮细胞ARPE-19、UM细胞 MUM-2B 均购自美国菌种保藏中心(ATCC);DMEM培养基、胎牛血清、噻唑蓝(MTT)、胰蛋白酶均购自美国GIBCO公司;LipofectamineTM2000、二喹啉甲酸(BCA)蛋白定量试剂盒、逆转录试剂盒购自大连Takara公司;十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)试剂盒、电化学发光(ECL)液和RIPA蛋白裂解液均购自碧云天生物技术公司;聚偏氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司。
1.2方法
1.2.1细胞培养 用含10%胎牛血清的DMEM培养基培养正常葡萄膜上皮细胞ARPE-19、UM细胞 MUM-2B,置于37℃,5% CO2的培养箱中常规培养。
1.2.2细胞转染 把未作任何处理的正常培养的MUM-2B细胞标记为NC组。将miR-204-5p模拟物(mimics)、miR-对照(con)、敲减JARID2基因(si-JARID2)、敲减阴性对照(si-con)、miR-204-5p+pcDNA、miR-204-5p+pcDNA-JARID2按照脂质体LipofectamineTM2000说明书操作步骤要求转染至U-2OS细胞,分别标记为miR-204-5p组、miR-con组、si-JARID2组、si-con组,miR-204-5p+pcDNA组、miR-204-5p+pcDNA-JARID2组转染48 h后,用qRT-PCR检测转染效率。转染成功后,用于后续试验。
1.2.3qRT-PCR实验 取适量对数生长期1.2.2各组细胞,按照RNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按逆转录试剂盒按照说明书操作合成cDNA。最后按qRT-PCR试剂盒说明书操作进行miR-204-5p、JARID2检测。用2-△△Ct计算miR-204-5p、JARID2的表达。
1.2.4MTT实验 取适量1.2.2各组细胞,加入20 μl 5 g/L的MTT溶液,培养3.5 h,然后弃去上清,每孔加入150 μl二甲基亚砜(DMSO),震荡,使结晶溶解,在490 nm波长下检测细胞吸光度(A)。细胞的增殖力与吸光值呈正比。
1.2.5Western印迹实验 取1.2.2各组细胞,加入裂解液,冰上裂解30 min。12 000 r/min离心10 min。取上清置于EP管,加入5×SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗,4℃过夜孵育,洗膜,加Ⅱ抗,4℃ 2 h。加发光液,曝光。
1.2.6Transwell实验 将1.2.2各组细胞以106个/孔接种于细胞6孔板,培养至融合度75%时,更换无血清培养基培养过夜。调整细胞密度至105个/ml,取100 μl加入上室内,600 μl含血清的培养基加入下室,培养过夜。取出小室,用棉签擦去上室内的细胞,磷酸盐缓冲液(PBS)洗涤,甲醇固定30 min,0.1%结晶紫染色20 min,PBS洗涤。显微镜下观察小室下表面附着的迁移细胞数,随机选5个视野计数,取平均值。将Transwell小室上表面铺适量厚度的基质胶,然后按照上述操作方法操作。最后显微镜下观察小室下表面附着的侵袭细胞。
1.2.7双荧光素酶报告基因检测实验 取适量对数生长期1.2.2各组细胞,遵照双荧光素酶报告基因检测试剂盒技术手册要求操作。以海参荧光素酶为报告基因的载体质粒(psiCHECK2)以萤火虫荧光素酶活性为内参,psiCHECK2-JARID2-3′UTR WT和psiCHECK2-JARID2-3′UTR MUT的表达为对照,转染24 h后,检测荧光强度。海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反映miR-204-5p与JARID2的结合力。
1.2.8统计学处理 采用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1miR-204-5p、JARID2在ARPE-19细胞和MUM-2B细胞中的表达 与ARPE-19细胞相比,MUM-2B细胞中miR-204-5p的表达显著降低,JARID2 mRNA及蛋白表达显著升高(P<0.05)。见图1、表1。
2.2过表达miR-204-5p抑制UM细胞增殖 与miR-con组相比,miR-204-5p组MUM-2B细胞在48、72 h时细胞活性均显著降低(P<0.05)。见表2。

图1 JARID2在ARPE-19和MUM-2B细胞中的表达

细胞miR-204-5pJARID2 mRNAJARID2蛋白ARPE-191.36±0.140.79±0.110.23±0.02MUM-2B0.16±0.032.58±0.161.56±0.08t/P值14.517/0.00015.968/0.00027.936/0.000
表2 过表达miR-204-5p抑制UM细胞增殖
与miR-con组比较:1)P<0.05;表3同
2.3过表达miR-204-5p抑制UM细胞迁移和侵袭 与miR-con组相比,miR-204-5p组MUM-2B细胞迁移量和侵袭量均显著降低(P<0.05)。见表3。
2.4miRNA-204-5p靶向JARID2 运用miRcode数据库预测到miRNA-204-5p与JARID2 3′UTR存在结合位点(图2A);双荧光素酶活性检测结果显示,与miR-con组相比,miR-204-5p组WT-JARID2细胞中荧光活性显著降低,MUT-JARID2细胞中荧光活性不受影响。见表4;与miR-con组(1.42±0.12)相比,miR-204-5p组细胞中JARID2表达(0.51±0.07)显著降低(P<0.05),与anti-miR-con(1.51±0.11)组相比,anti-miR-204-5p组细胞中JARID2表达显著升高(1.64±0.14,P<0.05)。见图2B。

表3 过表达miRNA-204-5p抑制UM细胞迁移和侵袭
表4 双荧光素酶报告实验
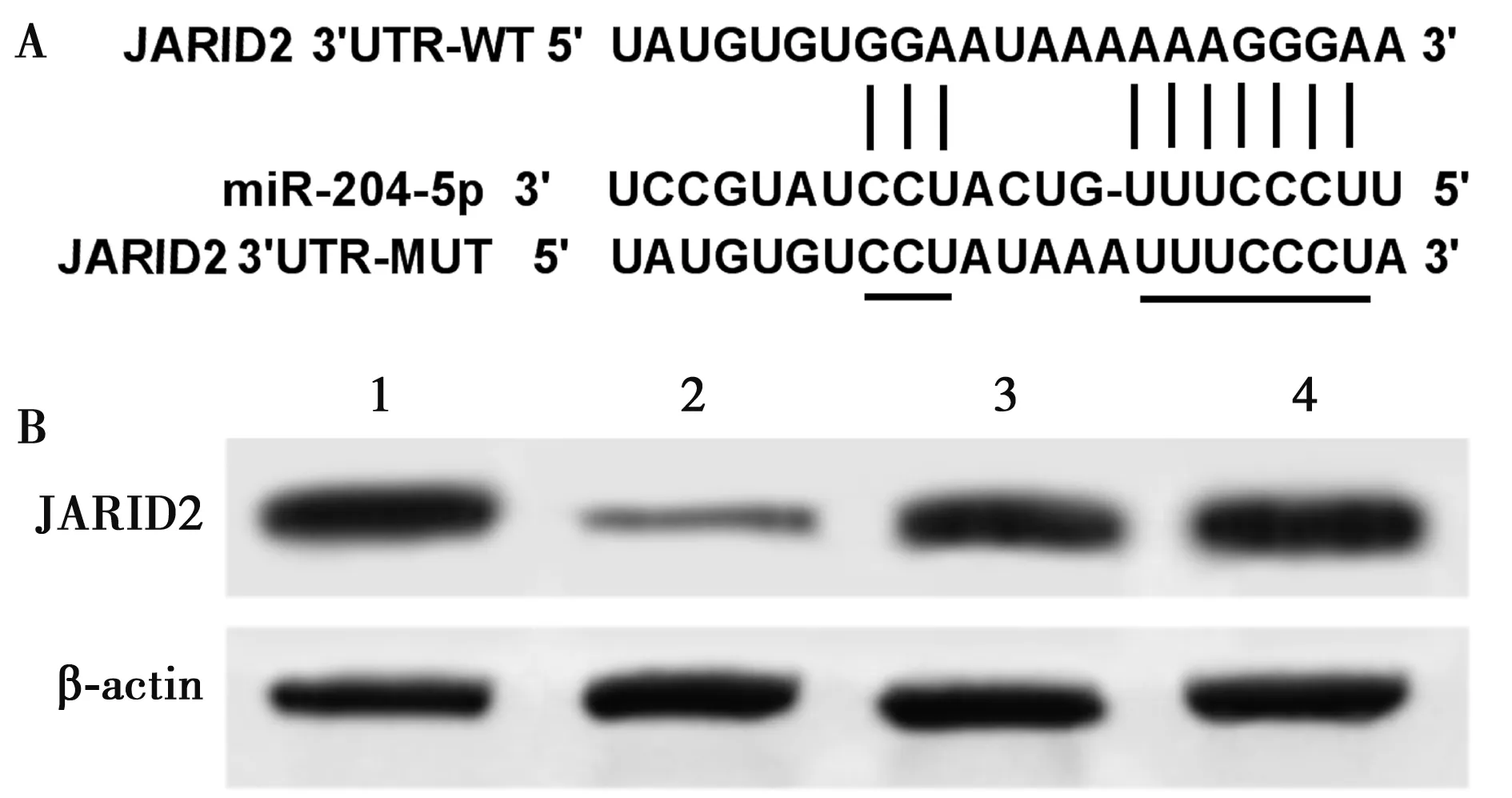
1~4:miR-con组、miR-204-5p组、anti-miR-con组、anti-miR-204-5p组图2 miRNA-204-5p靶向JARID2
2.5敲减JARID2抑制UM细胞增殖、迁移和侵袭 与si-con组相比,si-JARID2组MUM-2B细胞JARID2蛋白表达量显著降低(图3),在48、72 h时细胞活性均显著降低,细胞迁移数和侵袭数均显著降低(P<0.05)。见表5。
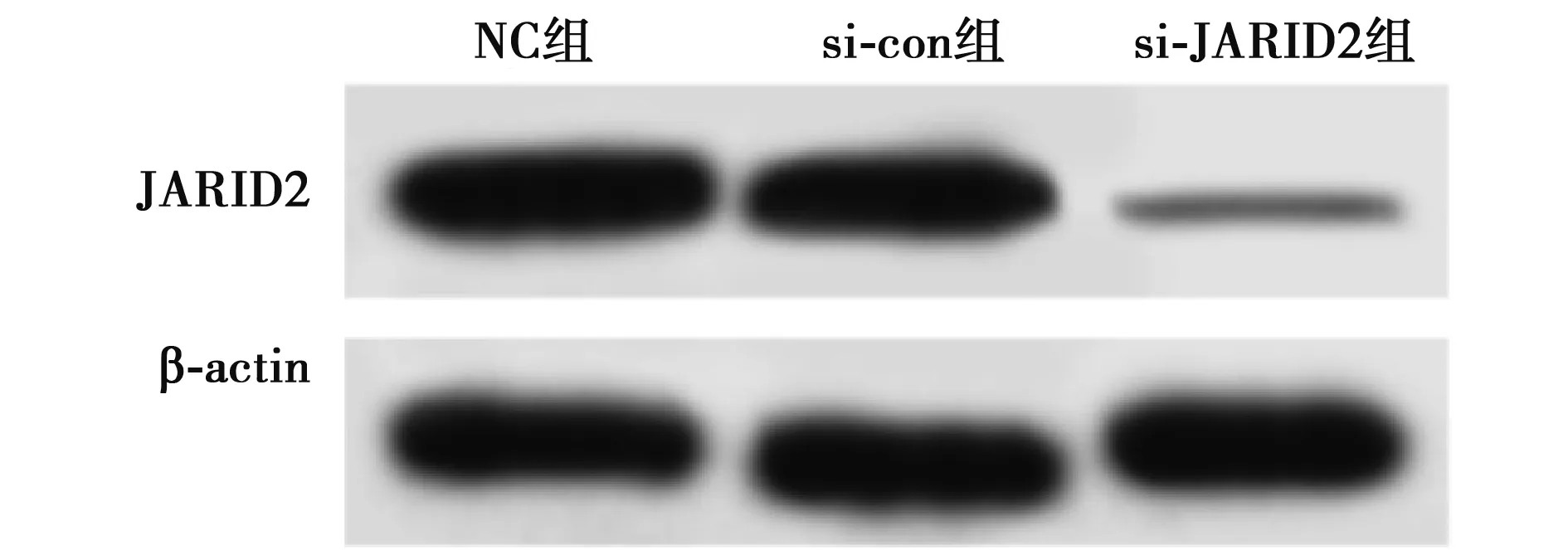
图3 UM细胞中JDRID2的表达
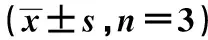
表5 敲减JARID2抑制UM细胞增殖、迁移和侵袭
与si-con组比较:1)P<0.05
2.6过表达miR-204-5p和过表达JARID2影响UM细胞增殖、迁移和侵袭 与miR-con组相比,miR-204-5p组MUM-2B细胞在48、72 h时细胞活性均显著降低,细胞迁移数和侵袭数均显著降低;与miR-204-5p+pcDNA组相比,在48、72 h时细胞活性均显著升高,细胞迁移数和侵袭数均显著升高(P<0.05)。见表6。
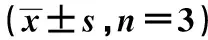
表6 过表达miR-204-5p和过表达JARID2影响UM细胞增殖、迁移和侵袭
与miR-con组比较:1)P<0.05;与miR-204-5p+pcDNA组比较:2)P<0.05
3 讨 论
UM是最常见的原发性眼内恶性肿瘤,包括虹膜、睫状体和脉络膜的黑色素瘤,其临床和分子特征及其危险因素、遗传学、发病机制、转移行为和治疗方面与皮肤黑色素瘤明显不同〔10~12〕。目前,绝大多数UM采用全球保护放疗(主要是近距离放射治疗),局部控制率>95%,摘除保留用于较大的黑素瘤,甚至可用各种晚期形式的外部放射来治疗〔13,14〕。尽管对原发肿瘤进行了成功和持久的治疗,但长期存活率仍然很低〔15〕。因此,研发有效的治疗方案及药物具有重要意义。
越来越多的miRNA参与肿瘤的发生,包括黑素瘤肿瘤〔16,17〕。miR-204-5p在许多人类恶性肿瘤中被下调并起到肿瘤抑制剂的作用〔18,19〕。Luan等〔20〕在黑色素瘤的研究中发现,miR-204-5p的表达异常下调,尤其是在转移性黑素瘤中,且过表达miR-204-5p可抑制黑色素瘤细胞增殖、迁移和侵袭,促进黑素瘤细胞凋亡,此外,基质金属蛋白酶-9和B细胞淋巴瘤-2是miR-204-5p的功能靶标,通过它们miR-204-5p在恶性黑素瘤中发挥生物学作用,又用异种移植模型验证miR-204-5p对恶性黑素瘤的作用,且miR-204-5p在恶性黑素瘤细胞中可增加5-氟尿嘧啶和顺铂(DDP)的化学敏感性,阐明了miR-204-5p在黑素瘤发展中的新功能和机制,为黑素瘤的治疗提供了治疗靶点。本研究检测了UM细胞 MUM-2B 中miR-204-5p的表达发现,miR-204-5p表达异常降低,且过表达miR-204-5p可抑制 MUM-2B细胞的增殖、迁移和侵袭,这与Luan等〔20〕的研究结果相抑制;深入研究,用双荧光素没报告基因检测实验验证,miR-204-5p靶向负调控JARID2。
组蛋白赖氨酸残基的去甲基化酶(KDMs)通过调节底物的甲基化在肿瘤细胞的生物学中具有重要作用〔21,22〕。JmjC为 KDMs的一个稳定结构域,其在Jumonji蛋白家族成员JARID2中首次发现〔23〕。大量研究证实,JARID2在癌症的发生发展中具有关键作用〔24~26〕。张岚等〔27〕在舌鳞癌的研究中发现,JARID2在舌鳞癌组织和细胞中的表达均明显升高。Radberger等〔28〕运用免疫组织化学染色法对UM患者组织研究发现,JARID1B的表达异常升高,且高JARID1B表达与较低的存活率相关。刘博等〔29〕在UM细胞的研究中发现,JARID2表达异常升高,敲减JARID2可抑制UM细胞的增殖、迁移、侵袭,提示JARID2在UM中具有重要作用。本研究检测了UM细胞 MUM-2B中JARID2的表达发现,JARID2表达异常升高,且敲减JARID2可抑制 MUM-2B细胞的增殖、迁移和侵袭,这与刘博等〔29〕的研究结果相一致;深入研究发现,过表达JARID2可逆转过表达miR-204-5p对UM细胞增殖、迁移、侵袭的抑制作用。
综上所述,miR-204-5p可抑制UM细胞增殖、迁移、侵袭,其机制可能与靶向JARID2有关,为UM的预防和治疗提供新靶点。
