骨髓间充质干细胞移植在小鼠脑梗死中的作用机制及对大脑HMGB1水平的影响
2020-02-07张桂芳杨孟丽常玉霞高石娟谭伟丽李天晓陈雪梅
张桂芳 杨孟丽 常玉霞 高石娟 谭伟丽 李天晓 陈雪梅
(1河南省人民医院,河南 郑州 450003;2郑州大学第一附属医院)
脑梗死又称为缺血性脑卒中,是由于各种原因引起的局部脑组织发生缺血性供应障碍,从而导致脑组织缺氧、缺血或发生变性坏死,继而产生相应的神经缺损症状〔1〕。临床上将脑梗死发病机制分为脑血栓形成、腔隙性脑梗死与脑栓塞3类,均与动脉粥样硬化、高血压、饮食不当及过度精神压力有关,临床表现为头昏、一过性肢体麻木、无力等,严重者将危及生命〔2〕。目前,临床上对于脑梗死多以溶栓、脑神经保护治疗为主,虽然能延缓病情发展,降低死亡率,但是远期预后较差,且存活患者中50.0%~70.0%伴有后遗症〔3,4〕。骨髓间充质干细胞是一种特殊的细胞,具有取材简单、免疫原性低、可自体取材等优点,成为脑梗死治疗的首选干细胞〔5〕。研究结果表明〔6〕,骨髓间充质干细胞移植能促进脑梗死神经功能恢复且安全,能为脑梗死治疗提供思路。但骨髓间充质干细胞治疗脑梗死的具体机制尚有待阐明〔7〕。高迁移率族蛋白(HMG)B1是一种高度保守的核蛋白,广泛分布于哺乳动物中,且随着晚期促炎作用的进一步研究而成为危重医学研究热点〔8〕。研究表明〔9〕,HMGB1是脑梗死早期脑部炎症相对重要的诱发因子,脑梗死后脑部多数HMGB1均从坏死的神经原中释放。目前,骨髓间充质干细胞对脑梗死组织中HMGB1低水平的影响研究较少,本文拟探讨骨髓间充质干细胞移植在小鼠脑梗死中作用机制及对大脑HMGB1水平影响。
1 资料与方法
1.1实验动物 参与实验的C57小鼠45只(7~8 w),雌雄不限,体质量20~26 g,动物合格证号:SCXK-2007-0003,自由摄食、饮水,光照12 h,建模前12 h禁食。5只用于骨髓间充质干细胞的分离、培养及鉴定;其余40只随机取10只,设为空白对照组,剩余30只采用线栓法完成脑梗死动物模型建立,建模成功后分为模型对照组、溶剂组与干细胞组各10只。
1.2仪器与设备 胎牛血清(美国Gibco公司)、H-DMEM培养基(美国Hyclone公司)、水合氯醛(国药集团化学试剂有限公司)、CO2培养箱(Thermo Forma公司)、多聚甲醛(北京化工厂)、高速冷冻离心机(德国赛多利斯公司)、手术器械一套(由医院提供)、倒置显微镜(日本Olympus)。
1.3细胞分离、鉴定 (1)细胞的分离、培养:5只C57小鼠,采用5%水合氯醛进行腹腔注射麻醉,待麻醉生效后常规消毒、铺巾,取双侧髂骨、胫骨与股骨浸泡在75%酒精中5 min,剥去骨头上附着的肌肉,剪开骨两端,采用1 ml注射器抽取磷酸盐缓冲液(PBS)冲洗骨髓并移至培养皿中,对骨髓悬液进行反复吹打,直到看不见明显的颗粒细胞悬液〔10〕。将获得的细胞悬液置入Ficoll淋巴细胞分离液中,3 000 r/min离心30 min,去上清,吸出白膜层,PBS清洗3次,3 500 r/min离心5 min,PBS连续清洗3次,去上清,加入含5%小牛血清的DMEM培养基2 ml,吹打细胞团,让细胞悬浮于培养基中。取细胞悬液10 μl在细胞计数板上计数,取(5~10)×105/ml细胞培养于25 cm2培养瓶中,37℃ 5%CO2培养箱中培养48 h,去除未贴壁的细胞,倒置显微镜下观察细胞形态;待细胞融合80.0%以上后进行传代培养,取第3代细胞备用〔11〕。(2)细胞鉴定:分别取骨髓间充质干细胞10×106,将其分为4分,分别加入CD34、CD90、CD73及不加抗体的稀释液,常温下孵育30 min,3 500 r/min离心5 min,去上清,加入PBS并不断吹打细胞,倒置显微镜下计数,待细胞孵育良好后采用流式细胞仪完成骨髓间充质干细胞鉴定,重复3次,取平均值〔12〕。
1.4动物模型建立及处理 造模小鼠均采用10.0%水合氯醛腹腔注射麻醉,剂量3 ml/kg,待麻醉生效后常规消毒、铺巾。正中部位切开颈前皮肤,完成颈总动脉/颈外动脉、颈内动脉(ICA)的分离,给予动脉夹完成颈总动脉近端与颈外动脉夹闭,利用血管夹夹闭ICA与椎动脉。在颈外动脉近端颈总动脉分叉部位做长2~3 mm的小切口,插入8-0尼龙纤维线,将纤维线送到颈内动脉近端后松开,然后将血管夹打开,继续前行直到遇到阻力位置,建立短暂性脑缺血小鼠模型,扎紧ICA、椎动脉〔13〕。假体手术组建模后与空白对照组进行常规喂养,经尾静脉注射生理盐水1 ml,溶剂组注射200 μl 5%鼠血清的RPMI1640培养基,干细胞组注射骨髓间充质干细胞5×106个(约1 ml),干预后30 d进行评估。
1.5观察指标 (1)骨髓间充质干细胞形态、鉴定:在倒置显微镜下观察细胞贴壁生长及第3代细胞形态;观察流式细胞仪测定下细胞表面标准物水平〔14〕;(2)神经功能缺损:采用改良神经功能缺损量表(mNSS)对各组建模前、干预后1、10、20及30 d神经缺损进行评估。该量表主要从运动、反射及感觉3方面进行评估,总分18分,分值越低治疗效果越理想〔15〕;(3)炎症因子:各组建模前、干预后30 d尾静脉采血2 ml,血清分离后采用酶联免疫吸附试验测定白细胞介素(IL)-6、IL-10及转化生长因子(TGF)-β水平〔16〕;(4)HMGB1水平:向上述分离的血清标本加入蛋白酶抑制剂(PMSF),吹打混合均匀后,4℃ 3 500 r/min离心5~6 min,取其上清为组织总蛋白,采用Western印迹测定各组血清中HMGB1表达水平,以β-actin作内参,采用美国LI-COR公司的Odyssey双色红外荧光成像系统对条带进行分析〔17〕。
1.6统计学分析 采用SPSS18.0软件进行χ2检验、t检验。
2 结 果
2.1骨髓间充质干细胞倒置显微镜下形态与鉴定 原代骨髓间充质干细胞形态不一,形状多为梭形;传代培养后第3代细胞增长迅速、排列具备一定的方向性,多呈旋涡状生长,但细胞界限不清,见图1。流式细胞仪测定结果表明:分离获得的骨髓间充质干细胞CD34占1.4%,CD73为98.6%,CD90为99.1%,说明分离获得的细胞为骨髓间充质干细胞,见图2。

图1 骨髓间充质干细胞倒置显微镜形态(×200)

图2 骨髓间充质干细胞流式细胞仪结果
2.2各组神经功能缺损评分比较 各组建模前神经功能缺损评分均无统计学意义(P>0.05);干细胞组干预后各时间点神经功能缺损评分均显著低于溶剂组、模型对照组且显著高于空白对照组(P<0.05);溶剂组干预后各时间点神经功能缺损评分均显著低于模型对照组且显著高于空白对照组(P<0.05);模型对照组干预后各时间点均显著高于空白对照组(P<0.05);见表1。

表1 各组神经功能缺损评分比较(分,
与空白对照组比较:1)P<0.05;与模型对照组比较:2)P<0.05;与溶剂组比较:3)P<0.05;下表同
2.3各组炎症因子比较 各组建模前IL-6、IL-10及TGF-β水平比较均无统计学意义(P>0.05);干细胞组干预后30 d IL-6水平显著高于溶剂组与模型对照组且显著低于空白对照组(P<0.05),IL-10、TGF-β水平均显著低于溶剂组与模型对照组且显著高于空白对照组(P<0.05);溶剂组干预后30 d IL-6水平显著高于模型对照组且显著低于空白对照组(P<0.05),IL-10、TGF-β水平均显著低于模型对照组且显著高于空白对照组(P<0.05);模型对照组干预后30 d IL-6显著低于空白对照组(P<0.05),IL-10、TGF-β水平显著高于空白对照组(P<0.05)。见表2。
2.4各组HMGB1水平比较 干细胞组〔(1.48±0.12)ng/ml〕与空白对照组HMGB1水平〔(1.50±0.12)ng/ml〕比较差异无统计学意义(P>0.05);干细胞组HMGB1水平显著高于溶剂组〔(1.03±0.23)ng/ml〕与模型对照组〔(0.74±0.15)ng/ml〕(P<0.05);溶剂组HMGB1水平显著高于模型对照组(P<0.05),见图3。

表2 各组炎症因子比较
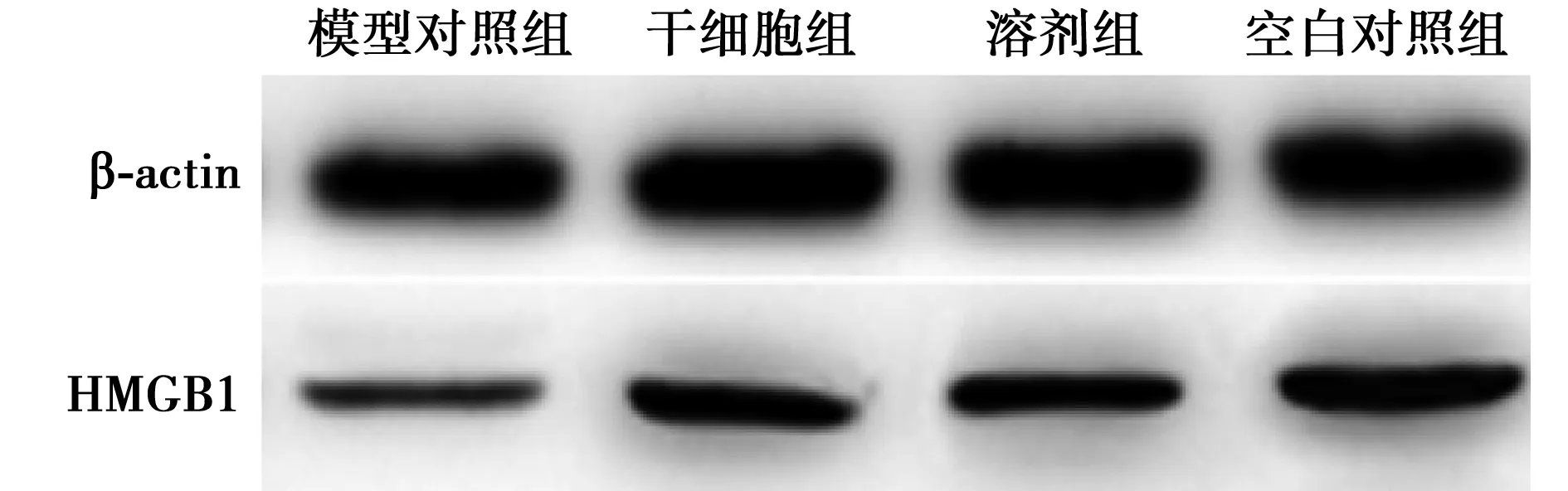
图3 各组HMGB1比较
3 讨 论
骨髓间充质干细胞是一类源于骨髓的特殊细胞,是干细胞的重要组成部分,能在特定条件下向中胚层组织细胞分化,亦可跨胚层向外胚层、内胚层细胞分化。同时,骨髓间充质干细胞进入人体能主动到达受损部位,用于脑梗死中可发挥神经保护作用,能分泌神经生长因子(NGF)、脑源性神经营养因子(BDNF)等神经保护因子,从而促进脑梗死神经功能恢复〔18〕。本研究说明骨髓间充质干细胞移植能减轻脑梗死小鼠神经损伤,利于恢复。骨髓间充质干细胞移植是一种新型的干预方法,用于脑梗死中能让植入的细胞代替受损的神经元、内皮细胞,且干细胞的自我更新、分化则能释放大量的营养因子,能维持、提高机体葡萄糖转运体作用,从而为大脑提供充足的能力与营养供给,有助于促进受损脑组织修复〔19,20〕。研究表明〔21〕,骨髓间充质干细胞抑制能降解细胞外基质,能促进神经突生长星形胶质细胞在中枢神经受损后发挥抗损伤作用,能支持并保护神经元,为新生组织的修复、再生提供氛围。
研究表明〔22〕,过度分化的胶原细胞能释放大量的炎症因子,导致神经元进一步损伤。IL-6主要由成纤维细胞、T淋巴细胞、B细胞产生,能刺激参与免疫反应,促进细胞增殖、分化。IL-10属于是一种多细胞源、多功能细胞因子,能调节细胞的生长、分化,参与炎性反应及免疫反应,是公认的炎症与免疫抑制因子〔23〕。研究表明〔24〕,IL-10在肿瘤、感染、造血系统中发挥了重要的作用。TGF-β是一组新发现的调节细胞生长、分化的TGF-β超家族一员,在特定的条件下促进纤维细胞壁的生长,在组织的修复、炎症及胚胎发育中发挥了重要作用。研究表明,TGF-β能调节细胞生长、分化,直接参与机体免疫调节〔25〕。研究表明〔26〕,脑梗死常伴有炎症因子的共同参与,且不同因子能相互作用、相互影响,加剧疾病的发生、发展。而将骨髓间充质干细胞用于脑梗死中则能促进神经功能恢复,改善炎症因子水平,从根本上控制疾病发展。本研究提示骨髓间充质干细胞能改善脑梗死小鼠炎症因子水平。
研究表明〔27〕,骨髓间充质干细胞能通过多种方式减轻急性脑梗死小鼠梗死体积,移植后能降低炎症应激反应。HMGB首次于1973年在牛胸腺中提取、鉴定,而HMGB1是最为丰富的HMG蛋白,能参与细胞骨架的转录、调节,能与DNA相互结合,能参与DNA的重组、修复及基因的转录调控,在细胞的复制及分化中发挥了重要的作用〔28〕。同时,HMGB1能诱导炎性反应,参与肿瘤细胞的分化、迁移。在脑梗死C57小鼠中,HMGB1多呈低表达,多与脑部组织炎性反应有关〔29〕。本研究说明骨髓间充质干细胞能抑制HMGB1凋亡,延缓病情发展。
综上,将骨髓间充质干细胞移植用于脑梗死小鼠中有助于减少神经缺损,降低炎症因子水平,能促进脑组织中HMGB1释放,能为脑梗死治疗提供思路与方法。
