我国食品用菌种安全性管理现状及国内外管理方式对比研究
2020-02-05陈潇,王君
陈 潇, 王 君
(国家食品安全风险评估中心, 北京 100022)
人类使用有益微生物加工食品的历史已经有上千年。在我国,发酵食品的历史悠久、文化深厚且种类繁多,常见的有酸奶、奶酪、食醋、面酱、豆豉、腐乳、纳豆、泡菜、酒类等[1]。随着食品加工技术的不断发展,微生物在食品生产加工中的应用也愈发广泛。国际乳品联盟(International Dairy Federation,IDF)和欧洲食品和饲料菌种协会(European Food and Feed Cultures Association,EFFCA)对食品用菌种(microbial food cultures,MFC)的定义为:用于食品生产的活的细菌、真菌或酵母。MFC一般由一种或多种微生物菌种(species)或菌株(strains)组成,其中包括了培养过程中带入的,以及为保证菌种存活、储存和标准化所加入的成分,还包括促进其在食品生产加工应用的成分。按照MFC使用目的差异,通常可分为两类:具有工艺作用的食品用菌种(一般作为发酵剂使用),以及具有一定功能,当摄入足量时,可给予宿主健康效益的食品用菌种(即益生菌)[2]。由于MFC的来源和种属关系的非公开性以及菌种本身的遗传特点,食品用菌种的安全性日益受到关注。因此,MFC的使用需要获得相关机构或权威组织的鉴定和批准,并保证副产物和细胞成分的安全性。
为确保食品用菌种的安全性,以及规范食品用菌种的生产和使用,世界各主要国家和地区根据本国或区域现状及管理需求制定了不同目的和不同形式的法律法规。本文对我国及国际主要国家和地区相关法规及规定进行了梳理和总结,对不同的管理方式现状及特点做了分析探讨,以期为提高我国食品用菌种管理的科学性提供参考。
1 我国食品用菌种管理情况
1.1 食品用菌种国家标准情况
原国家卫生和计划生育委员会(现国家卫生健康委员会)(National Health Commission, NHC)于2016年发布了《食品安全国家标准 食品加工用酵母》(GB 31639—2016)[3],该标准适用于食品加工用酵母,并将食品加工用酵母定义为“用于食品加工过程,以糖蜜或淀粉质类原料为主要碳源,加入氮源、磷源等适宜细胞生长的发酵用营养物质,接种酵母菌种,经发酵培养、分离、过滤、干燥等工序制成的能够发酵产生二氧化碳、酒精或增加食品风味等功能的酵母类产品”。该标准还规定了食品加工用酵母的产品分类、技术要求等内容。其中在技术要求中规定了酵母菌种的原料要求、感官要求、污染物限量、微生物限量和食品添加剂的使用等内容。该标准的发布和实施为食品加工用酵母的标准化和规范化提供了依据。
1.2 我国食品用菌种名单管理情况
我国以菌种名单列表和行政许可公告的形式发布允许使用的菌种种类。原卫生部(现国家卫生健康委员会)于2010年4月发布了《可用于食品的菌种名单》[4]。该名单中包括了21个菌种及亚种,其中6个为双歧杆菌属菌种,14个为乳杆菌属菌种,1个为链球菌属菌种。该名单还注明了传统上用于食品生产加工的菌种允许继续使用,但名单以外的新菌种应按照《新食品原料安全性审查管理办法》[5]执行。该名单发布之后,原国家卫生和计划生育委员会(现国家卫生健康委员会)又陆续通过公告的形式批准发布了一批食品用菌种,主要包括2个乳杆菌属菌种、3个乳球菌属菌种、1个明串球菌属菌种、2个丙酸杆菌属菌种、1个克鲁维酵母属菌种、2个片球菌属菌种、3个葡萄球菌属菌种和1个芽胞杆菌属菌种。公告中的菌种均需要按照限定的使用范围等相关要求使用。传统上用于食品生产加工的菌种允许继续使用,未在公告和名单中的菌种则需要按照新食品原料相关管理规定进行申报。
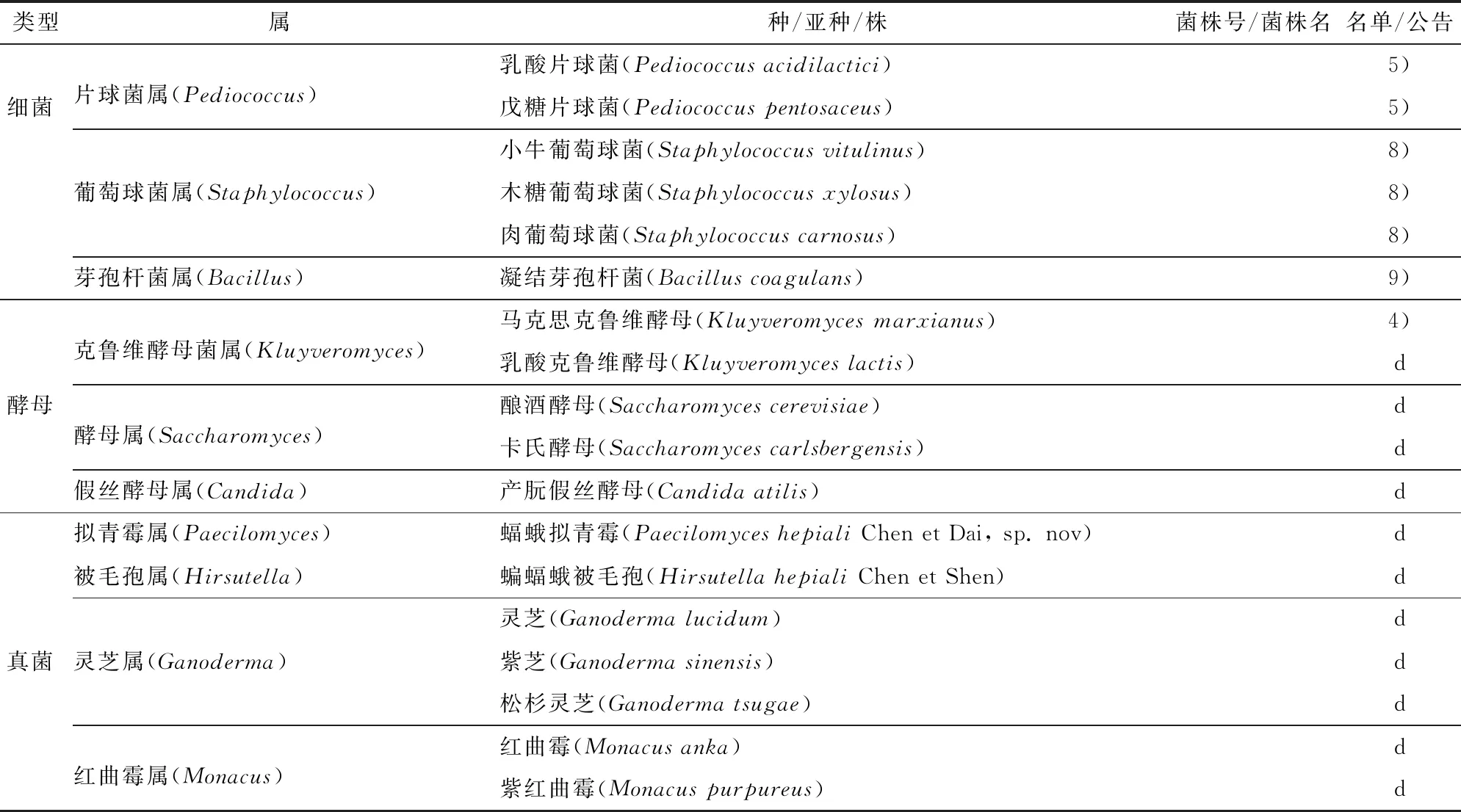
对于婴幼儿食品菌种的使用,原国家卫生和计划生育委员会(现国家卫生健康委员会)于2011年对已批准的可用于食品的菌种进行安全性评估,制定了《可用于婴幼儿食品的菌种名单》[6],该名单中包括4种细菌的6个菌株,其中还限定了嗜酸乳杆菌(Lactobacillusacidophilus)(菌株号NCFM)仅限用于1岁以上幼儿的食品。该名单发布后,原国家卫生和计划生育委员会(现国家卫生健康委员会)又于2014年和2016年分别批准了2个乳杆菌属菌株和1个双歧杆菌属菌株的总共3个菌株可在相关婴幼儿食品中使用[7-8]。此外,对于保健食品中使用的菌种,原卫生部(现国家卫生健康委员会)发布了《可用于保健食品的益生菌菌种名单》以及《可用于保健食品的真菌菌种名单》[9]。我国已批准的食品用菌种具体情况见表1。
1.3 我国对食品用菌种申报的相关规定
按照《新食品原料申报与受理规定》(以下简称《规定》)[10]第1章第3条的定义,新食品原料包括无传统食用习惯的“动物、植物和微生物”。因此,在我国无传统食用习惯的食品用菌种,均需要按照《规定》进行申报。申报的材料应包括研制报告、安全性评估报告、生产工艺、执行的相关标准(包括安全要求、质量规格、检验方法等)、标签及说明书、国内外研究利用情况和相关安全性评估资料等技术资料和相关文件,同时还需要提供未启封最小包装的样品等。对于进口的食品用菌种,需要提供进口菌种的出口国(地区)相关部门或者机构出具的允许该产品在本国(地区)生产或者销售的证明材料,以及进口菌种生产企业所在国(地区)有关机构或者组织出具的对生产企业审查或者认证的证明材料。《规定》第3章还针对技术材料的具体内容进行了详细规定,如研制报告需要包括该菌种的分类学地位、生物学特征、菌种鉴定和鉴定方法及依据等资料,对于国内外均无食用习惯的菌种、仅在国外个别国家或国内局部地区有食用习惯的菌种,以及已在多个国家批准食用的菌种应提供相应的毒理学评价资料。此外,对于菌种的申报,还需要提供微生物耐药性试验报告和产毒能力试验报告。生产工艺部分,需要提供发酵培养基组成、培养条件和各环节关键技术参数,以及菌种的保藏、复壮方法及传代次数。同时,对经过驯化或诱变的菌种,还应提供驯化或诱变的方法及驯化剂、诱变剂等研究性资料。
2 国际组织和其他国家食品用菌种管理情况
2.1 国际组织的情况
国际标准化组织(International Organization for Standardization)和国际乳品联盟(International Dairy Federation,IDF)联合工作组于2010年制定并发布了《用于发酵乳制品的细菌发酵剂》(ISO 27205或IDF 149—2010)标准。该标准规定了工业用细菌发酵剂培养物的定义、分类、细菌数要求、污染物限量、质量和食品安全管理、标签标识以及分析方法等内容,为国际上细菌发酵剂类产品的标准化和规范化提供了参考和依据。

表1 我国已批准的食品用菌种名单
续表1
*仅限用于1岁以上幼儿的食品。名单:a.可用于食品的菌种名单;b.可用于婴幼儿食品的菌种名单;c.可用于保健食品的益生菌菌种名单;d.可用于保健食品的真菌菌种名单。公告:1)《关于批准雨生红球藻等新资源食品的公告》(2010年第17号);2)《关于批准翅果油等2种新资源食品的公告》(2011年第1号);3)《关于将肠膜明串珠菌肠膜亚种列入<可用于食品的菌种名单>的公告》(2012年第8号);4)《关于批准显齿蛇葡萄叶等3种新食品原料的公告》(2013年第16号);5)《关于批准壳寡糖等6种新食品原料的公告》(2014年第6号);6)《关于批准塔格糖等6种新食品原料的公告》(2014年第10号);7)《关于批准番茄籽油等9中新食品原料的公告》(2014年第20号);8)《关于小牛葡萄球菌等3菌种的公告》(2016年第4号);9)《关于发酵乳杆菌CECT5716等3个菌种的公告》(2016年第6号);10)《关于弯曲乳杆菌等24种“三新食品”的公告》(2019年第2号)。此表格信息更新至2019年11月,部分菌种的分类学地位已发生变化,此处仍与名单和公告发布时的写法保持一致。
IDF曾于2002年发布了《具有食品历史记载的微生物清单》(inventory of microorganisms with a docu-mented history of use in food)[11],该文件主要对传统发酵食品的发酵作用类型进行分类,并包含了分离自传统发酵食品的、有食用历史的菌种清单。该清单内容的确定综合考虑了科学文献情况、微生物的食用历史、微生物的实际应用情况、微生态学资料(代谢活动和微生物间的相互作用)以及公共数据库中有关该微生物的临床报告等方面内容。此文件的发布为食品发酵工业对食品用菌种的使用和研发提供了参考,具有广泛的指导意义。2012年,IDF联合EFFCA对该文件进行了修订和补充,说明了MFC在美国和欧盟的管理情况以及科学评价标准,并进一步规范和更新了菌种清单,将清单的范围由用于乳制品的菌种扩展到在更多种类食品中使用的菌种[12]。
世界卫生组织(World Health Organization, WHO)和联合国粮农组织(Food and Agriculture Organization of the United Nations, FAO)于2002年联合发布了《食品中益生菌评价指南》(Guidelines for the Evaluation of Probiotics in Food)[13],该指南提出了目前被广泛认可的“益生菌(probiotics)”的定义,还规定了食品用益生菌的评价准则和要求。指出对于益生菌的评价应主要关注菌株的鉴别(包括形态和基因)、安全性评估、功能特性评估、健康声称和标签等。其中在安全性评估部分,需要关注理论上可能引起的副作用,包括系统性感染、有毒有害的代谢活动、易感人群的过度免疫刺激以及耐药基因转移。
2.2 欧盟的情况
在欧盟范围内使用的食品用菌种首先需要满足欧盟《食品法规的一般原则和要求》[Regulation (EC)No. 178/2002]的相关规定,即食品生产者的职责是应当确保食品用菌种的安全性。对于在食品中有长期安全使用历史的菌种,欧盟允许直接在食品中使用,不需要进行上市前的安全性评估。对于欧盟市场和消费者而言是“新(novel)”的菌种,则需要进行上市前的安全性评价和授权才可进入欧盟市场,欧盟委员会(European Union Commission)决定菌种是否需要进行上市前的安全性评价和授权。
2007年,欧盟正式提出了安全资格认证(qualifiedpresumption of safety, QPS)理念,旨在对添加到食品及饲料中的微生物实施上市前的风险评估。申请者需提请欧洲食品安全局(European Food Safety Authority, EFSA)下属的生物危害评估小组(EFSA Panel on Biological Hazards, BIOHAZ)对其申请的食品用菌种进行上市前的安全性评估。BIOHAZ进行评估和认证工作,并根据最新研究成果和相关资料对QPS列表进行复核和更新,经认证的菌种会通过QPS列表的形式对外发布。该列表修订周期为3年[14]。
QPS对于食品(包括饲料)用菌种的评估包括4项核心内容,即分类学地位(taxonomy)、知识体系(body of knowledge or familiarity)、致病性(pathogenicity)以及最终用途(end use)[15]。分类学地位的评估要求最好使用公认的分类学单位,一般而言微生物都会鉴定到种(species)。为了体现评估工具的最大价值,欧盟使用“资格(qualification)”机制排除含有耐药基因、毒力基因等的不良菌株,在实际可能的最高分类水平寻求QPS。菌种的识别是QPS的先决条件。对有明确分类学地位的菌种,则需要进一步确定其“知识体系”的相关信息。这些信息主要包括食用历史,以及科学文献和资料库、临床、生态学以及工业应用等领域相关信息。“知识体系”的评估是为了确保该菌种任何可能潜在的副作用都是可知和可预测的。如果某微生物不能通过现有命名法或历史命名法与已经具有QPS状态的菌种类别相关联,则需要进行全面的安全性评估。对于通过表型选择或诱变等技术获得的菌株,如果其亲株属于QPS,则安全性评估仅需要关注预期的变化及结果。QPS文件中明确指出了禁止使用具有普遍致病性的菌种类别,同时还规定,若致病性仅限于特定菌株,并且致病机理已经明了且有相应的检测手段,则该菌种可以通过备注限制条件的方式纳入QPS列表。这种管理方式已经应用于诸如枯草芽孢杆菌(Bacillussubtilis)的菌种管理。此外,QPS列表中的大部分菌种可用于各种用途,但也有某些菌种限定了使用的范围,如2015版QPS列表中规定了谷氨酸棒状杆菌(Corynebacteriumglutamicum)的使用范围为“用于氨基酸生产”。
2.3 美国的情况
美国食品药品管理局(U.S. Food and Drug Administration, FDA)于1997年提出了“公认为安全”(generally recognized as safe, GRAS)的管理模式。该模式采用“企业自我认可,FDA备案”的方式对申报菌种的安全性进行评价。对于1958年以前已经在食品中有使用历史的菌株,申请者只要证明其在1958年前的食用情况即可列入GRAS名单,并作为普通食品原料用于食品生产加工。对于1958年之后在食品中使用的菌株,则需要由申请者向FDA的食品安全与应用营养中心(Center for Food Safety and Applied Nutrition, CFSAN)提交申请材料。申请者应根据已有的科学文献和实验结果,组织有资质的专家对菌种的安全性进行评估。该申请材料应包括信息描述、应用条件、鉴定和特性信息、用于指定用途的依据,以及化学、毒理学、微生物学信息和其他相应的支持数据或文献等[16]。FDA根据普遍存在性、普遍可利用性、普遍可接受性3个方面对申请材料进行评估,评估结果包括以下几种基本情况[17]:1)FDA没有疑问(FDA has no questions),即可纳入GRAS名单,但有时FDA会提醒申请者符合标签标示等相关的使用要求(additional correspondence available)。2)应申请者的要求而停止申请的评估(at the notifier’s request, FDA ceased to evaluate this notice)。一般是因为提供的资料不足以评定其安全性,需要申请者重新提供或继续补充相关支持安全使用的数据和信息。3)提供的材料不支持GRAS要求(notice does not provide a basis for a GRAS determination)。一般是因为缺少某些重要的安全性资料,以至于缺少充分的依据证明其符合GRAS。对于已经纳入GRAS名单的物质,FDA会进行跟踪评估。若在使用过程中发现安全问题,FDA会更正GRAS名单并告知申请者。此外,如果GRAS名单中的物质使用范围发生变化,则需要重新进行评定。
2.4 澳大利亚和新西兰的情况
在澳大利亚和新西兰(以下简称“澳新”),传统用菌种外的MFC作为新食品(novel food)由澳新食品标准局(Food Standards Australia New Zealand, FSANZ)进行管理。《澳新食品法典》中的“新食品标准”(Standard 1.5.1)规定了新食品的定义为“没有传统使用习惯,需要对公共健康和安全方面进行评估的食品”,其范围囊括了“微生物,包括益生菌”类别[18]。对于需要申报的食品用菌种,澳新食品标准局将根据现有的动物与人体毒理学资料进行全面的安全性评估。一般而言,安全性评估所考虑的因素主要有以下内容:1)在其他国家作为食品使用的历史。2)成分和组成。3)制备方法及质量规格。4)潜在致敏性。5)成分的代谢或毒代动力学研究。6)成分的动物毒理学研究。7)成分的人类耐受性研究。此外,对于微生物(包括益生菌),还需要提供关于潜在致病性的资料、对胃肠道微生物菌群影响的资料、该微生物在其他国家作为食品使用的资料和人体耐受实验的资料等。对益生菌的人体临床实验必须采用双盲、安慰剂对照的试验设计[19]。对于新公告的新食品,将在15个月内拥有专属使用权,该食品为某品牌专属销售。15个月的专属使用期满后,需要按照FASANZ公布的列表中的名称和使用条件使用和销售。
2.5 加拿大的情况
根据加拿大《食品和药品条例》B部分的规定,食品用菌种可作为食品原料使用。对于没有使用历史的食品用菌种,加拿大同样采取上市前审批制度。加拿大《食品和药品条例》B部分第28款规定了新食品原料的定义[20],其中规定了对于加入食品中的活菌培养物(live bacterial cultures added to foods),若无食用历史,或采用了转基因技术,使其具有新的特征,或不再具有其原始的特征,以及所具有的特征超出了其原始特征的预期范围,都属于需要进行审批的范围。上市前的安全性审查工作由加拿大卫生部负责。评估需要的材料包括:1)销售使用的通用名称。2)生产商的名称和地址或者进口商的名称和地址。3)菌种的相关信息,包括研发信息、生产工艺及包装贮藏工艺、成分改变的细节信息、用途和制备说明、加拿大以外的食用历史和其他证明安全性的资料。4)估计消费量信息。5)所有待使用的标签原文。6)通信联络人及署名日期。加拿大卫生部还建议食品生产商若使用了新技术(如微胶囊技术)协助微生物的传送,则应先联系卫生部食品理事会(Food Directorate of Health Canada)以讨论该技术是否符合新食品原料的定义。同时,即便该菌株属于乳酸菌或者双歧杆菌这类常见可食用菌种,食品理事会仍会要求食品生产商提供相应材料,以确保所申请菌株不具有可转移的耐药性[21]。加拿大卫生部在开展评估时需先确定该申请是否属于新食品原料的范畴,然后根据新食品原料安全评估指南开始安全评估。在收到申请者的材料45天之内,加拿大卫生部需要给出评估意见,一般包括两种结论:1)信息提供完善,可以证明新食品的安全性。2)需要进一步提供补充信息。对于第二种情况,在收到补充信息90d内,需要再次给出评估结论。评估完成后,如果所有评估小组成员都认为该菌种无健康风险,即可由新食品原料部门形成提案交与食品管理委员会,一经批准发给证书同意销售。
3 国内外食品用菌种管理情况比较
MFC对食品生产加工具有非常重要的作用,其在不同国家和地区食品中的应用情况和历史也各不相同。对于各国的管理机构而言,常将MFC按照具有传统食用习惯,以及没有传统食用习惯两种类型采取不同的管理方式。其中,前者一般可直接用于食品生产,其生产和使用需要符合通用食品法规对安全性的要求,而后者则需要按照相应的程序进行评估或审批。
对于具有传统食用习惯MFC,其来源及种类都较为丰富。有国际组织,如IDF,以清单的形式对外公布传统用菌种列表。也有国家和地区要求提供菌种相关信息,并由专门机构进行判断,如澳大利亚和新西兰。一般而言,大部分国家和地区对传统食用习惯MFC的定义和范围进行了限定,其中除美国外的国家和地区均将“有传统食用习惯”限定在所属辖区范围内,具体见表2。
对于不符合表2中规定的具有“传统食用习惯”或“食用历史”的MFC,上述国家和地区均采用了上市前评估及审批的方式进行管理,以保证菌种使用的安全性。由于不同国家和地区对MFC的管理思路不同,其相应的管理方式和规定也存在一定差异。相应管理模式的异同见表3。
需要说明的是,欧盟同样将无食用历史的MFC作为新食品原料管理,然而自1997年以来,欧盟尚未以新食品原料的形式批准MFC。欧盟认为一般的MFC在食品安全使用方面有着悠久的历史,被认为是传统的食品原料。因此,EFSA专家组不对这些MFC进行评估。不过,若需要对某种MFC的安全性进行评估时,可以参考QPS清单[22]。

表2 不同国家和地区对“传统食用习惯”或“食用历史”的界定

表3 不同国家和地区对“无传统食用习惯”或“无食用历史”MFC管理模式的比较
对于无传统食用习惯或食用历史的MFC,管理机构通常根据相应的法律法规对申报或评估程序进行规范,以确保新菌种食用的安全性。MFC的安全性评价一般从2个方面考虑,1是菌种本身对人或动物没有致病性,2是菌种不产生对人或动物健康造成危害的有毒代谢产物。除标签标示、产品信息等申报材料以外,通常需要提供的评估材料还包括分类学、毒理学、致病性、耐药性、食用历史等相关资料和数据,以及标准化工艺等相关信息和资料。上述国家和国际组织对无传统食用习惯的MFC安全性评估相关要求见表4。
4 讨论和建议
笔者总结、梳理和对比了国际组织,以及中国、欧盟、美国、澳大利亚和新西兰、加拿大等国家和地区食品用菌种管理的相关规定。目前,世界上大部分国家和地区尚未对MFC以及食品中MFC的使用制定专门的法律法规或标准。但对于食品中MFC的使用,和其他食品原料一样,均需要以保证其安全性为前提。上述国家和地区在保证MFC安全性上有着各自的管理思路和管理方式,但总的前提是MFC供应商必须有足够的手段和方式保证MFC的安全性。由于MFC是活的微生物,因此相对于其他食用物质而言,管理机构宜建立特定的评价工具和方法评估其安全性,正如欧盟以及IDF和EFFCA的做法。此外,对于MFC管理方式的定位,也同样存在差异,即将非发酵剂类的MFC作为食品原料还是食品添加剂进行管理,同样将影响对于MFC安全性的管理思路。然而,无论采用何种管理思路和管理方式,都应当在MFC的原始种子批水平、工作菌种制备过程、其应用的食品生产过程和整个货架期三个层面对MFC进行评估并保证安全性。结合本文内容,建议我国可从以下几个方面完善MFC的管理:
4.1 完善MFC安全性评价相关要求
对于新申报的MFC,我国分别对国内外均无食用习惯的微生物、仅在国外个别国家或国内局部地区有食用习惯的微生物类和已在多个国家批准食用的微生物类等规定了需要进行的毒理学评价内容。美国将申请备案的菌种分为1958年以前使用的和1958年之后使用的。对于1958年以前使用的菌种,只需要证明其在1958年前的食用情况,即可列入GRAS名单中,无需再进行其他相关备案材料的准备。欧盟则分别规定了对于与已有QPS状态的菌种类别相关联的菌种、特定菌株有致病性的菌种以及亲属株属于QPS的利用重组技术获得的菌株应提供何种申报材料。进行必要的分类管理可以有效节约行政审批资源,有助于在评估时将焦点集中在需要关注的特定安全风险上,更有助于保障新菌种的安全性。建议我国管理部门可根据菌种的分类学地位,结合其安全使用历史情况,进一步细化不同类别菌种的安全性评价要求,如对于与传统菌种在分类学上相近的菌株,或在某分类学水平有致病性菌株的菌种,可分别规定其安全性评价要求,以便节约和集中评审资源,提高评估效率。此外,我国还应尽快建立统一的、规范的MFC安全性评价程序。同时,作为检验和判定MFC产品合规性的重要依据,还应进一步完善各类MFC特别是非发酵剂作用MFC的检验方法标准。
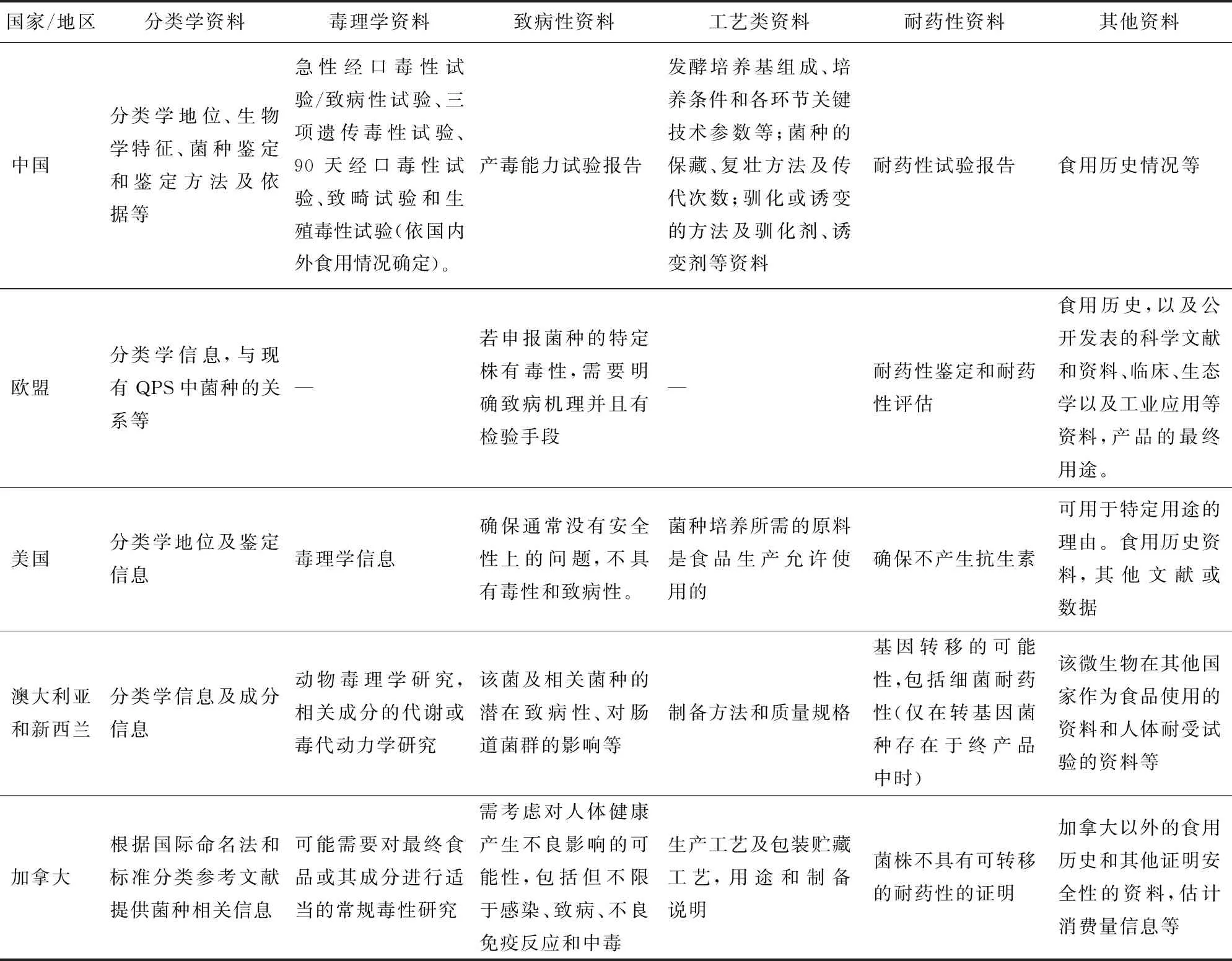
表4 不同国家和国际组织对无传统食用习惯的MFC安全性评估相关要求
“—”代表无相应要求。
4.2 建立上市后跟踪评价机制
有调查显示,我国食品工业用菌种中有84.67%来自有国家认定资质的菌种保藏中心,11.68%来自外资企业,2.92% 由食品企业自行分离获得[23]。虽然传统食品生产所使用的MFC被认为是较为安全的,但随着相关研究和检测技术的发展,常发现新的安全问题。20世纪70年代,我国曾发生生产酱油用真菌菌种在发酵基质上不产生黄曲霉毒素,而在其他基质上产毒的事件。对于生产柠檬酸使用的黑曲霉,有研究发现其部分菌株具有产生伏马菌素等有毒代谢产物的能力。对于生产酱油、大酱及白酒使用的米曲霉,也曾发现野生特定菌株有产生黄曲霉毒素和其他真菌毒素的情况[24]。因此,对于传统菌株特别是长期传代菌种的安全性跟踪是非常必要的,我国应针对传统的和已批准的MFC建立可行的再评价机制。
4.3 完善MFC相关标准
随着对MFC研究的深入和食品加工技术的进步,添加非发酵剂作用的MFC的食品产品,在产品开发和应用上受到更多的关注。作为市场监管和消费者知情权的重要体现,菌种及添加菌种产品的标签标识是食品菌种管理的重要部分。目前,我国在饮料、发酵乳、乳粉等部分产品标准中规定了添加菌种产品应满足的要求以及标签标识规定等内容。随着此类产品种类的日益丰富,我国应进一步完善和统一各类添加菌种食品的标签标识要求。此外,建议根据我国传统发酵食品的情况,对我国“传统上用于食品生产加工的菌种”情况进行研究,积累相关资料。
