红曲霉Monascus sanguineus X1处理黄水的培养基优化及酯化液制备
2020-02-05薛意斌王旭锋刘欢欢李贞景陈勉华王昌禄
刘 丹, 杨 帆, 薛意斌, 王旭锋, 张 静, 刘欢欢,李贞景, 陈勉华, 王昌禄
(天津科技大学 食品工程与生物技术学院/省部共建食品营养与安全国家重点实验室, 天津 300457)
黄水是白酒酿造的酒醅中溶解于水的部分营养物质,浸沉于窖池底部形成的棕黄色黏稠状液体。年产上万吨的白酒企业,每天约有10 t黄水产生。黄水中含有丰富的残余淀粉、还原糖和大量的有机酸,其中乙酸、丁酸和乳酸的含量最为丰富[1],若不经过处理直接排放,不仅会污染环境,而且会造成资源浪费。目前,针对黄水的研究和应用,主要有4个方面:1)微生物多样性分析及菌种选育[2];2)风味物质萃取[3];3)酿酒用大曲的制备[4];4)利用微生物产酯化酶的特性处理黄水,制备酯化液及窖泥养护[5],如唐丽云等[6]利用黄水酯化液提高浓香型白酒的质量和口感;李河等[7]利用现代微生物和发酵工程技术,在酯化酶作用下将黄水、酒尾、尾水等酿酒副产物转化为浓香型白酒酯化液;郗晔[8]以黄水为基质培养产香红曲霉,在不添加其他物质的黄水中发酵产生菌丝体。因此,利用红曲霉制备黄水酯化液,用于白酒增香,具有较大的应用潜力[9-13]。
目前黄水酯化液制备多以曲为微生物来源,且以固态发酵为主要方式,以纯种红曲霉液态发酵处理黄水制备酯化液少见报道,本文利用一株高产酯化酶的红曲霉菌株X1,以酯化酶活力为指标,对该菌株进行了培养基优化;研究了黄水、乙醇、己酸等酯化前体物质对其液态发酵制备酯化液的影响;优化了产酯化液的相关参数。该结果旨在为红曲霉及其酯化酶在黄水中的应用提供理论参考。
1 材料与方法
1.1 实验材料
红曲霉(Monascussanguineus)X1由天津科技大学食品工程与生物技术学院发酵食品与新资源开发研究室保藏。硝酸钠、磷酸二氢钾、硫酸镁、蛋白胨、葡萄糖等均为分析纯。黄水由天津津酒集团提供。
培养基:麦芽汁培养基[14]。种子液培养基:大米粉3 g,NaNO30.3 g,KH2PO40.25 g,MgSO4·7H2O 0.1 g,自来水100 mL,pH自然。发酵培养基:大米粉5 g,NaNO30.3 g,KH2PO40.15 g,MgSO4·7H2O 0.1 g,自来水100 mL,pH值为7.0。以上培养基灭菌条件为121 ℃,15 min。
1.2 仪器与设备
SW- CJ- 1FD型超净工作台,上海博讯事业有限公司医疗设备厂;LS- B50L型立式压力蒸汽灭菌锅,上海华线医用核子仪器有限公司;KCL2000型恒温恒湿培养箱,日本EYELA东京理化公司;AG22331型高速离心机,德国Eppendorf公司;ZWY- 2112D型恒温培养振荡器,上海支撑分析仪器制造有限公司。
1.3 实验方法
1.3.1红曲霉X1产酯化酶的发酵培养基优化
1.3.1.1 单因素实验设计
表1为不同发酵参数单因素实验条件。以酯化酶活力为指标,选择不同碳源、碳氮比、接种量和初始pH值,研究其对红曲霉X1液态发酵产酯化酶的影响。
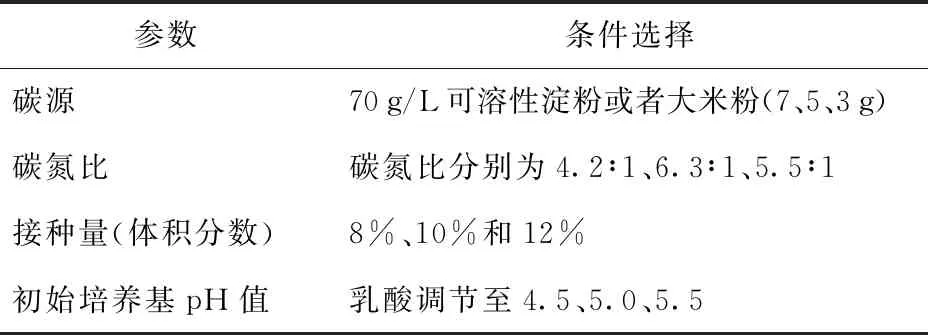
表1 不同发酵参数单因素实验条件
1.3.1.2 正交试验设计
依据单因素实验结果,以碳源、碳氮比、接种量、pH值为影响因素,酯化酶活力为指标,进行正交优化试验(表2),确定培养基最优组合。
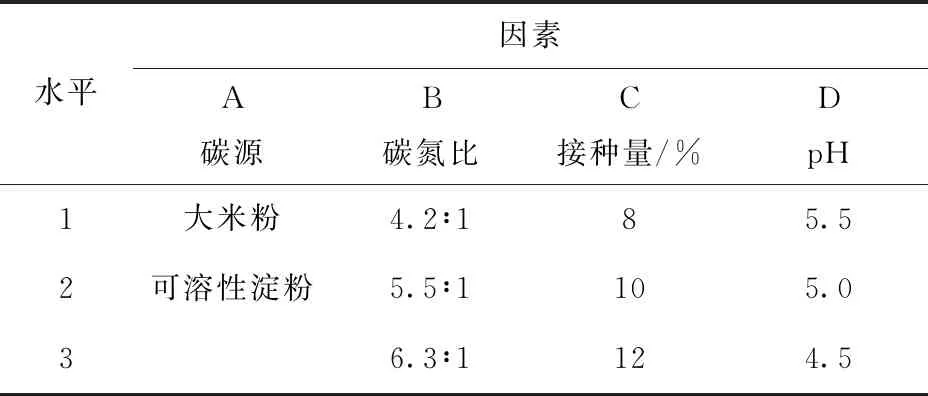
表2 正交试验设计
1.3.1.3 红曲霉X1发酵产酯化酶最适黄水添加量的确定
在单因素实验和正交试验得到的优化条件基础上,进一步研究未灭菌黄水添加量(0、5%、10%、20%(体积分数))对红曲霉菌株X1液态发酵产酯化酶的影响,得到菌株X1产酯化酶的最适黄水添加量。
1.3.2酯化液制备中最适底物添加量的确定
发酵培养基优化后,以3 000 r/min离心10 min,收集酶活最高时的发酵上清液,分两组进行实验,一组添加己酸(0、0.05%、0.10%(体积分数))和乙醇(0、0.5%、2.0%、4.0%、6.0%、8.0%、10.0%(体积分数));另一组则补加黄水(0、5%、10%、20%(体积分数)),分别制备酯化液。研究己酸、乙醇添加量和黄水补加量对酯化液制备的影响。
1.3.3发酵产物测定
乙酸、己酸、乙醇、乙酸乙酯、己酸乙酯和乳酸乙酯的测定采用气相色谱法。以8 000 r/min离心发酵液,取上清液,过0.22 μm滤膜后进样检测。检测条件为:气相色谱仪配备FID检测器(450GC,德国布鲁克公司),AT. LZP- 930白酒毛细管专用色谱柱(30 m×0.32 mm×1.0 μm,中国科学院兰州化学物理研究所),进样口温度200 ℃,检测器温度200 ℃,柱流速5.00 mL/min,载气为氦气(纯度99.99%),载气流速25 mL/min,氢气30 mL/min,空气流速300 mL/min。分流比10∶1,进样量1 μL。程序升温条件初始温度60 ℃,保持5 min,以5.0 ℃/min连续升温至180 ℃并保持3 min。
1.3.4酯化酶酶活力测定
采用1-萘酚比色法对酯化酶酶活力进行测定[15]。酶活力定义:在37 ℃条件下,15 min水解1-醋酸萘酯产生1.0 nmol 1-萘酚所需酶量为1个酶活力单位(U)。
2 结果与讨论
2.1 发酵培养基对红曲霉X1产酯化酶的影响
以酯化酶活力为指标,选择不同碳源、碳氮比、接种量和初始pH值,研究其对红曲霉X1液态发酵产酯化酶的影响,实验结果如表3。
2.1.1碳源对X1菌株产酯化酶活力的影响
表3中,以大米粉为碳源,发酵液上清液中酯化酶活力为435.05 U/mL;以可溶性淀粉为碳源时,酯化酶活力仅为302.35 U/mL,差异明显。二者差异可能是由于其淀粉含量及性状不同导致培养液黏度不同,使X1生长条件不同,因而酯化酶活力存在差异。另外,大米粉营养更丰富,原料来源广泛,价格低廉,虽然溶解性相对较差,但从酶活力结果来看,不影响X1菌株生长及酯化酶产生。
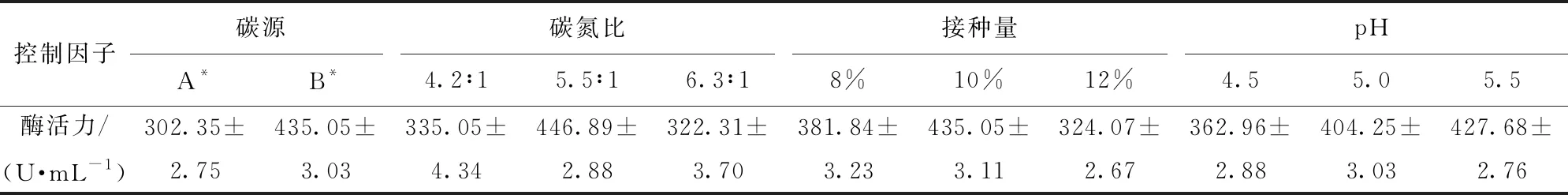
表3 碳源、碳氮比、接种量和pH值对X1菌株液态发酵产酯化酶活力的影响
碳源A*、B*分别为可溶性淀粉和大米粉。
2.1.2碳氮比对X1菌株产酯化酶活力的影响
碳氮比对微生物生长及代谢影响较大,若培养基碳源不足,易引起菌体衰老和自溶,而碳源过高,容易发生底物抑制,培养基酸化,不利于菌体生长;若氮源过多,菌体生长过于旺盛,不利于代谢产物积累[16]。霉菌细胞中碳氮比大约为10∶1,一般工业发酵培养基碳氮比约为50∶1,由于酯化酶是一类蛋白酶,在发酵过程中氮源消耗多,因此,通过降低培养基中碳氮比,可提高酯化酶的产量[17]。本研究中,当培养基中碳氮比为5.5∶1时,红曲霉X1发酵液中酯化酶活力最高,为446.89 U/mL,说明此碳氮比有利于X1菌株酯化酶生产。
2.1.3接种量对X1菌株产酯化酶活力的影响
接种量对微生物生长繁殖代谢尤为重要。在发酵工业中,霉菌的接种量一般为7%~15%(体积分数)。采用较大接种量,可缩短发酵过程中菌体繁殖达到高峰的时间,加速酯化酶产生,并减少杂菌污染;但接种量过大,易引起菌体竞争,菌种活力不足,导致酯化酶活力下降。本研究中,当红曲霉接种量为10%时,发酵液中酯化酶活力为435.05 U/mL,适合X1菌株生长及酯化酶产生。
2.1.4初始pH值对X1菌株产酯化酶活力的影响
利用乳酸控制初始发酵培养基pH值为5.5时,发酵液中酯化酶活力为427.68 U/mL;pH值为5.0时,发酵液中酯化酶活力为404.25 U/mL,仅比pH值5.5的发酵液酶活力低23.43 U/mL。因此,pH值5.0和pH值5.5的培养基条件均较适合X1菌株生长及酯化酶产生。
2.1.5X1菌株产酯化酶发酵培养基正交试验优化结果
在单因素实验基础上,以大米粉为碳源,控制碳氮比5.5∶1,接种量10%,pH值5.0为条件进行正交试验,试验结果如表4。由于正交试验得到的优水平和优组合不统一,须对正交结果进一步验证,结果如表5。2号试验组(优组合)的结果相对高于1号试验组(优水平),即大米粉为碳源,碳氮比为5.5∶1,接种量为10%,pH值为5.0的培养条件较合适。
由表5可知,X1菌株液态发酵产酯化酶的优化培养基为(含量以100 mL计):大米粉7 g,大豆蛋白胨2 g,NaNO30.2 g,KH2PO40.15 g,MgSO4·7H2O 0.1 g。优化培养条件为:500 mL三角瓶中装液量50 mL,初始pH值5.0,接种量10%,培养温度30 ℃,摇床转速180 r/min,培养时间4 d。
2.1.6黄水添加对X1菌株液态发酵产酯化酶的影响
黄水中含有少量白酒酿造过程中未利用的淀粉、残糖及氨基酸等物质[18],可作为红曲霉生长的营养物,而其中丰富的有机酸,可诱导红曲霉产生酯化酶,从而提高发酵液中酯化酶活力。在此,考察了黄水的添加对红曲霉X1发酵产酯化酶的影响,结果如图1。
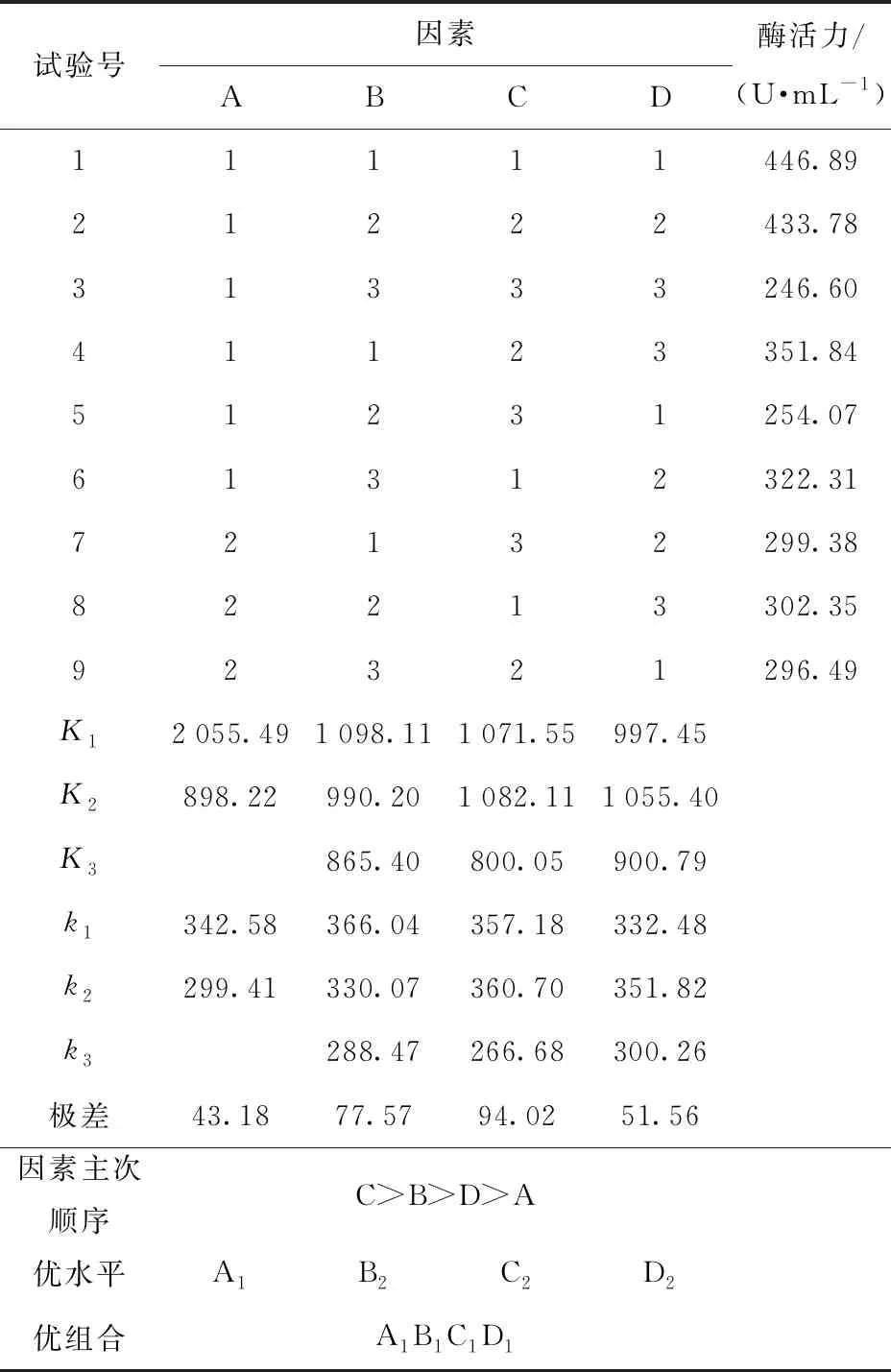
表4 X1菌株液态发酵产酯化酶正交试验结果
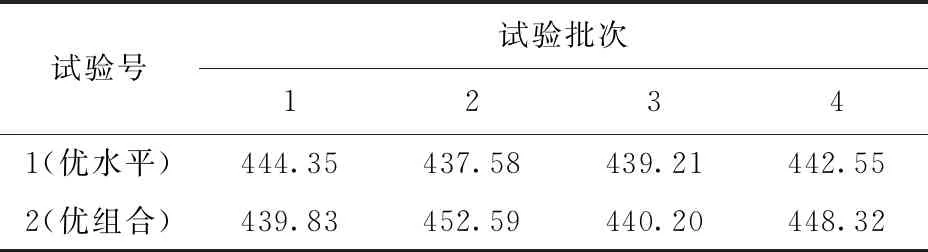
表5 X1菌株液态发酵产酯化酶正交试验结果验证

图1 黄水添加量对酯化酶酶活力的影响Fig.1 Effect of yellow water addition in esterifying enzyme activity
在空白组和实验组中,发酵上清液中酯化酶活力均呈先升高后降低趋势。空白组发酵液中酯化酶酶活力在第2天时比实验组高,为211.50 U/mL,且增长最快,第4天达到酶活力高峰(489.45 U/mL),之后开始下降,在第6天时酶活力下降到392.07 U/mL,为最高时的80.1%;实验组红曲霉X1均存在较长的生长适应期,在添加5%、10%、20%黄水组,酶活力分别在第4天、5天和5天达到最高(723.38、765.95、590.98 U/mL)。由此可见,添加5%~20%黄水可提高酯化酶产量,其中10%效果最好;分别添加30%、40%黄水时,抑制了红曲霉X1的生长,酯化酶活力未检出,这可能是由于过量黄水的添加导致培养基pH值较低[19];空白组,添加5%、10%、20%、30%、40%黄水组,其培养基初始pH值分别为5.41、4.60、4.29、4.08、3.98、3.92。pH值对微生物生长和产酶有一定的影响,从而造成酯化酶活力不同。因此,添加适量黄水能够促进红曲霉X1生长过程中产生酯化酶。
2.2 不同酯化底物的添加对酯化液制备的影响
2.2.1己酸、乙醇的添加对酯化液制备的影响
发酵培养基优化后,以酯化酶活力最高的发酵上清液催化不同体积分数的己酸和乙醇制备酯化液,研究己酸和乙醇的添加对酯化液制备的影响,实验结果如图2。由图2可知,随着己酸添加量的增加,己酸乙酯生成量也随之增加,但己酸利用率却随着己酸含量的增加呈现先增加后降低趋势。在空白组中,己酸乙酯体积分数仅为0.004 8%;当己酸添加量为0.8%时,己酸利用率达到最大,为7.61%,此时己酸乙酯体积分数为0.029%,较空白组增加了5倍。当己酸添加量为0.8%时,己酸利用率高,己酸乙酯生成量较大。而当己酸添加量高于0.8%时,由于pH值降低导致酶活力下降,己酸利用率也随之降低,导致己酸乙酯产量与己酸添加量不成正比。
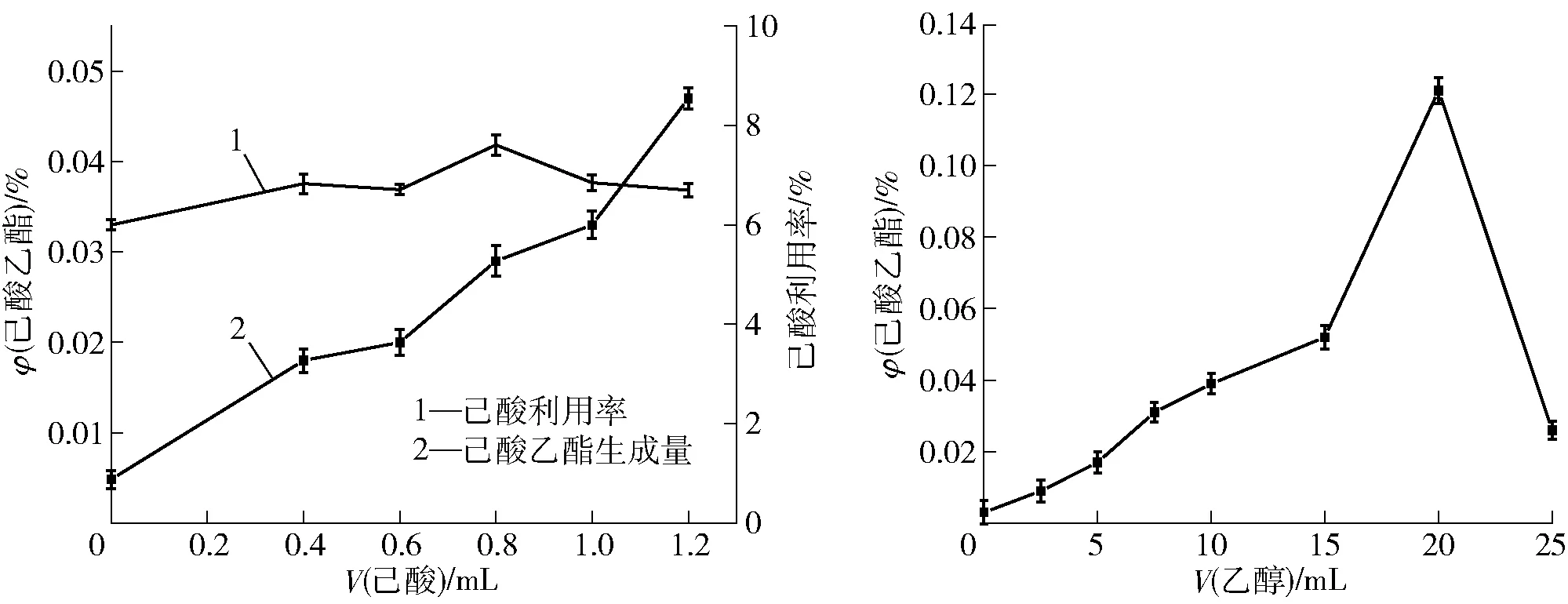
图2 己酸和乙醇添加量对酯化液中己酸乙酯生成量的影响Fig.2 Effect of hexanoic acid and ethanol addition on production of ethyl caproate in esterification liquid
在己酸最优(0.8%)条件下,随着乙醇添加量的增加,己酸乙酯浓度呈现先增加后降低趋势,当乙醇添加量为20%时,己酸乙酯体积分数达到0.121%;当乙醇添加量为25%时,己酸乙酯体积分数仅为最高组的21.5%。这可能是由于酯化反应所需底物乙醇的增加抑制了酯化酶活性,也可能是改变了酯化酶结构降低了酯化速率,导致己酸乙酯生成量减少[20]。
2.2.2未灭菌黄水添加量对酯化液制备的影响
在酯化酶活力最高的发酵上清液中补加不同体积分数的黄水制备酯化液,研究黄水添加量对酯化液制备的影响,实验结果如图3。
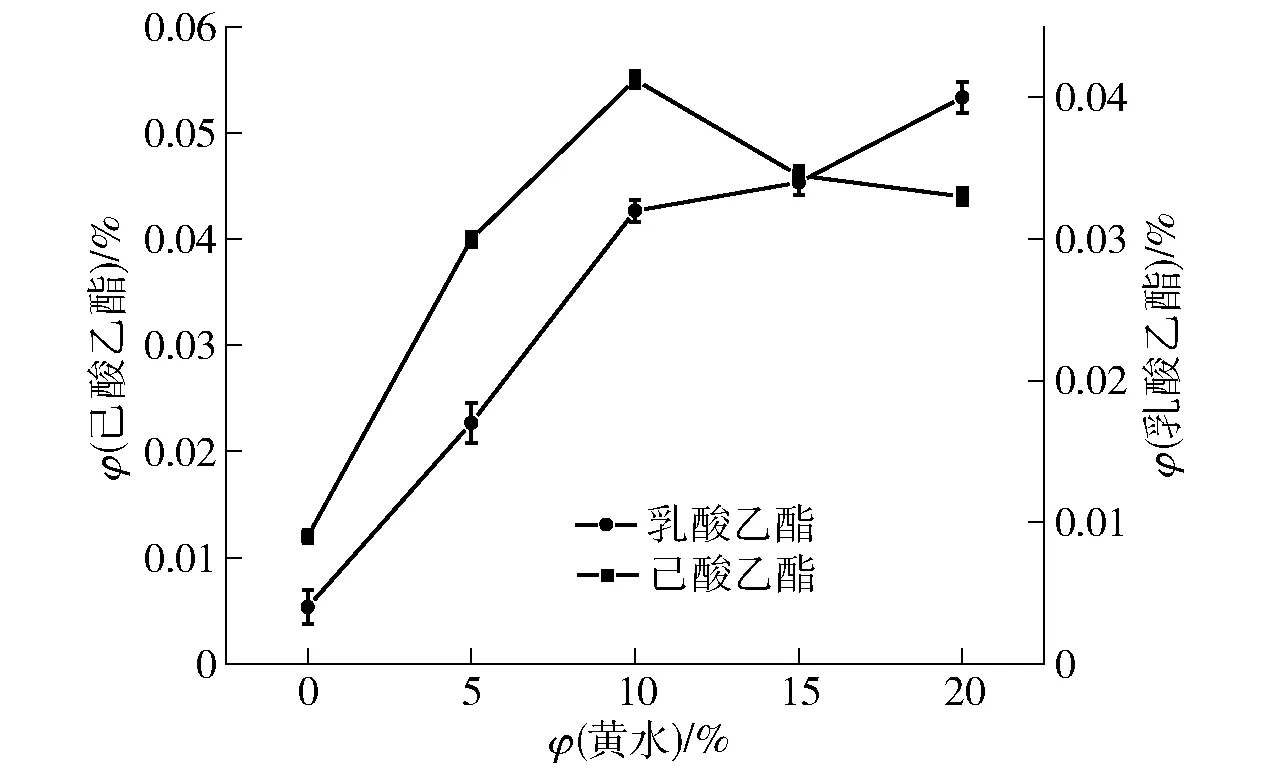
图3 黄水添加量对酯化液中乳酸乙酯、己酸乙酯生成量的影响Fig.3 Effect of yellow water addition on production of ethyl lactate and ethyl caproate in esterification liquid
由图3可知,随着黄水添加量的增加,乳酸乙酯浓度呈递增趋势,己酸乙酯浓度先增加后降低。当黄水添加量为10%时,乳酸乙酯体积分数为0.032%,己酸乙酯体积分数达到0.055%。随着黄水添加量的增加,乳酸乙酯增幅不明显,而己酸乙酯浓度开始降低,这可能是由于在酯化反应体系中,乳酸和己酸作为竞争性底物,在一定范围内,两者均随着底物浓度增加而呈现增加趋势,超过此范围,两者出现竞争而乳酸更占优势,己酸乙酯的合成便会减少;也可能是由于在该培养基条件下,合成的酯化酶中乳酸乙酯合成酶活性高于己酸乙酯合成酶活性[21]。
当在红曲霉X1发酵培养基中,加入体积分数为0.8%的己酸和体积分数为20%的乙醇继续培养1 d后,酯化液中己酸乙酯体积分数可达0.121%;而向酯化酶液中补加体积分数为10%黄水后,己酸乙酯和乳酸乙酯体积分数分别可达0.055%和0.032%,总酯体积分数为0.087%。
3 结 论
研究了红曲霉MonascussanguineusX1处理黄水的培养基优化及酯化液制备条件。结果表明:该红曲霉优化发酵培养基组分(以100 mL计):大米粉7.0 g,大豆蛋白胨2.0 g,NaNO30.2 g,KH2PO40.15 g,MgSO4·7H2O 0.1 g,培养基初始pH值5.0,接种量 10%(体积分数)。在此条件下,加入体积分数为0.8%的己酸和体积分数为20%的乙醇继续培养1 d后,酯化液中己酸乙酯体积分数可达0.121%;而向酯化酶液中补加体积分数为10%的黄水后,己酸乙酯和乳酸乙酯的体积分数分别可达到0.055%和0.032%,总酯体积分数为0.087%。
利用微生物酶法生产酯类物质不仅反应条件温和、能耗低,反应速率和转化率高,而且产品纯度高,香味自然纯正,使白酒风味柔和、香醇自然,可增强其固态感和自然感。浓香型白酒酯化液以酿酒副产物黄水、酒尾、尾水等为原料,加入酶制剂、己酸,人为控制酯化液发酵条件,可以较快地得到高酯生物发酵液。许多酒厂都在积极使用酯化液发酵技术来生产高酯调味酒,提高浓香型白酒的优质品率,增强酒体协调性等,并使酿酒副产物得到综合利用,实现清洁生产,提高浓香型白酒的质量。
