燕麦黄酒发酵过程中微生物群落结构变化及对高级醇的影响
2020-02-05孙乐平徐嘉良刘敬科
孙乐平, 张 伟, 徐嘉良, 刘敬科, 邢 旋, 任 清,*
(1.北京工商大学 轻工科学技术学院, 北京 100048; 2.河北农业大学 食品科技学院, 河北 保定 071001;3.河北省农林科学院 谷子研究所, 河北 石家庄 050035)
黄酒是世界三大古酒之一,源自中国,是中华民族的瑰宝。黄酒通常以稻米和黍米等谷物为主要原料,利用麦曲等作为糖化发酵剂,通过蒸煮、加曲、糖化、发酵、过滤、煎酒、贮存等工艺酿制而成[1-2]。黄酒不仅营养丰富,而且具有独特的风味[3]。高级醇是黄酒中的重要风味物质,是含3个以上碳原子醇类的总称。黄酒中的高级醇主要为异丁醇、异戊醇、异丙醇、正己醇、β-苯乙醇和正丙醇等[4]。适量的高级醇赋予黄酒特有的醇香、丰满圆润和协调的口感,但高级醇的含量过高,会产生异杂味和较强的致醉性[5],因此,控制黄酒中的高级醇含量对提高黄酒品质具有重要意义。
高级醇是在发酵过程中由微生物代谢产生,包括氨基酸降解代谢和糖代谢合成两种途径[6]。在降解代谢途径中,蛋白质水解生成氨基酸,氨基酸在转氨酶的作用下,将氨基转移给α-酮戊二酸形成谷氨酸和α-酮酸,α-酮酸经脱酸、还原后形成比原氨基酸少一个碳的高级醇;在合成代谢途径中,葡萄糖经过糖酵解作用和三羧酸循环产生了α-酮酸中间体,在酮酸脱羧酶和脱氢酶的作用下还原形成相应的高级醇。
目前,黄酒的酿造原料除稻米和黍米外,玉米、高粱、苦荞等具有高营养、低食用性的作物也用来酿造黄酒,以期扩大黄酒原料,增加农作物附加值。相比其他谷物,燕麦具有更加独特的营养特性,蛋白质含量高,氨基酸组成均衡,富含维生素、蒽酰胺和酚类等抗氧化物质[7-8]。已有学者使用燕麦作为黄酒的酿造原料,研究燕麦黄酒发酵工艺及燕麦黄酒的抗氧化活性[9-10],但作为影响黄酒营养特性和质量特性的高级醇含量及其与微生物间的代谢关系少见报道。本研究旨在检测燕麦黄酒发酵过程中的高级醇变化和微生物动态,分析高级醇产生的微生物机制,为燕麦黄酒品质控制提供理论依据。
1 材料与方法
1.1 实验材料
燕麦,坝莜1号(张家口市农业科学院提供);黄酒酒曲,北宗黄酒麦曲。
1.2 仪器与设备
50/30 μm DVB/CAR/PDMS固相微萃取纤维头和57330- U型固相微萃取手柄,美国Supelco公司;2010 PLUS型气相色谱质谱仪,日本岛津株式会社;E.Z.N.A.土壤DNA试剂盒,美国Omega Bio-Tek, Norcross, GA公司;GeneAmp 9700型PCR仪,美国ABI 公司;Illumina MiSeq平台,美国Illumina公司。
1.3 实验方法
1.3.1燕麦黄酒的酿造
将燕麦淘洗干净并浸泡24 h,加入3倍去离子水煮熟,加入0.1%糖化酶糖化60 min,随后加入15%的黄酒酒曲拌匀,装入黄酒发酵罐中28 ℃下发酵10 d。每两天取样一次,取约10 g样品4 000r/min离心10 min,取上清液,用于测定高级醇。剩余约30 g样品转移到无菌离心管中,储存在-80 ℃冰箱中用于提取DNA。每个样品(记作:OD0、OD2、OD4、OD6、OD8、OD10)取3组平行,共计测定18个样品(记作:OD0_1至OD0_3,OD2_1至OD2_3,OD4_1至OD4_3,OD6_1至OD6_3,OD8_1至OD8_3,OD10_1至OD10_3)。
1.3.2燕麦黄酒中高级醇的测定
通过顶空固相微萃取/气相色谱- 质谱联用仪(HS-SPME/GC- MS)分析酒样中的高级醇种类及含量。取0.5 mL燕麦黄酒发酵液加入SPME玻璃小瓶顶空瓶中,再加入5.44 mL体积分数为15%的乙醇和60 μL内标物(2-辛醇,质量浓度为8 800 μg/L)。将萃取纤维头插入SPME小瓶中,50 ℃温水浴下超声萃取45 min。萃取结束后,将萃取纤维头插入GC- MS进样口,在250 ℃下热解吸7 min。通过DB- 气相色谱柱(30 m×0.25 mm×0.25 μm)分析样品。
GC- MS条件:初始温度为40 ℃,保持3 min,以6 ℃/min的速率升高至100 ℃,以10 ℃/min的速率升高至230 ℃并保持7 min。载气为纯度大于99.999%的高纯度氦气,不分流,气体流速为1.0 mL/min,进样器和检测器温度均设定为250 ℃,离子源温度设定为230 ℃。质谱仪的电离方式为电子轰击电离(EI),EI发射电流为50 μA,EI的离子能量为70 eV。m/z扫描33~400 u范围内的总离子流。通过NIST谱库对比出高级醇。
高级醇的半定量分析是通过2-辛醇作为内标进行。通过用GC- MS检测的高级醇和内标的峰面积代入式(1),计算燕麦黄酒中高级醇的含量。
(1)
式(1)中:C为燕麦黄酒中某种高级醇的质量浓度,μg/L;Cis为样品中内标物的质量浓度,μg/ L;Ac为燕麦黄酒中待测高级醇的峰面积;Ais为内标物峰面积。
1.3.3燕麦黄酒发酵中微生物多样性的测定
利用土壤DNA试剂盒从发酵物中抽提微生物DNA。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA质量和纯度。通过聚合酶链式反应(PCR)扩增细菌的16S rRNA基因的V3~V4高变区。PCR反应体系的过程设定为:95 ℃ 5 min;95 ℃ 30 s;55 ℃ 30 s;72 ℃ 40 s;72 ℃延伸10 min,25个循环,引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。同时,通过PCR扩增真菌的ITS1区域,PCR反应体系的过程设定为:95 ℃ 2 min;95 ℃ 30 s;61 ℃ 30 s;72 ℃ 45 s,30个循环,72 ℃延伸10 min。引物为ITS1F(5′-AxxxCTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-BGCTGCGTTCTTCATCGATGC-3′)[11]。PCR 产物用2%琼脂糖凝胶电泳检测。纯化的扩增子以等物质的量比汇集,并在Illumina MiSeq平台上进行测序(2×300)。
Miseq测序得到的PE reads先根据overlap关系进行拼接,同时对序列质量通过Trimmomatic进行质控和过滤,通过FLASH做数据合并,进行OTU(operational taxonomic unit)聚类分析和物种分类学分析。使用Usearch (版本7.0 http://drive5.com/uparse/)以97%相似性为截止值对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,最终生成OTU表格。采用RDP classifier贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析,分别在各分类水平:domain(域)、kingdom(界)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种)统计各样本的群落组成。16S细菌和古菌核糖体使用Silva数据库[10](Release128 http://www.arb-silva.de);ITS 真菌使用Unite[11](Release 7.0 http://unite.ut.ee/index.php)真菌数据库。基于OTU聚类分析结果,进行多样性指数分析;基于分类学信息,可以在各个分类水平上进行群落结构的统计。
通过单样本的多样性(Alpha多样性)分析微生物群落的多样性,使用Simpson指数估算样本中微生物多样性,Simpson指数值越大,说明群落多样性越低。通过计算物种之间的相关性,构建物种相关性网络,当物种与物种之间的相关系数符合0.05阈值时则构建连线。最后使用Networkx复杂网络分析工具包,获得物种和样本的组内相关信息。16S功能预测则是通过PICRUSt对OTU丰度表进行标准化,去除16S marker基因在物种基因组中的拷贝数目的影响,根据KEGG数据库的信息,获得代谢通路的3个水平信息,并分别得到3个水平的代谢路径丰度表。
1.3.4燕麦黄酒中高级醇与微生物关联分析
为将高级醇代谢与微生物代谢联系起来,利用皮尔逊(Person)相关性建立了高级醇和属水平微生物的显著性关联。使用Benjamini-Hochberg方法通过FDR调整P值和P校正值,利用R语言编程,根据所有重要的关联构建关联网络,P值设定为P≤0.05。
2 结果与分析
2.1 高级醇在燕麦黄酒发酵过程中的动态变化
通过GC- MS检测以燕麦为原料酿造黄酒过程中高级醇的种类及含量,结果见表1。由表1可见,整个发酵过程中共检测到包括β-苯乙醇在内的18种高级醇,其中发酵末期(第10天)检测到6种高级醇,分别是β-苯乙醇、异戊醇、异丁醇、2-甲基-2-乙基- 十三醇、1-十六烷醇和2-[2-(乙烯氧基)乙氧基]乙醇。高级醇的总含量在发酵末期达到最大值,为(15 011.968±6.050)μg/L。所有高级醇中,稳定存在的高级醇(检出次数≥4)包括:β-苯乙醇、异戊醇、2-甲基-2-乙基- 十三醇和1-十六烷醇。在投料当天,即发酵第0天,(Z,Z)-2-(9,12-十八碳二烯基氧基)- 乙醇是最主要的高级醇,占当日高级醇总检出量的43.13%;发酵第2天的主要高级醇是β-苯乙醇,占当日高级醇总检出量的50.80%;在发酵的第4天,β-苯乙醇和异戊醇都具有较高的含量,分别占当日总检出量的40.22%和44.33%;在发酵第6天和第10天,2-甲基-2-乙基- 十三醇都具有较高的含量,分别占各天高级醇总检出量的56.89%和58.19%。同时,在整个发酵过程中,2-甲基-2-乙基- 十三醇具有最高的单次检出量,为(8 734.937±0.905) μg/L。3,3-二甲基-2-戊醇、植物醇和叔十六烷硫醇仅在投料当天被检测到。
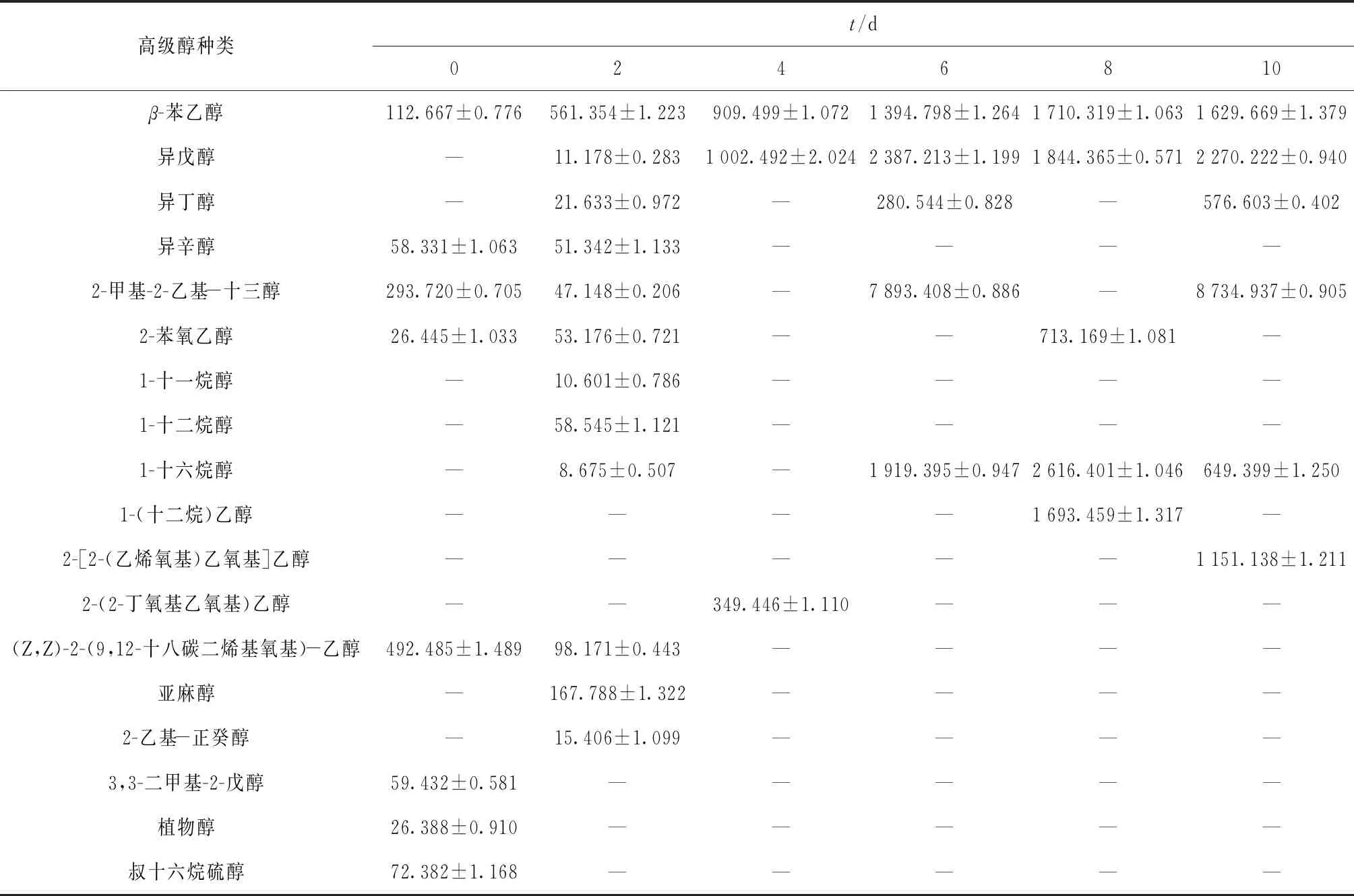
表1 高级醇在燕麦黄酒发酵过程中的变化
“—”表示未检出。
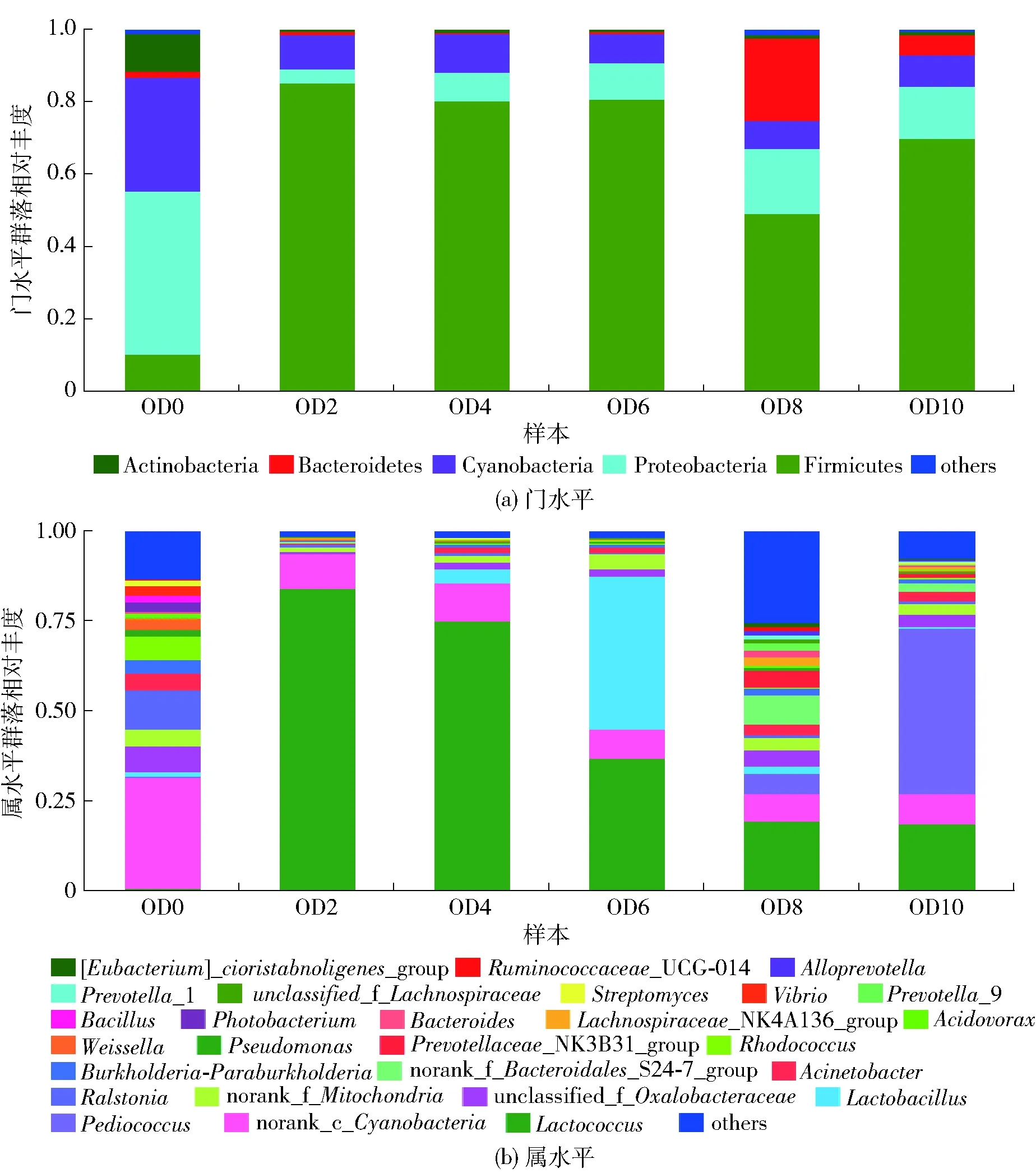
图1 燕麦黄酒发酵过程中细菌门水平和属水平的多样性Fig.1 Bacterial diversity during fermentation of oat Huangjiu on phylum level and genus level
2.2 燕麦黄酒发酵过程中的细菌多样性
采用MiSeq二代测序技术研究燕麦黄酒中细菌多样性,经过有效序列筛选后18个样品共获得791 608个有效序列,在各个生物学分类水平上分别获得:1界,27门,50纲,104目,192科,413属;在3%非相似度(cutoff)水平上分析发酵液中细菌多样性,获得1 124个OUT。燕麦黄酒发酵过程中细菌多样性如图1。门水平上的最优势菌门为厚壁菌门(Firmicutes),其相对丰度呈先急剧升高后缓慢降低再稍有回升的趋势;变形菌门(Proteobacteria)是次优门,其相对丰度呈现先急剧降低再逐渐缓慢升高的趋势;拟杆菌门(Bacteroidetes)在发酵第8天呈现较高的相对丰度。属水平上乳球菌属(Lactococcus)是最优势属,从发酵第2天起,其相对丰度呈现不断降低的趋势;乳杆菌属(Lactobacillus)在第6天有较高的相对丰度;片球菌属(Pediococcus)在发酵第10天有较高的相对丰度。
通过Alpha多样性分析(Simpson指数)发现(如图2),发酵过程中微生物的细菌多样性在投料开始时较高,在发酵第2天急剧降低,随后逐渐升高。
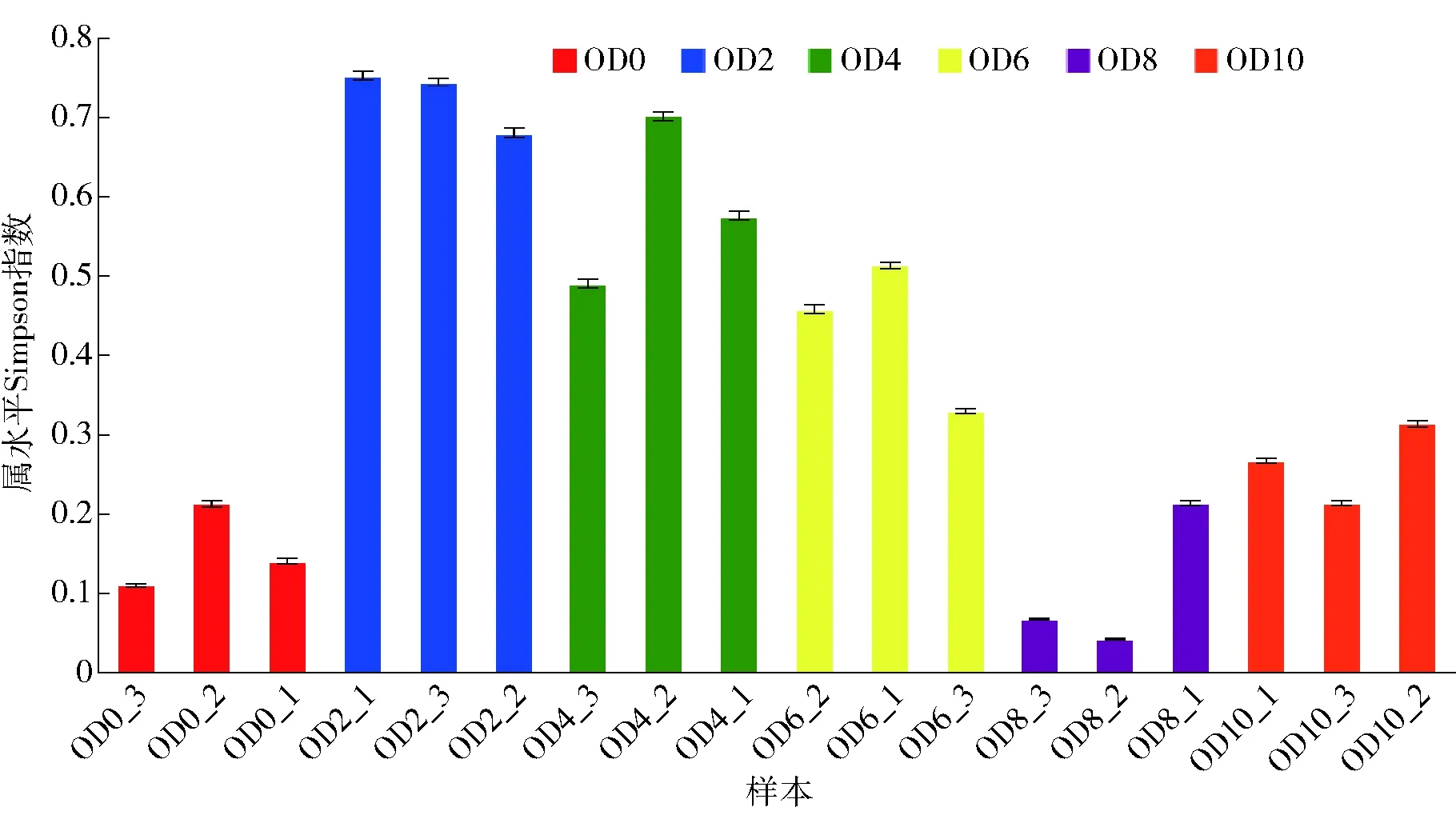
图2 燕麦黄酒发酵过程中细菌Alpha多样性分析Fig.2 Bacterial Alpha diversity analysis during fermentation of oat Huangjiu
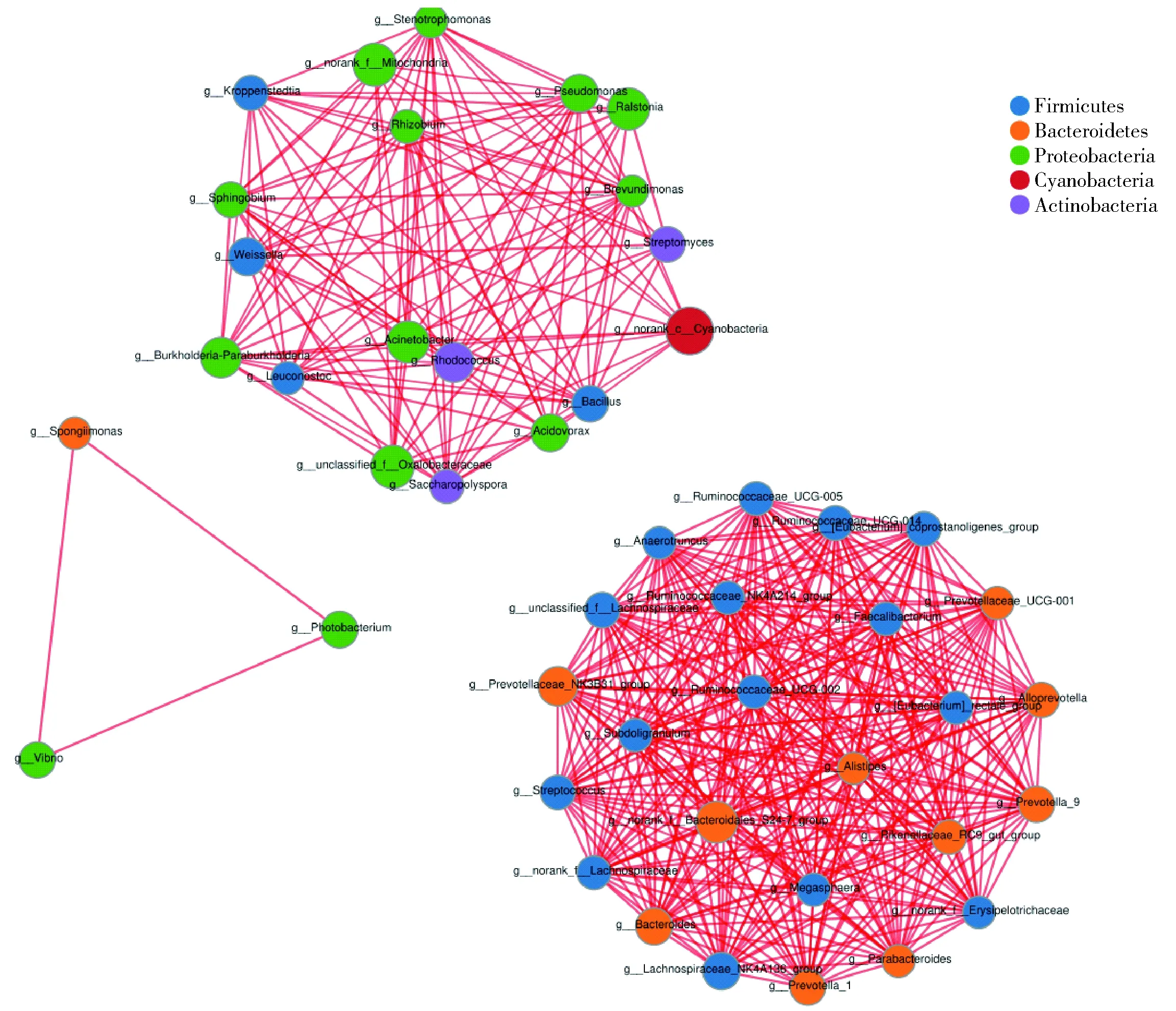
图3 燕麦黄酒细菌相关性网络分析Fig.3 Bacterial network analysis of oat Huangjiu
对不同发酵时间样本间的物种丰度信息进行相关性分析,物种在黄酒发酵样本中的共存在关系和物种间的相互作用情况如图3。所有菌属间所建立的相关性均为正相关,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的多属微生物之间建立了复杂的独立正相关性;Spongiimonas、发光杆菌属(Photobacterium)和弧菌属(Vibro)相互间建立正相关并且未与其他菌属建立相关性。
根据Kyoto Encyclopedia of Genes and Genomes (KEGG)数据库的信息,可以获得代谢通路信息,用PICRUSt获得代谢通路的3个水平信息,level 1和level 2水平的丰度如图4。膜运输、氨基酸代谢和碳水化合物代谢是相对丰度最高的代谢通路。
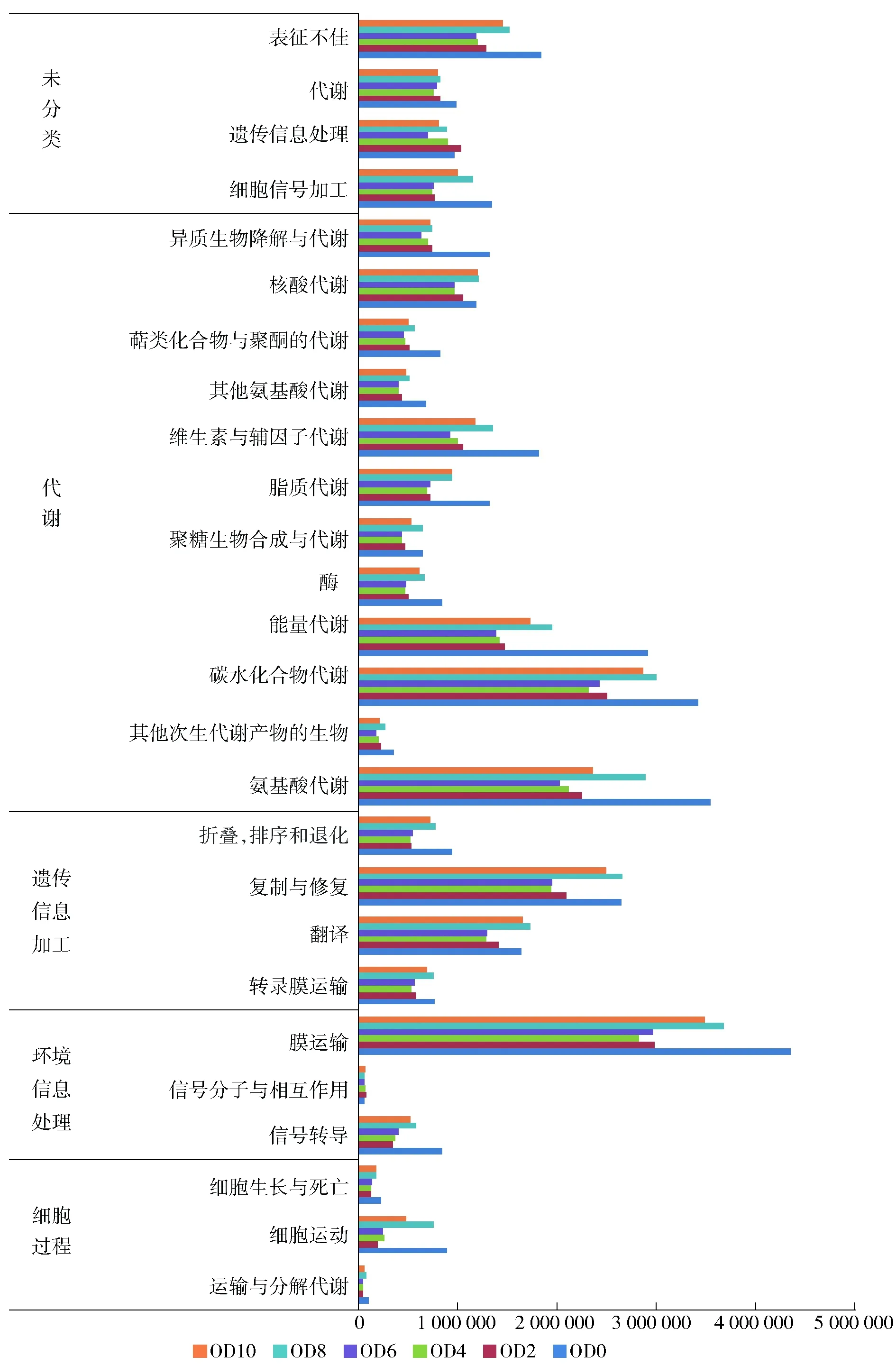
图4 KEGG代谢通路水平1和水平2相对丰度Fig.4 Relative abundance of KEGG pathway on level 1 and level 2
2.3 燕麦黄酒发酵过程中的真菌多样性
对18个样品进行测序,研究发酵物的真菌多样性,优化后共得到648 999个序列,在各个分类水平上分别包括1界、3门、4纲、4目、8科、8属。在3%非相似度(cutoff)水平上分析发酵液中真菌多样性,获得13个OUT。燕麦黄酒发酵液中的门水平和属水平的微生物相对丰度如图5。图5中,门水平上子囊菌门(Ascomycota)占有绝对的优势,其相对丰度为99.97%~100.00%;属水平上酵母菌属(Saccharomyces)是最具优势的菌属,其相对丰度为99.72% ~ 99.98%。
通过Alpha多样性分析(Simpson指数)(如图6)发现,发酵过程中的微生物真菌多样性无明显变化,且真菌多样性较低。
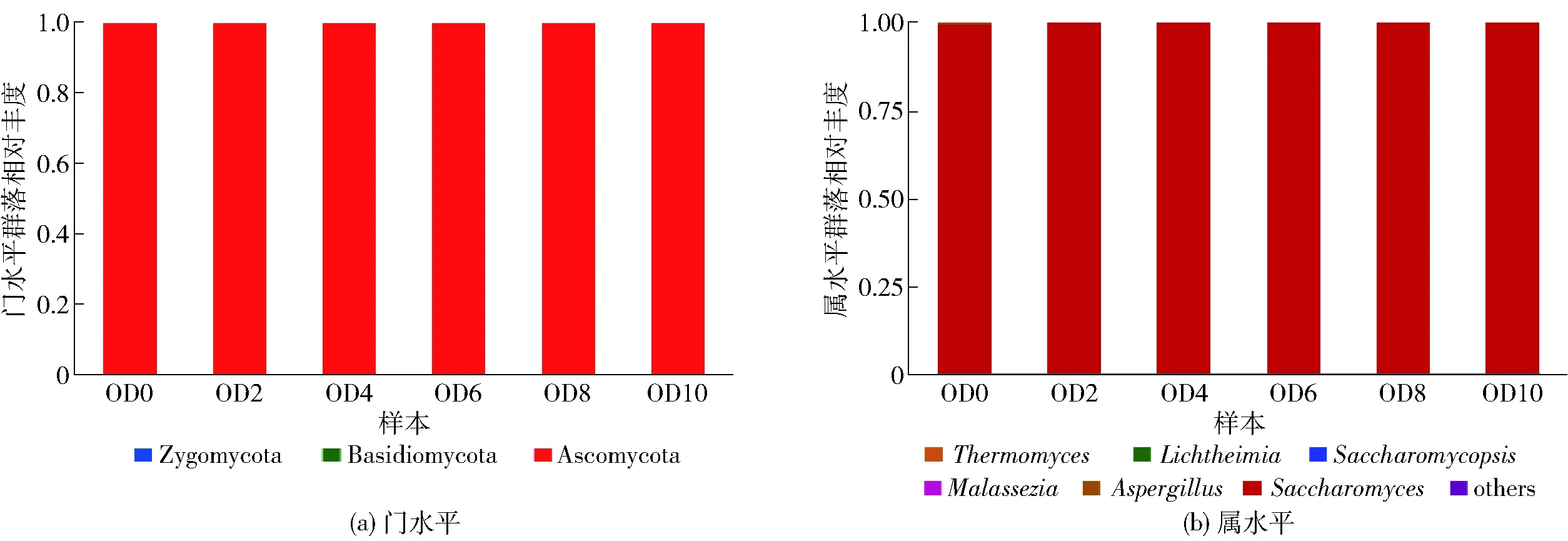
图5 燕麦黄酒发酵过程中真菌门水平和属水平的多样性Fig.5 Fungal diversity during fermentation of oat Huangjiu on phylum level and genus level
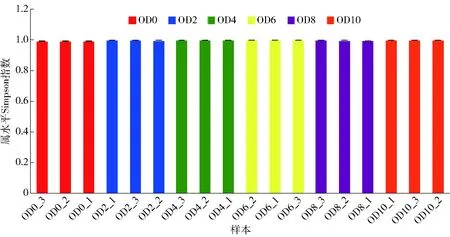
图6 燕麦黄酒发酵过程中真菌Alpha多样性分析Fig.6 Fungal Alpha diversity analysis during fermentation of oat Huangjiu
2.4 燕麦黄酒中微生物与高级醇代谢的相关性预测
利用Person相关性预测燕麦黄酒发酵过程中微生物与高级醇的关联,设定P≤0.05,在检测到的18种高级醇中有16种高级醇与297属微生物共建立了869项关联。1-(十二烷)乙醇与153属微生物建立了关联,是建立关联数最多的高级醇;2-苯氧乙醇与151属微生物建立了关联;3,3-二甲基-2-戊醇、植物醇和叔十六烷硫醇都与136属微生物建立了关联;(Z,Z)-2-(9,12-十八碳二烯基氧基)-乙醇与125属微生物建立关联;2-[2-(乙烯氧基)乙氧基]-乙醇、异丁醇和1-十六烷醇都仅与7属微生物建立关联;1-十二烷醇、亚麻醇、1-十一烷醇和2-乙基- 正葵醇都仅与2属微生物相关联;异辛醇和异戊醇都与嗜热真菌属(Thermomyces)建立了关联;β-苯乙醇与根霉菌属(Rhizopus)建立了关联。
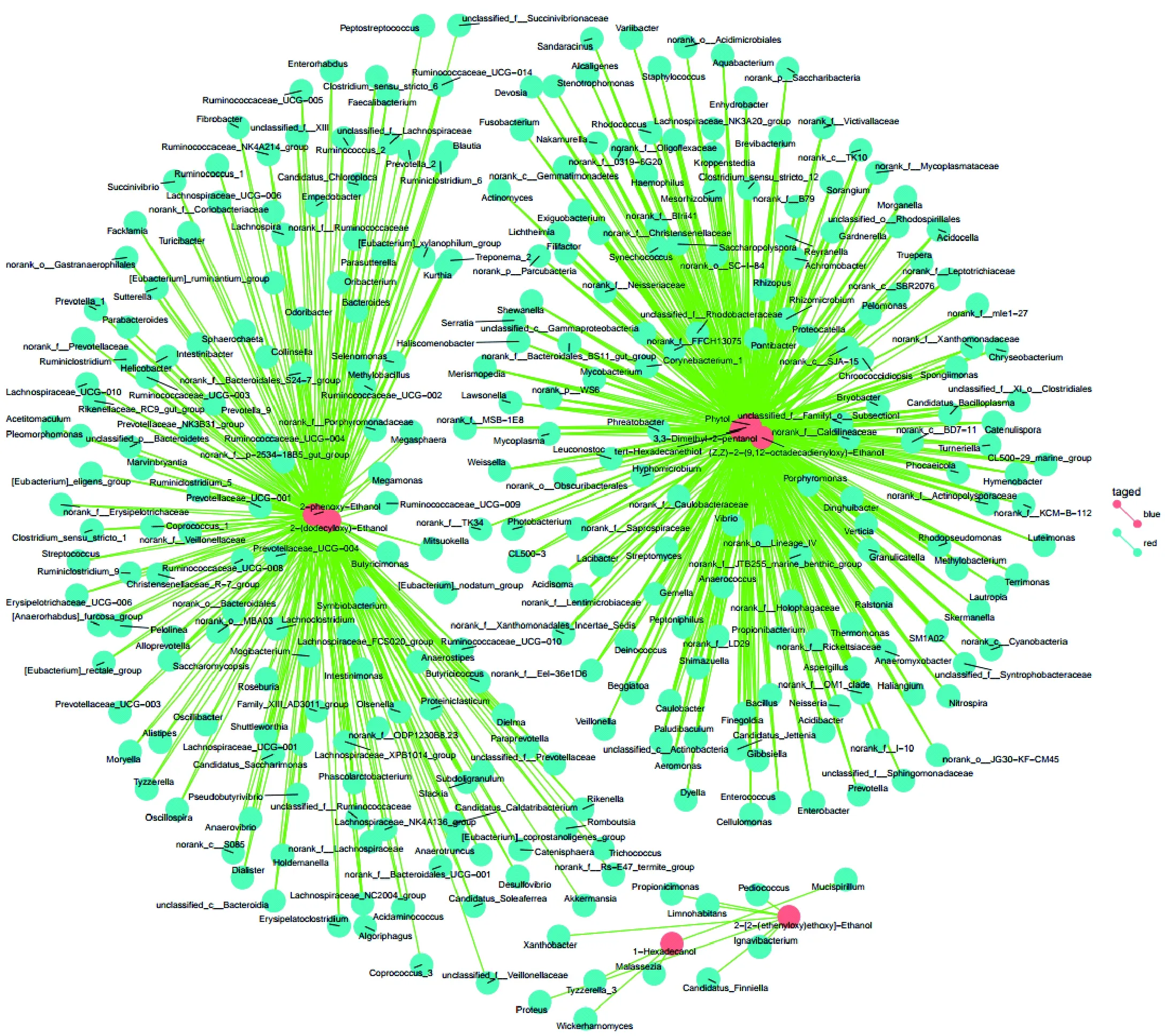
图7 FDR校正后燕麦黄酒中微生物与高级醇代谢的相关性预测Fig.7 Correlation between microorganisms and higher alcohols of oat Huangjiu after adjusting by FDR
利用False Discovery Rate (FDR)对P值进行校正,设定P(adjust)≤0.05,发现共有8种高级醇与244属微生物建立了675项更紧密的关联(如图7)。其中,1-(十二烷)乙醇仍与124属微生物建立关联,建立关联数最多;2-苯氧乙醇与118属微生物建立了紧密关联;3,3-二甲基-2-戊醇、植物醇和叔十六烷硫醇都与110属微生物建立了紧密的关联;(Z,Z)-2-(9,12-十八碳二烯基氧基)-乙醇与92属微生物建立紧密关联;2-[2-(乙烯氧基)乙氧基]-乙醇与片球菌属(Pediococcus)等7属微生物建立关联; 1-十六烷醇与马拉色氏霉菌属(Malassezia)等4属微生物建立紧密关联。高丰度的微生物中,罗尔斯通菌属(Ralstonia)和红球菌属(Rhodococcus)均与高级醇的代谢建立了关联。
3 讨 论
β-苯乙醇作为黄酒中常见的高级醇之一,是本研究中一直稳定存在的高级醇。β-苯乙醇是一种具有持久的玫瑰型香味的高级芳香醇,是玫瑰香气的主要成分,天然存在于多种植物花、叶及其提取物中,在食品领域和日用化学品中有着广泛的应用。一定浓度的β-苯乙醇能够抑制革兰氏阴性菌、球菌、杆菌以及部分真菌的生长繁殖,具有抑菌效果[12]。本研究发现,乳球菌在发酵中后期受到抑制,其抑制有可能来自β-苯乙醇。一些真菌和酵母菌株具有生产β-苯乙醇的能力[13]。KEGG数据库显示,β-苯乙醇在微生物机体内的主要代谢路径是苯丙氨酸代谢途径,其生成是通过L-苯丙氨酸去羧基生成苯乙胺,苯乙胺由于去氨基作用生成苯乙醛,苯乙醛再经还原作用生成β-苯乙醇[14]。研究表明,多种酵母,如黏红酵母(Rhodotomlaglutinis)、毕赤酵母(Pichiapastoris)、马克斯克鲁维酵母(Kluyveromycesmarxianus)、酿酒酵母(Saccharomycescerevisiae)、异常汉逊酿酒酵母(Unusualhansonsaccharomycescerevisiae)、乳酸克鲁维酵母(Kluyveromyceslactis)及真菌,如黑曲霉(Aspergillusniger)、猴头菌(Hericiumerinaceus)、白地霉(Geotrichumcandidum)具有生物转化L-苯丙氨酸生成β-苯乙醇的能力[15-17]。β-苯乙醇与苯乙醛之间可以相互转化,本研究发现,根霉属菌(Rhizopus)与β-苯乙醇的代谢呈负相关,因此,根霉菌属可能参与β-苯乙醇转化生成苯乙醛。
异戊醇是酒类发酵过程中最主要的高级醇组分。Atsumi等[18]利用13C核磁共振波谱法和气相色谱质谱法发现,亮氨酸经由Ehrlich途径代谢可得到异戊醇。异戊醇在本实验中也占有较高的比例,其含量在发酵中后期均高于β-苯乙醇,因此,控制异戊醇的产量对控制黄酒发酵中高级醇含量具有重要意义。研究表明,异戊醇的生成量不严格随酵母添加量的增多而增多[19]。异戊醇可能被分解或转化,其可能经酯化反应与酸反应生成酯,也有可能在微生物的作用下转化生成其他物质。关联分析发现,异戊醇的产生与嗜热真菌属(Thermomyces)呈负相关,嗜热真菌属可能参与异戊醇的分解代谢,可能对高级醇的控制具有积极效果。
异丁醇可用作生物燃料,同时也是人工麝香、精油和药物的重要原料[20]。Dickinson 等[21]的研究结果表明,酿酒酵母内能够通过缬氨酸代谢途径合成异丁醇,梭状芽胞杆菌是丁醇的天然生产者,能在合适的发酵条件下产生大量丁醇。本研究发现,异丁醇与片球菌属(Pediococcus)和变形杆菌属(Proteus)等7属微生物建立关联且均为正相关,它们均可作为异丁醇生产的潜在菌属,对高级醇的控制可能具有重要意义。
2-苯氧乙醇是一种略带玫瑰香味、低挥发、高沸点的无色油状液体[22],是一种重要的化工原料,主要通过工业合成的方法获取[23]。由微生物代谢产生2-苯氧乙醇尚未见报道。根据检出结果发现,2-苯氧乙醇显示出逐渐上升的趋势且在发酵初始阶段有原料带入。经过FDR校正后,2-苯氧乙醇仍与酵母属(Saccharomycopsis)等118属微生物建立关联,是建立关联数较多的高级醇,由此可推测其代谢基质较为复杂,且这118属微生物可能参与其生物代谢过程。
在检测到的18种高级醇中包括3种烷醇,分别为:1-十一烷醇、1-十二烷醇和1-十六烷醇。十二个碳原子以上蜡状固体的饱和一元醇被称为高级烷醇,含有十二个碳原子以下无色液体的链状饱和一元醇被称为低级烷醇。高级烷醇在自然界中的存在极为广泛,通常以高级脂肪酸蜡酯的形式存在,广泛分布于植物的根、茎、叶、果皮及籽仁中。高级烷醇对动植物具有多种生理活性,可显著降低胆固醇水平,具有抗血栓形成等多重作用[24]。高级烷醇在微生物体内主要有3条脂肪醇合成途径:以脂酰- ACP为底物合成脂肪醇;以自由脂肪酸为底物合成脂肪醇;以脂酰- CoA 为底物合成脂肪醇[25-27]。本研究中最主要的高级烷醇为1-十六烷醇,其含量呈现出先升高后降低的趋势。KEGG数据库显示,1-十六烷醇代谢路径主要存在于脂肪酸分解代谢过程,十六烷(脂肪酸)在长链醛脱氢酶的作用下生成十六醛[28],随后长链醇脱氢酶将十六醛转化为十六烷醇。本研究将十六烷醇与马拉色氏霉菌属(Malassezia)、威克汉姆酵母属(Wickerhamomyces)、Mucispirillum和Tyzzerella_3均建立了紧密的正相关。这些菌属与十六烷醇的相关性均大于0.95,可能参与了十六烷醇的代谢,是十六烷醇的潜在生产菌属。
酵母菌属作为生产酒精的主要微生物,是发酵过程中不可或缺的重要菌属之一。针对黄酒中高级醇的含量及种类的研究多集中于酵母品种、充氧量、酵母接种量、发酵温度等对于高级醇代谢的影响[29]。其他微生物菌属,尤其是细菌对高级醇代谢有一定影响,对细菌种类和丰度的调控可能成为调控高级醇含量的另一有效途径。以燕麦为原料酿造黄酒是黄酒酿造工业的一个新的尝试,对燕麦黄酒中重要质量指标之一的高级醇进行研究,对燕麦黄酒后续研究和开发将具有重要意义。
