天麻和苦荞复配液对灰树花胞外多糖合成的影响及其发酵动力学研究
2020-02-05吴天祥王川南
雷 露, 吴天祥,2,*, 王川南
(1.贵州大学 酿酒与食品工程学院, 贵州 贵阳 550025;2.贵州食品工程职业学院 粮油食品工程系, 贵州 贵阳 551400)
灰树花(Grifolafrondosa)是一种营养丰富、生物活性高的药食两用真菌,它的菌丝体、子实体与发酵液中分离的一类富含β-(1→6)、β-(1→3)糖苷键的真菌多糖,即灰树花多糖(Grifolafrondosapolysaccharide, GFP)让其具有很高的药用价值[1]。灰树花多糖具有抗肿瘤[2],清除自由基[3-5],抗氧化[3,7-8],提高成纤维细胞增殖,促进胶原蛋白合成等生物活性[2]。快速、高效、经济地获得药用真菌胞外多糖的方法是采用液体发酵培养。为了能最大量获得胞外多糖,在药用真菌液体发酵体系中添加一定的外源刺激物,能同时促进菌体细胞的生长和次生代谢产物(如EPS)的生物合成[9]。
近年来,众多学者在利用药用真菌液体转化方面进行了大量的研究,Yang等[10]研究发现在灵芝液体发酵中添加薏苡仁油能显著促进灵芝菌丝体的生长;Lin等[11]发现枸杞水提取物的添加能显著促进云芝液体发酵液菌丝体的增加。本课题组前期研究结果表明,天麻醇提物的添加可以显著促进灰树花细胞生长和胞外多糖的合成[12-15]。赵亮等[16]在灰树花发酵体系中,添加山药、苦荞提取物均对灰树花胞外多糖的产量有促进作用。目前,国内外学者针对添加外源提取物增加胞外多糖产量的研究限于单一添加物,对复配物的添加作用研究较少。
在此基础上,本实验在灰树花深层发酵体系中同时添加2种外源添加物,即天麻和苦荞复配液。分析对灰树花胞外多糖产量和菌丝体生物量的影响,并动态分析了发酵过程中的胞外多糖含量、菌体质量、残糖(还原糖)含量、pH值的变化,以期为今后研究复配液对提高灰树花多糖产量的影响提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
灰树花(菌种编号5.404),中国普通微生物菌种保藏管理中心;苦荞籽粒,贵州省威宁县苦荞种植基地;天麻,贵州省德江县天麻种植基地。
斜面培养基为马铃薯葡萄糖琼脂(PDA)培养基。液体种子培养基(g/L):葡萄糖 30,KH2PO40.5,蛋白胨2,MgSO4·7H2O 0.5,酵母膏 6,自然pH值。发酵培养基(g/L):葡糖糖 50,KH2PO42,蛋白胨5,MgSO4·7H2O 2,酵母膏10,自然pH值。
1.2 仪器与设备
BXM- 30R型立式灭菌锅、GZX- 9070 MBE型数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;SW- CJ- 1D型净化工作台,苏州净化设备有限公司;SG8200HPT型超声波清洗机,上海冠特超声仪器有限公司;GL- 20G- Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;CP114型电子天平,上海奥豪斯仪器有限公司;L5S型紫外分光光度计,上海仪电分析仪器有限公司;TS- 2102C型恒温振荡器,上海天呈仪器有限公司。
1.3 实验方法
1.3.1灰树花菌体培养方法
1)斜面种子培养:从母种试管中用接种铲挑取黄豆粒大小的菌丝块接种于PDA斜面培养基中部,放置于25 ℃恒温培养箱中,待菌体长满整个斜面。
2)液体种子培养:将接种勺在培养好的斜面种子管中轻轻刮取蚕豆粒大小的菌丝体接种于液体种子培养基中,250 mL三角瓶装液量为100 mL,置于25 ℃、150 r/min恒温摇床培养4~7 d。
3)发酵培养:按10%的接种量,用移液枪从液体种子培养基中吸取种子液接种至发酵培养基中,250 mL三角瓶装液量为100 mL,置于25 ℃、150 r/min恒温摇床培养。三角瓶中长出大量均匀细小的菌丝球且培养液清亮为最佳。
1.3.2天麻醇提物的制备
天麻粉制备:天麻洗净,55 ℃烘干、粉碎,过80目筛备用。
天麻醇提物的制备:称取10 g天麻粉,加入100 mL体积分数75%的乙醇溶液浸提48 h后过滤,减压除去乙醇,加入蒸馏水定容到100 mL,即1 g天麻粉可得10 mL醇提液。将醇提液作为灰树花液体培养中的外源添加物。
1.3.3苦荞醇提物的制备
苦荞粉的制备:苦荞籽粒去壳、洗净,55 ℃烘干、粉碎,过80目筛备用。
苦荞醇提物的制备:称取10 g苦荞粉,分别加入350 mL体积分数65%、75%、85%、95%的乙醇溶液,80 ℃回流提取2 h后过滤,减压除去乙醇,加入蒸馏水定容到100 mL,即1 g苦荞粉可得10 mL醇提液。将醇提液作为灰树花液体培养中的外源添加物。
1.4 分析方法
1.4.1生物量的测定
灰树花菌体生长以其生物量为指标。将发酵完成后的培养基用滤纸过滤,得到灰树花菌丝体,菌丝体用蒸馏水冲洗3次,放置于60 ℃数显鼓风干燥箱中烘干至恒重,称质量即得到菌丝体干重。结果以单位体积发酵液中的菌丝体干质量为菌丝体生物量(g/L)。
1.4.2胞外多糖含量的测定
量取5 mL1.4.1中过滤后的滤液,加入4倍体积的95%乙醇溶液,于4 ℃冰箱中醇沉24 h,离心(4 000 r/min,15 min)去除上清液,将沉淀用95%的乙醇溶液洗涤3次,然后于60 ℃数显鼓风干燥箱烘干,加水于55 ℃水浴锅溶解,溶解后定容至50 mL,最后取1 mL溶液用苯酚—硫酸法测定胞外多糖含量。
1.4.3还原糖含量的测定
取1 mL1.4.1中过滤后的滤液,用蒸馏水定容至50 mL,取1 mL稀释液于25 mL的具塞比色管中,加1 mL蒸馏水,再加入1.5 mL DNS(3,5-二硝基水杨酸)试剂,摇匀后,沸水浴加热5 min,冷却至室温并定容至25 mL,于520 nm处测定吸光度。
1.5 数据分析
使用SPSS 23.0软件分析显著性,用Excel 2010软件和Origin 2017软件绘图。
2 结果与分析
2.1 苦荞醇提物对灰树花生物量和胞外多糖合成的影响
在灰树花发酵体系中添加不同质量浓度的苦荞提取物,发酵7 d后菌丝体生物量和胞外多糖产量如图1、图2。随着苦荞质量浓度的增加,灰树花菌丝体生物量和胞外多糖产量先增加至最大后降低。这说明一定质量浓度的苦荞提取物能刺激灰树花菌体生长和胞外多糖的合成,高质量浓度的苦荞提取物对灰树花的生长具有一定的抑制作用。当乙醇提取体积分数为75%,苦荞醇提物添加量为5 g/L时,对灰树花菌丝体产胞外多糖和生物量的合成具有明显的促进作用(P<0.05),分别达到最大值(1.268±0.169) g/L和(1.727±0.132) g/L时,与空白组(不加苦荞)相比,分别增加了11.35%和19.27%。根据这一结果,选取75%乙醇用于苦荞提取,进行后期实验。
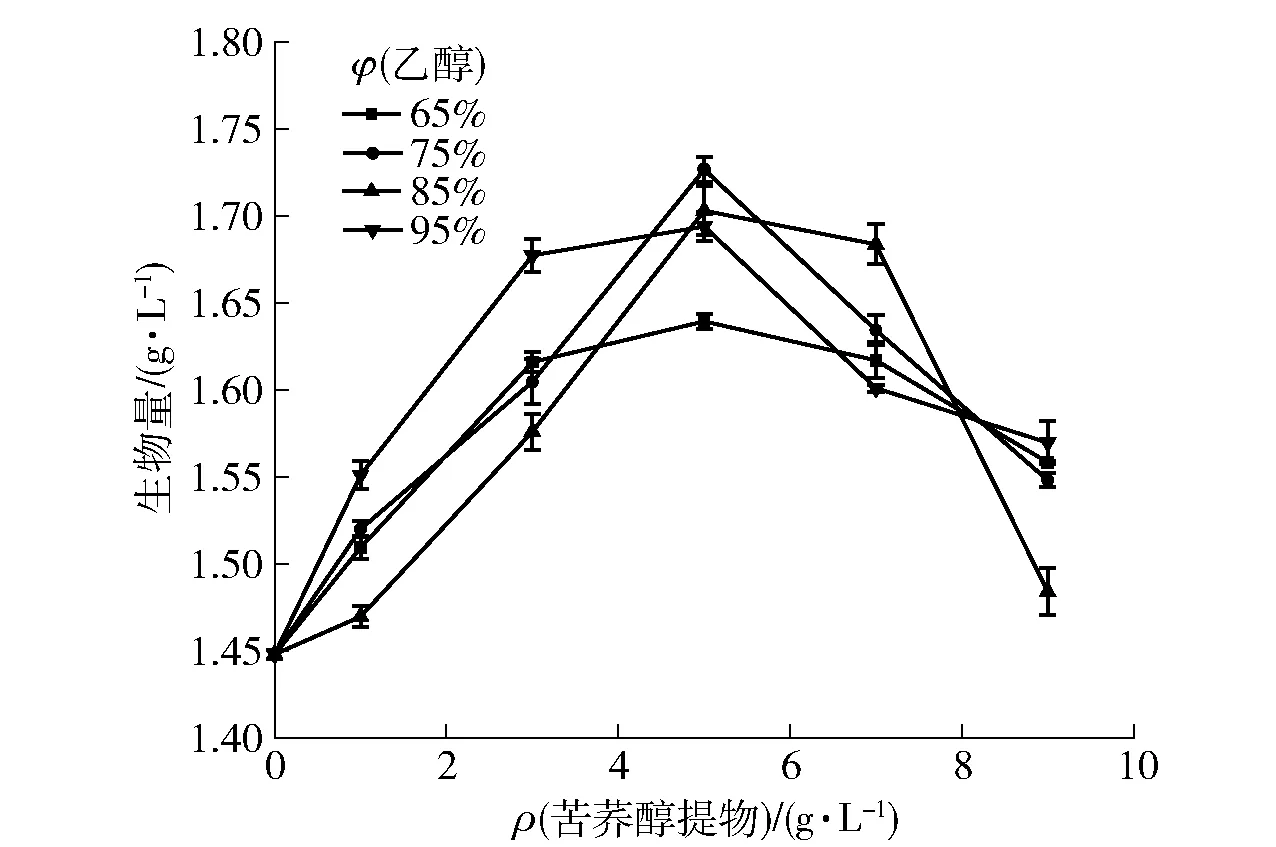
图1 不同质量浓度苦荞醇提物对灰树花生物量的影响Fig.1 Effects of different concentrations of Fagopyrum tataricum extract on biomass of Grifola frondosa
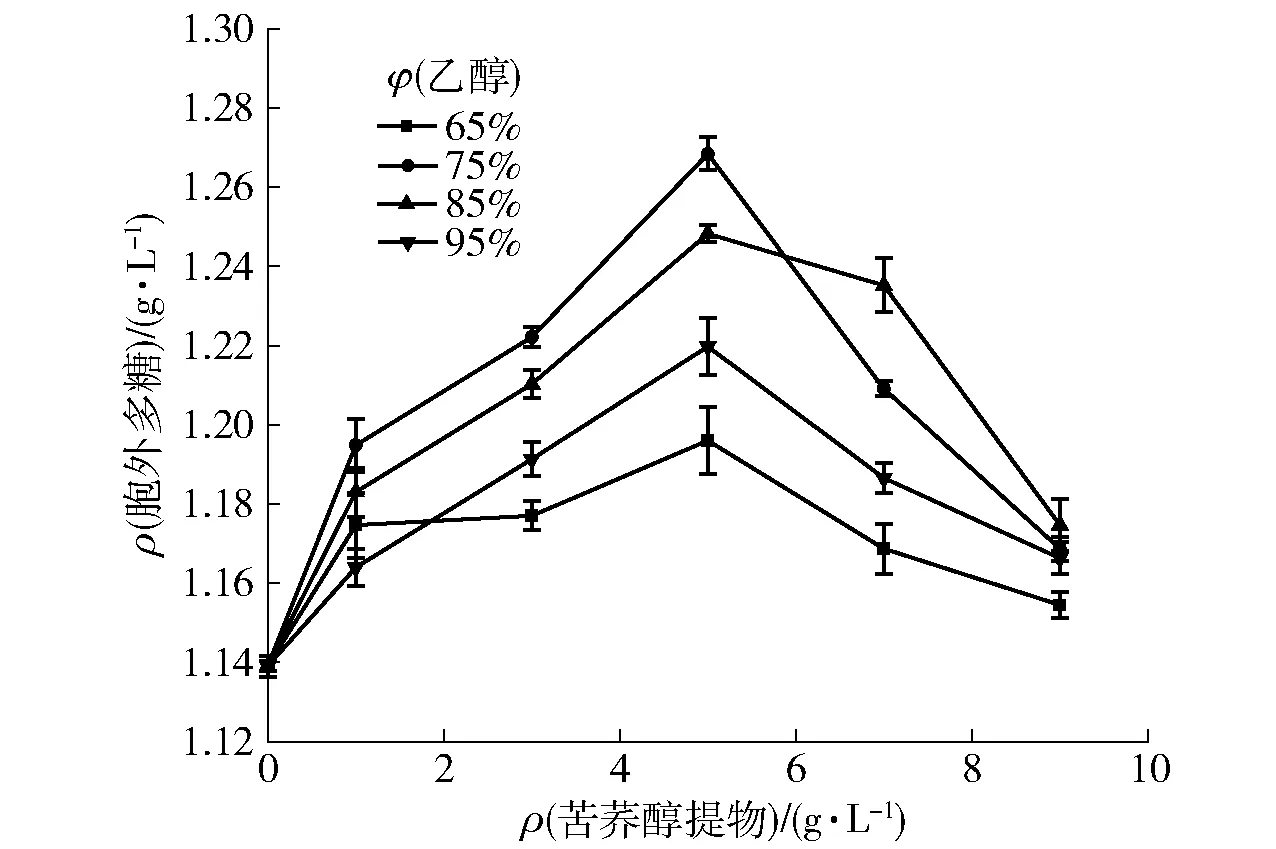
图2 不同质量浓度苦荞提取物对灰树花胞外多糖合成的影响Fig.2 Effects of different concentrations of Fagopyrum tataricum extract on synthesis of extracellular GFP
2.2 天麻醇提物对灰树花生物量和胞外多糖合成的影响
本实验室前期研究结果表明,将体积分数75%乙醇浸提天麻得到的醇提物添加到灰树花发酵液中,有益于其胞外多糖产量和菌丝体生物量增加[17]。故本实验直接在灰树花发酵体系中添加不同质量浓度的75%天麻醇提物,发酵7 d后灰树花生物量和胞外多糖的产量如图3。随着天麻醇提物质量浓度的增加,灰树花胞外多糖产量和菌丝体生物量先增加后降低。这说明一定质量浓度的天麻醇提物对灰树花发酵起到促进作用(P<0.05),而高质量浓度的天麻醇提物对灰树花的生长具有一定的抑制作用。当天麻醇提物的添加量达到7 g/L时,灰树花的胞外多糖产量和生物量分别达到最大值(1.493±0.026) g/L和(1.965±0.012) g/L,与空白组(不加天麻)相比分别增加了31.08%和35.70%。
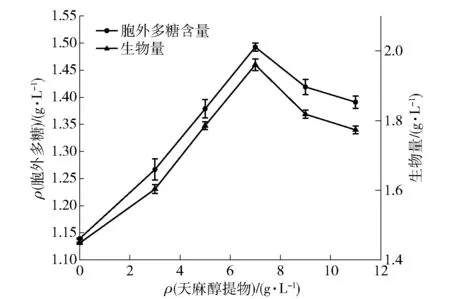
图3 天麻醇提物对灰树花胞外多糖合成和生物量的影响Fig.3 Effect of Gastrodia elata extract on systhesis of extra-cellular polysaccharide and biomass of Grifola frondosa
2.3 天麻和苦荞复配液对灰树花生物量和胞外多糖合成的影响
不同比例的天麻和苦荞复配液的添加均对灰树花的生长和胞外多糖合成有一定的促进作用,见表1。当复配液天麻醇提物的添加量为7 g/L,苦荞醇提物的添加量为5 g/L时,与空白组(不加提取物)相比,灰树花胞外多糖产量和生物量分别增加了49.08%和51.10%(P<0.01);与单一添加7 g/L的天麻醇提物相比,灰树花胞外多糖产量和生物量分别增加了13.76%和11.35%(P<0.05);与单一

表1 不同比例的天麻和苦荞复配液对灰树花胞外多糖合成和生物量的影响
添加5 g/L的苦荞醇提物相比,灰树花胞外多糖产量和生物量分别增加33.88%和26.69%(P<0.01)。这说明了一定体积的天麻和苦荞复配液对灰树花的发酵起到了良好的促进作用。在后续实验中选取复配液配比为天麻醇提物7 g/L、苦荞醇提物5 g/L加入灰树花发酵体系中。
2.4 发酵动力学分析
在灰树花发酵体系中同时添加7 g/L的天麻醇提物和5 g/L的苦荞醇提物,每隔1 d取样,研究发酵培养13 d内菌丝体生物量、胞外多糖产量以及残糖(还原糖)的变化情况。
2.4.1生物量和残糖的发酵动力学分析
在灰树花整个发酵周期中,随着培养时间的延长菌丝体的生物量不断增加,在1~3 d生长处于迟缓期,3~7 d生长处于对数期,在第7天时趋于稳定(见图4)。与空白组相比,复配组菌体生长速率较快,消耗碳源(还原糖)更多,第7天复配组生物量比空白组提高了70.40%,残糖含量比空白组降低了59.74%。其中的原因可能是在添加了天麻和苦荞复配液后,提取物中的有效成分能够促进灰树花菌体细胞的吸收,使灰树花能够利用更多的碳源物质来促进自身菌体细胞的生长。在发酵后期,葡萄糖没有消耗完,这可能由于灰树花在发酵过程中产生的酶能将底物分解为碳源物质供其利用,也可能是某些条件限制了灰树花菌体细胞的生长[17-18]。

图4 菌丝体生物量和残糖含量的动态变化Fig.4 Dynamic changes of mycelial biomass and residual sugar content
2.4.2胞外多糖和pH值的发酵动力学分析
在灰树花整个培养阶段,空白组与复配组的胞外多糖产量均逐渐增加至最大值后缓慢下降,见图5。在1~3 d胞外多糖合成速率较慢,在3~7 d胞外多糖产量迅速增加,第7天时,空白组与复配组均达到最大值(1.139±0.264) g/L和(1.698±0.138) g/L,随后胞外多糖产量开始缓慢下降,这可能是由于在发酵后期菌体细胞产生的酶将多糖分解为单糖物质导致胞外多糖的产量开始下将。此外,pH值在整个发酵周期中呈现先下降后上升的趋势,可能是在培养的前期,灰树花通过糖酵解途径以及半纤维素降解产生乳酸而导致pH值下降[19]。空白组和复配组分别在第11天和第9天时pH值开始上升,其原因是在灰树花发酵期间,观察到空白组发酵至第11天、复配组发酵至第9天时灰树花菌体由均匀的球状变细小球状悬浮于发酵液中,发酵液由澄清变浑浊。判断此时灰树花菌体细胞开始自溶,细胞破碎,导致胞内的碱性物质流出。复配组自溶的时间早于空白组2 d,这可能是因为添加了复配液后,菌丝体的生长速度更快,生长周期缩短,这在生产应用中会提高生产效率。
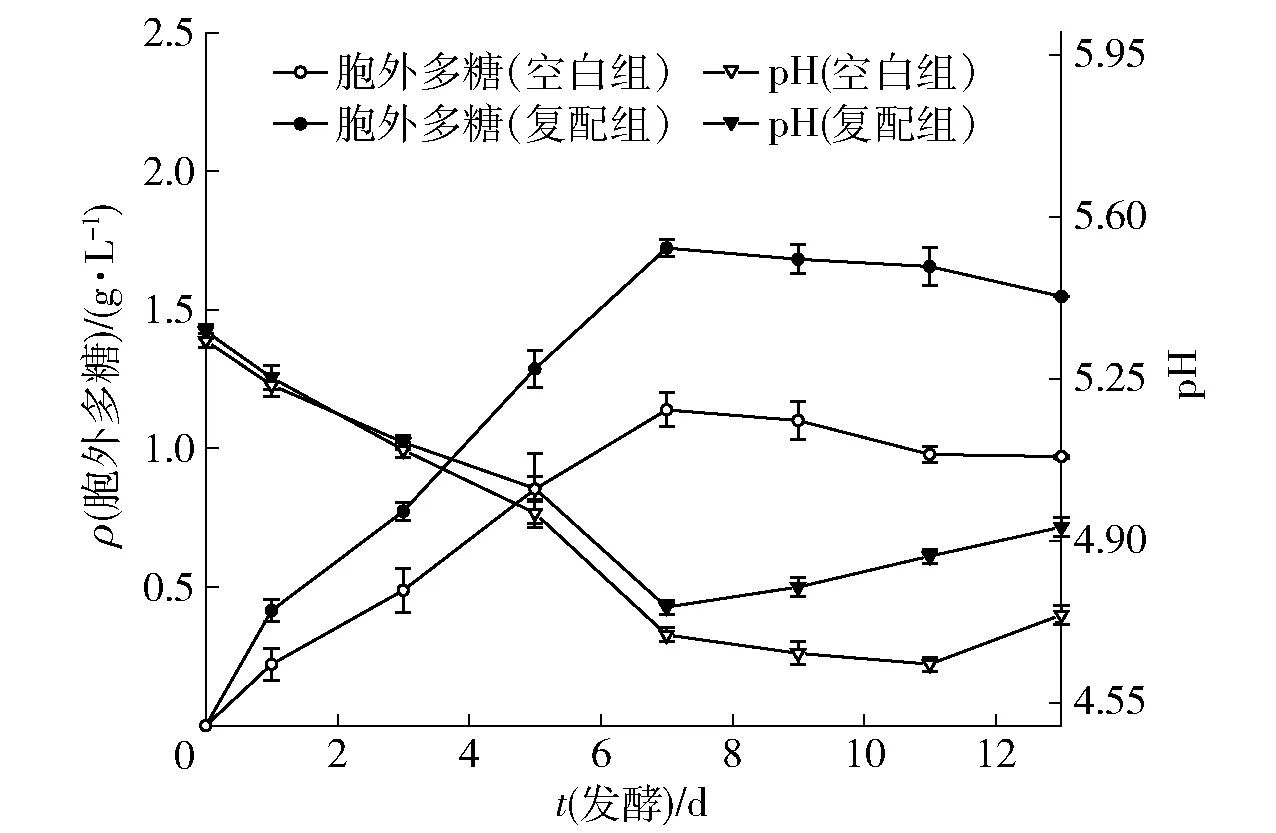
图5 灰树花胞外多糖含量和pH值的动态变化Fig.5 Dynamic changes of extracellular GFP content and pH
3 结 论
本实验研究了天麻醇提物和苦荞醇提物复配添加比例对灰树花胞外多糖合成以及菌丝体生长的影响并优化了复配比例。结果表明:当复配液中天麻醇提物添加量为7 g/L、苦荞醇提物添加量为5 g/L时效果较佳,相比空白组(未添加提取物)和单一添加组(天麻、苦荞),使胞外多糖产量分别增加了49.08%、13.76%、33.88%,菌丝体生物量分别增加了51.10%、11.35%、26.69%,均显著地高于空白组(P<0.01)和单一添加组(P<0.05)。因天麻苦荞复配液影响灰树花胞外多糖的合成以及菌丝体生长的具体机制还不明确,因此本课题组将在前期的研究基础上进一步考察天麻、苦荞提取物中的有效成分(芦丁、槲皮素、天麻素、对羟基苯甲醛、对羟基苯甲醇等)[20-22]在灰树花发酵体系中的生物转化机理,为更有效地提高灰树花菌体生物量和胞外多糖产量提供参考。
