常压室温等离子体诱变选育富硒纳豆芽孢杆菌
2020-02-05邵蕾娜王凤寰
孙 博, 邵蕾娜, 殷 娴, 王凤寰, 张 雨
(北京工商大学 轻工科学技术学院, 北京 100048)
硒元素是人体必需微量元素之一,是维持人体正常生理功能的重要营养成分,具有保护组织和细胞膜免受氧化应激反应,提高人体免疫力,保护肝脏等的生理功能[1-3]。由于硒在人体内的安全阈值很低,硒摄取量连续低于40 μg/d会出现缺硒症状,高于400 μg/d则可能产生硒中毒现象[4];因此,补硒需慎重。食品中硒的毒性和活性取决于硒的化学结构,相比于无机硒,有机硒具有更高的生物利用度和更低的毒性[5]。由于人工合成有机硒成本高且技术难度大,因此生物转化法是目前最常用的有机硒合成方法,其中以微生物作为载体研究和运用最多的是富硒酵母[6]。纳豆是大豆经纳豆芽孢杆菌(Bacillusnatto)发酵而形成的一种豆制品,具有预防中风、心脏病、骨质疏松、肥胖症及由病原菌引起的消化道疾病等的作用[7]。纳豆芽孢杆菌作为枯草芽孢杆菌的亚种,其本身具有良好的耐硒能力,可成为一种新型的有机硒微生物转化载体,具有非常广阔的开发应用前景,而使用纳豆菌诱变选育富硒载体的相关研究较少。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变具有操作简单、诱变效果好、成功率高、成本低等优点,是常用的微生物诱变技术[8]。研究旨在利用ARTP对纳豆芽孢杆菌BSN424进行诱变,以期建立ARTP诱变和筛选富硒纳豆芽孢杆菌的方法,并对突变菌株进行遗传稳定性实验,最终获得硒转化率较高、遗传稳定性较好的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1实验菌种
诱变出发菌株为一株纳豆芽孢杆菌,编号为BSN424,由北京工商大学酶工程实验室从纳豆粉中分离得到。
1.1.2培养基
LB固体培养基:酵母浸粉5 g,蛋白胨10 g,氯化钠10 g,去离子水1 000 mL,琼脂粉15 g/L,pH值7.0。121 ℃灭菌15 min。
改良大豆蛋白胨培养基:葡萄糖10 g,大豆蛋白胨10 g,七水合硫酸镁0.5 g,磷酸二氢钾2.3 g,无水氯化钙0.1 g,十二水合磷酸氢二钠1.26 g,去离子水1 000 mL,自然pH值。115 ℃灭菌15 min。
1.1.3实验试剂
酵母浸粉,英国Oxoid公司;蛋白胨、大豆蛋白胨,北京奥博星生物技术有限责任公司;琼脂粉,北京康倍斯科技有限公司,以上均为生物试剂。分析纯试剂葡萄糖、氯化钠、七水合硫酸镁、磷酸二氢钾、无水氯化钙、十二水合磷酸氢二钠、亚硒酸钠、氢氧化钠及优级纯试剂过氧化氢(体积分数30%)、盐酸、硝酸、硼氢化钾,国药集团化学试剂有限公司。
1.2 仪器与设备
ARTP诱变系统,北京思清源生物科技有限公司;LC- AFS6500型液相色谱原子荧光联用仪,北京海光仪器有限公司;Mars 6型微波消解仪,美国CEM公司;EHD- 40型电热消解仪,北京东航科仪仪器有限公司;Ecotron型恒温震荡培养箱,瑞士INFORS公司;Infinite M200型酶联免疫检测仪,帝肯(上海)贸易有限公司。
1.3 实验方法
1.3.1菌种活化
从冻藏的BSN424菌株保藏管中蘸取一环菌液,划线涂布于LB固体培养基。37 ℃恒温培养12 h后,挑取培养基上的单菌落接种于含4 mL改良大豆蛋白胨液体培养基的摇菌管中, 37 ℃、220 r/min条件下恒温培养12 h。取400 μL菌液转接到含40 mL改良大豆蛋白胨液体培养基的100 mL三角瓶中,37 ℃、220 r/min条件下恒温培养12 h,得到活化二代的种子液,备用。
1.3.2纳豆芽孢杆菌生长曲线测定
通过测定纳豆芽孢杆菌生长曲线,确定适宜的培养时间和加硒时间。种子液以1%的接种量接入到改良大豆蛋白胨液体培养基中,250 mL三角瓶中装液量为100 mL。37 ℃、220 r/min培养,每隔2 h取样,采用比浊法,测定纳豆芽孢杆菌的OD600值,绘制生长曲线。
1.3.3适宜硒质量浓度的选择
将活化好的种子液以1%的接种量分别接种于硒质量浓度不同(0、2、4、6、8、10、12、14 μg/mL)的改良大豆蛋白胨液体培养基中,37 ℃、220 r/min培养24 h,8 000 r/min离心5 min,观察菌体颜色变化,确定最适加硒质量浓度[9]。
1.3.4ARTP诱变
将培养至对数中后期的纳豆芽孢杆菌菌液离心收集,用生理盐水洗涤2次后,稀释成OD600值在0.6~0.8的菌悬液,取10 μL菌悬液滴加在载片上,涂布均匀后放入ARTP诱变系统中进行诱变,诱变条件见表1。

表1 ARTP诱变条件
将经过诱变处理后的载片置于装有1 mL生理盐水的1.5 mL离心管中,震荡洗脱60 s左右,将洗脱后的菌悬液按10倍梯度稀释6次,分别记为10-1~10-6。将10-4、10-5、10-6的稀释菌悬液涂布在LB固体培养基上,37 ℃恒温培养12 h,每个梯度做3组平行实验,未经诱变的载片作对照组,在相同条件下培养,进行平板菌落计数。通过平板菌落数来计算诱变致死率,并获得致死率曲线,致死率的计算见式(1)[10]:
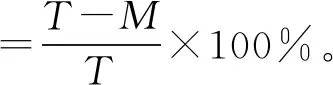
(1)
式(1)中,T为不经诱变处理的对照组平板菌落数,CFU;M为经诱变处理后的平板菌落数,CFU。
1.3.5硒含量的测定
采用氢化物发生- 原子荧光光谱仪(HG- AFS)检测硒含量。HG- AFS是一种具有我国自主知识产权的分析仪器,具有结构简单、分析成本低、气相干扰少、灵敏度高等优点[11]。检测条件见表2。
1.3.5.1 标准曲线的绘制
1 mg/mL亚硒酸钠标准溶液(以硒元素含量计)配制:准确称取亚硒酸钠109.5 mg,用去离子水定容至50 mL,过滤除菌,现用现配。取硒质量浓度为1 mg/mL的亚硒酸钠标准溶液,依次用1.2 mol/L HCl溶液稀释至硒质量浓度分别为200、160、120、80、40、20、10 ng/mL,用HG- AFS以表2条件测定标准溶液及空白对照的荧光强度,绘制标准曲线。

表2 HG- AFS检测条件
1.3.5.2 培养基中初始硒含量测定
纳豆芽孢杆菌富硒培养过程中,向培养基中添加亚硒酸钠溶液,迅速混匀,立即取样1 mL,用1.2 mol/L HCl溶液稀释10倍后,测定硒含量,即为培养过程中添加亚硒酸钠溶液时培养基中的初始硒含量。
1.3.5.3 发酵上清液中残留硒含量测定
发酵结束后,将发酵液以10 000 r/min离心10 min,并吸取1 mL上清液加入微波消解消化管中,再加入4 mL硝酸和1 mL 30%过氧化氢溶液,根据GB 14880—2012以表3条件进行消化处理[12]。
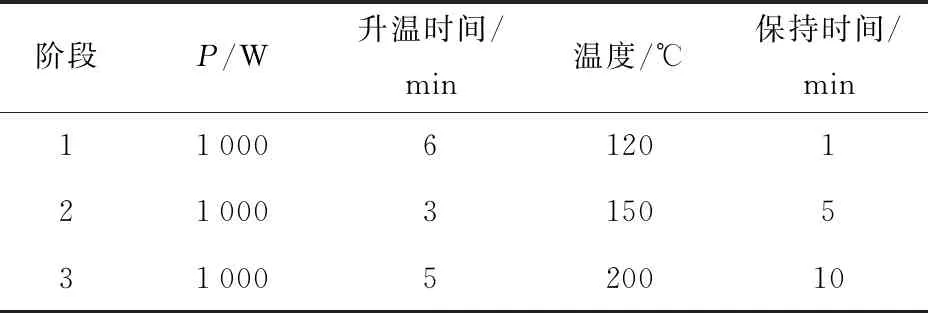
表3 微波消解条件
消解结束后,于赶酸仪上加热至管中液体体积剩余1 mL左右,冷却后加入4 mL 浓盐酸,再次加热至管中液体体积剩余1 mL左右,将六价硒还原成四价硒,冷却。用1.2 mol/L HCl溶液转移至50 mL容量瓶中定容,混匀,测定硒含量,即为发酵上清液中残留硒含量。
1.3.5.4 菌体培养物中硒含量测定
发酵液以10 000 r/min离心10 min,弃去上清液,获得菌体培养物,用磷酸盐缓冲液反复洗涤3次,以去除附着于细胞表面的硒化合物,冷冻干燥后,保存备用[13]。
准确称取10 mg菌体冻干粉末,加入微波消解消化管中,消解后测定菌体培养物中的硒含量。
1.3.6突变菌株耐硒能力测定
随机挑取经ARTP诱变后的LB固体培养基上的单菌落于每孔含有1 mL改良大豆蛋白胨培养基(硒质量浓度6 μg/mL)的96孔深孔板中,每块孔板接种93株突变菌株,3株出发菌株BSN424,共10块板。930株突变菌株于振荡培养箱中37 ℃、220 r/min恒温培养24 h后,观察菌液颜色变化情况,挑选颜色较浅菌株并使用酶标仪测定菌悬液OD600值。
1.3.7突变菌株复筛
将挑选出的耐硒能力较强的菌株接种于含适宜硒质量浓度的改良大豆蛋白胨液体培养基中,250 mL三角瓶中装液量为100 mL,37 ℃、220 r/min条件下富硒培养24 h后,测定其硒转化率和富硒量,计算见式(2)、式(3)[14]。

(2)
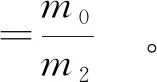
(3)
式(2)、式(3)中,m0为菌体细胞内硒质量,μg;m1为添加的总硒质量,μg;m2为菌体细胞干质量,μg;ρ0为培养基初始硒质量浓度,μg/mL;ρ1为发酵上清液硒质量浓度,μg/mL。
1.3.8突变菌株遗传稳定性测定
将复筛后富硒能力较高的突变株在LB固体培养基上连续7代传代培养,并将各代分别进行相应种子液的制备以及改良大豆蛋白胨液体培养基的发酵培养,通过比较突变菌株的富硒量来测定突变菌株的遗传稳定性。
1.4 数据处理
使用Origin Pro 2019软件对实验数据进行处理,计算相对标准偏差并绘图。
2 结果与分析
2.1 培养时间及加硒时间的确定
纳豆芽孢杆菌BSN424生长曲线如图1。培养3 h后,菌体开始进入对数期;培养24 h后,菌体开始降解。由于亚硒酸钠对菌体生长有抑制作用,加硒时间不宜过早,而在对数期,菌体生长代谢旺盛,硒转化率高。Yin等[15]研究发现,在酿酒酵母对数生长前期添加无机硒,所得酵母细胞生物量、总硒含量及有机硒比例最高。靳志强等[16]研究也发现,在对数生长初期添加亚硒酸钠得到的菌体,其总硒含量及硒转化率均最大。故从菌体生长及硒转化率方面考虑,选择在纳豆芽孢杆菌对数生长初期添加无机硒,即在培养3 h后添加亚硒酸钠溶液,培养24 h。
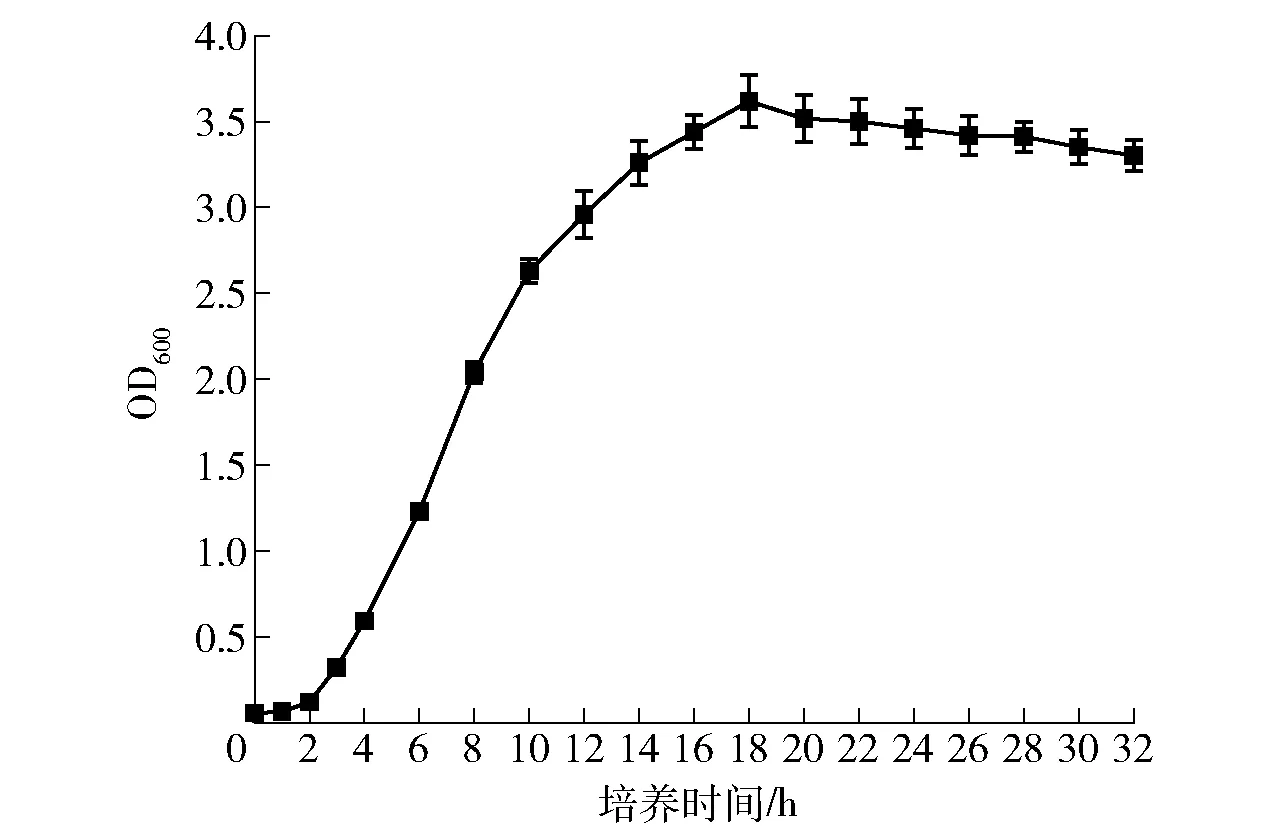
图1 纳豆芽孢杆菌BSN424生长曲线Fig.1 Growth curve of Bacillus natto BSN424
2.2 培养基中适宜硒质量浓度的确定
纳豆芽孢杆菌在一定硒质量浓度条件下可将无机硒转化为有机硒,但当环境中硒含量过高时,菌体会把大量的无机硒还原为红色的单质硒,故使菌体呈现出不同程度的红色[17]。纳豆芽孢杆菌BSN424在不同硒质量浓度条件下的菌体颜色见表4。如表4所示,在设定的硒质量浓度范围内,菌体颜色变红程度与培养基中硒质量浓度成正相关。硒质量浓度在6 μg/mL时菌体颜色变化不明显,低于6 μg/mL时颜色没有变化,说明培养基中硒质量浓度超过6 μg/mL时会使其在细胞内大量转化为红色的硒单质。为了减少单质硒的转化,使更多的无机硒在细胞内转化为有机硒,选择6 μg/mL作为培养基的适宜硒质量浓度。
2.3 ARTP诱变适宜照射时间的确定
诱变处理后根据纳豆芽孢杆菌致死率绘制致死率曲线,如图2。由图2可知,诱变致死率随照射时间增加而增大,照射20 s时可杀死90%的菌体;当照射时间达到60 s时,诱变致死率已达到100%。由现代育种理论可知,诱变致死率在90%~95%时正向突变率最高。因此实验选择的适宜诱变时间为25 s,致死率为94.3%。
2.4 突变菌株耐硒筛选结果
利用含亚硒酸钠抗性培养基的96孔深孔板培养突变菌株,并通过菌悬液OD600值和菌体颜色变化筛选突变菌株。通过对比诱变出发菌株与诱变菌株的菌体颜色,挑选出在6 μg/mL硒质量浓度下转化单质硒较少的菌株,同时再对比菌悬液的OD600值,以挑选出生长较好的突变菌株。经对比,初筛共挑选出64株耐硒诱变菌株。

表4 纳豆芽孢杆菌BSN424在不同硒质量浓度下培养24 h后菌体颜色变化
2.5 突变菌株富硒筛选结果
2.5.1硒标准曲线的绘制
HG- AFS测定的硒质量浓度标准曲线见图3,标准曲线回归方程为Y=90.505 3X+295.939 6,R2=0.999 44。
2.5.2突变菌株富硒能力分析
2.5.2.1 突变菌株的硒转化率
出发菌株BSN424及64株初筛得到的耐硒诱变菌株经摇瓶富硒发酵后测定的硒转化率见图4。
由图4可知,诱变出发菌株BSN424的硒转化率为21.8%,共有34株突变菌株的硒转化率高于出发菌株, 其中硒转化率最高的突变菌株编号为BN- I214,硒转化率达到37.8%,比诱变出发菌株高出了16%。

图2 不同照射时间下ARTP诱变致死率曲线Fig.2 ARTP mutagenic lethal rate curve with different treatment time
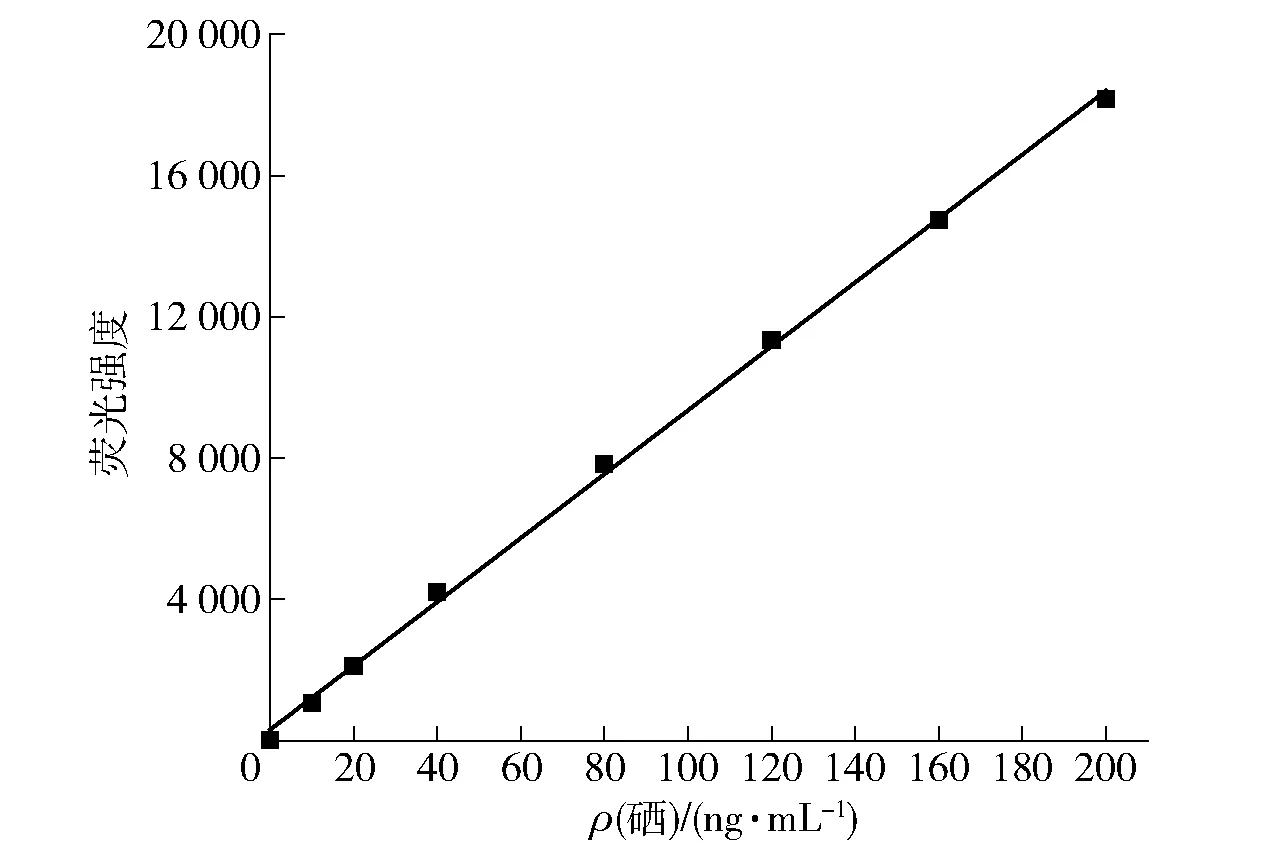
图3 硒标准曲线Fig.3 Standard curve of selenium
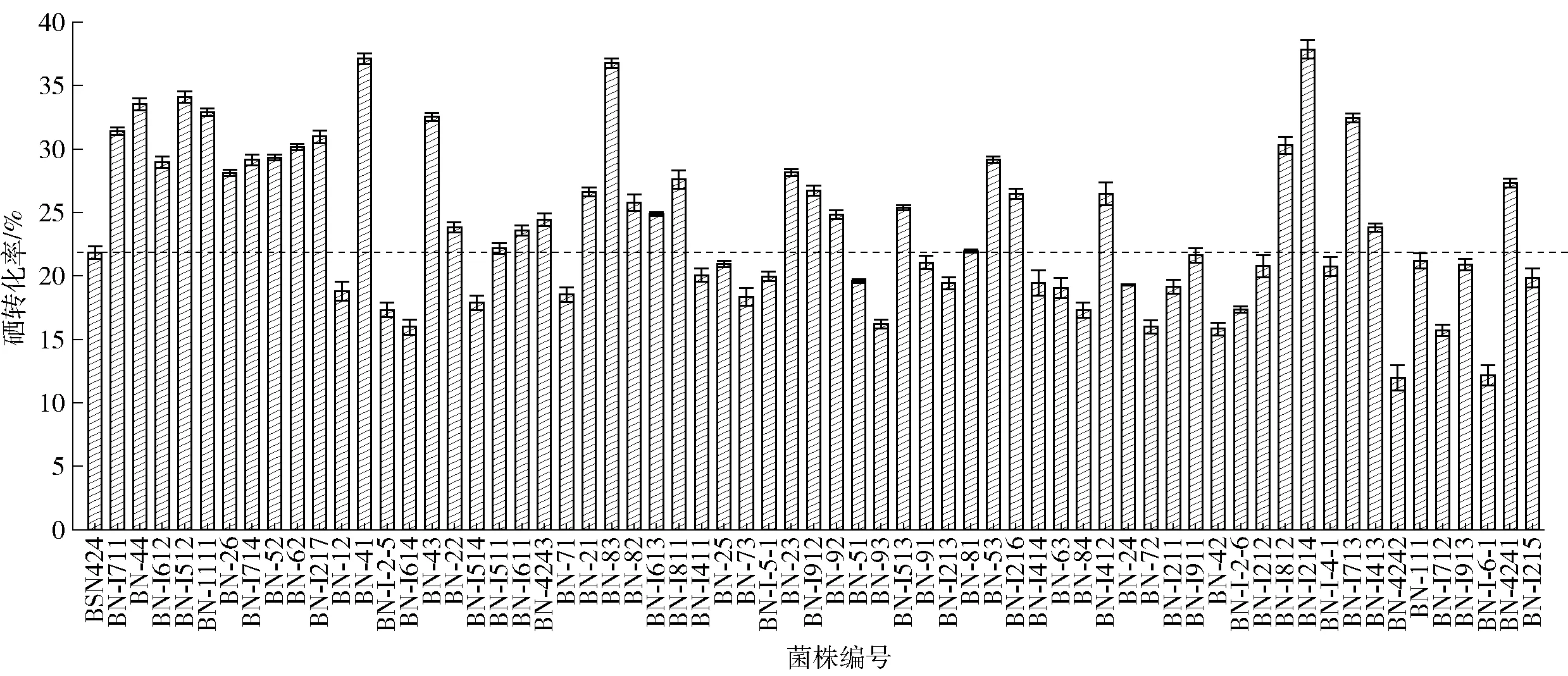
图4 突变菌株摇瓶复筛后的硒转化率Fig.4 Selenium conversion rate of mutagenic strains after shake flask screening
2.5.2.2 突变菌株的富硒量
挑选突变菌株中硒转化率最高的6株突变菌株:BN- I214、BN- 41、BN- 83、BN- I512、BN- 44、BN- 1111及诱变出发菌株BSN424,分别测定其摇瓶富硒发酵后的富硒量,见图5。
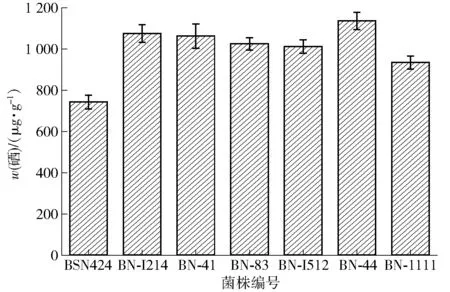
图5 突变菌株摇瓶复筛后富硒量Fig.5 Selenium content of mutagenic strains after shake flask screening
由图5可知,诱变出发菌株BSN424的摇瓶发酵富硒量为742.12 μg/g,6株突变菌株的富硒量均大于诱变出发菌株,说明以硒转化率作为筛选富硒纳豆芽孢杆菌的依据是可行的,其中突变菌株BN- 44的富硒量最高,达1 136.43 μg/g,比出发菌株提高了53.13%。
2.6 突变菌株遗传稳定性分析
用LB固体培养基分别将富硒量较高的突变菌株(BN- I214、BN- 41、BN- 44)传代7代,将各代菌株制成种子液后接种到改良大豆蛋白胨液体培养基进行富硒摇瓶发酵,测定富硒量,结果见图6。
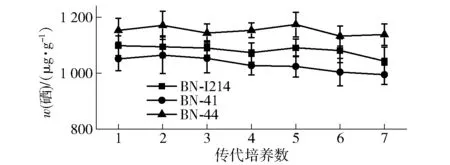
图6 突变菌株遗传稳定性Fig.6 Genetic stability of mutagenic strains
由图6可知,经ARTP诱变的3株突变菌株经传代7代后富硒量没有明显的下降,均具有较好的遗传稳定性,其中BN- 44富硒量最高。因此,综合考虑选择BN- 44菌株作为最终筛选得到的纳豆芽孢杆菌富硒诱变菌株。
3 结 论
实验通过对纳豆芽孢杆菌BSN424生长曲线的测定,确定适宜加硒时间为培养后第3小时,培养时间为24 h;通过适宜硒质量浓度的选择,确定富硒培养过程中,培养基中适宜硒质量浓度为6 μg/mL。研究表明ARTP诱变育种方法能有效地对纳豆芽孢杆菌BSN424进行诱变,适宜诱变时间为25 s,经耐硒能力、富硒能力及富硒量的测定,筛选出一株富硒纳豆芽孢杆菌BN- 44,富硒量为1 136.43 μg/g,相比出发菌株的742.12 μg/g提高了53.13%,具有较强的富硒能力。本实验以期为有机硒生物转化法中寻找益生菌富硒载体及其诱变育种提供一定依据,但突变菌株BN- 44富硒量提高的原理尚不清楚,有待进一步的研究。
